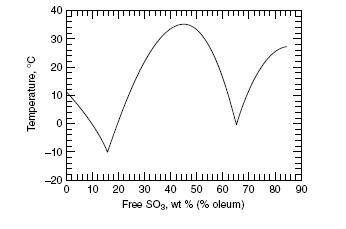
Фазовая диаграмма состояния системы серный ангидрид - вода
0% свободного SO3 соответствует 100% H2SO4; 100% свободного SO3 соответствует чистому серному ангидриду
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2009 Журнал Химиков-Энтузиастов |
Получение серного ангидрида и олеума len1, sciencemadness.org перевод с английского В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
В статье описан простой и доступный способ получения олеума и серного ангидрида путем разложения бисульфата натрия при температуре не выше 780°C. В процессе получения используется эффективная система конденсации, которая позволяет проводить пиролиз с использованием обычной вытяжки или даже без таковой (очень не рекомендуется во избежание несчастных случаев). Эффективность конденсации имеет особое значение, поскольку общеизвестно, что туманы H2SO4 создают большие трудности при их улавливании. Одновременно дается теоретическое описание процесса разложения NaHSO4, что является очень важным для понимания факторов, влияющих на выход целевого продукта реакции, а также для выявления возможных причин его уменьшения.
Полученные результаты.
Достигнут 69% выход SO3 от теоретически возможного в процессе разложения NaHSO4 (в допущении, что полученный продукт - чистый SO3). Основные потери SO3 обусловлены его улетучиванием при температурах ниже 450°C.Крепость олеума - 90% - определена отгонкой SO3. Крепость олеума 102% +/-30% - определена титрованием. (Большая ошибка обусловлена тем, что на данные расчетов очень сильно влияет точность эксперимента (см. теоретическую часть). Очевидно, что крепость более 100% невозможна). В результате разложения NaHSO4 может быть достигнут практически 100% выход H2SO4. Конечная температура процесса несколько ниже 780°C, что достигается благодаря однородному температурному полю печки, а также использования реакционного сосуда, геометрия которого обеспечивает равномерное испарение SO3/H2O из расплава с минимальным разбрызгиванием. Эффективная система конденсации паров позволяет проводить процесс под обыкновенной вытяжкой (возможно также проведение процесса без вытяжки, однако это не рекомендуется во избежание несчастных случаев). Побочное образование SO2 не наблюдалось. NaHSO4 плавится при 185-195°C, выделение паров H2O начинается около 220°C, образование белых паров SO3 (в форме разбавленной H2SO4) начинается при 260°C. Далее содержание кислоты в парах возрастает и при 340°C из вязкой реакционной смеси начинает отгоняться конц. H2SO4. Если температура была поднята от 185 до 450°C на протяжении 5 часов, реакционная масса не затвердевает, пока не будет достигнута "нормальная" точка разложения Na2S2O7. Таким образом, распространенная интерпретация термолиза как двухстадийного процесса: 2NaHSO4 => Na2S2O7 => Na2SO4 при котором сначала выделяется H2O, а только потом SO3, является очень упрощенной. Стадии насколько накладываются, что систему целесообразно рассматривать как смесь Na2S2O7/Na2SO4/H2O (или, что равнозначно - Na2SO4/SO3/H2O), соотношение компонентов в которой меняется с температурой. Представляется весьма вероятным, что эти соотношения также зависят от временного режима нагрева, который может являться фактором, дающим возможность увеличить выход продукта. Данный вопрос не исследовался, и в экспериментах был использован одинаковый режим нагрева (5 часов, 185-450°C). SO3 обладает рядом интересных свойств: в изолированной от атмосферы пробирке при 10°C его пары, которые находятся над твердым телом, практически невидимы, но стоит открыть пробирку, как появится густой туман. Пары SO3 даже при 10°C обугливают любую органику - внутренняя часть полиэтиленовой трубки немедленно обуглилась, черные пятна появляются на стеклянной посуде, содержащей даже следы органики - предварительно эта посуда была тщательно вымыта в посудомоечной машине. Серный ангидрид действует как "проявитель отпечатков пальцев". Если необходимо избежать изменения цвета продукта и получить белоснежный SO3, следы органики на стекле должны быть тщательно удалены хромовой смесью. Стекловата легко выдерживает нагрев до 800°C, но ее желтый пигмент обугливается, поэтому стекловату необходимо нагреть при 500°C для выжигания пигмента. Система SO3/H2O активно действует на железо при 400°C. Возникла идея использовать данный процесс для перевода этой смеси в SO3, причем на выходе из реакционных трубок была бы достигнута почти 100% эффективность разделения. К сожалению, при этом наблюдался запах SO2. Исследование продуктов после охлаждения реактора показало наличие внутри FeSO4, а также FeS. Образование последнего было подтверждено выделением H2S при добавлении воды к смеси кислот внутри трубки. Количество серы, восстановленной от +6 SO3 до -2 в FeS, наглядно демонстрирует, что среда внутри трубки обладает сильными восстановительными свойствами, и если трубка не покрыта футеровкой, то она является полностью не пригодной в качестве реакционного сосуда для пиролиза NaHSO4. В отличие от SO2, SO3 не имеет запаха, который мог бы предупредить о его присутствии, в то же время его пары является чрезвычайно сильным коррозионным и канцерогенным агентом. К счастью, пары SO3 видимы - и это свойство необходимо использовать, чтобы избежать с ними контакта. Теория Система SO3/H2O. Систему, содержащую серную кислоту, можно представить как смесь H2O и SO3: a H2SO4 + (b - a) H2O = a SO3 + b H2O. Представленное уравнение не соответствует реальному равновесию. Точная структура системы намного сложнее, правая и левая части уравнения скорее представляют собой два различных способа, полезных при описании данной системы. Смеси, для которых b >> a являются растворами серной кислоты, случай b = a соответствует 100% H2SO4, а когда b < a, мы имеем дело с олеумом, который может быть жидким или твердым в зависимости от состава. Данная особенность олеума (b < a) обусловлена структурой немонотонной фазовой диаграммы, которая содержит два максимума. При комнатной температуре (20°C) олеум является твердым в интервале концентраций 30%-60% SO3, и снова при >75% SO3. По этой причине при концентрации свободного SO3 >75% невозможно определить содержит олеум больше или меньше SO3, исходя только из факта появления твердой фазы. Необходим количественный анализ. Система обладает гистерезисом, поэтому определение температуры плавления является очень ненадежным. Более предпочтительным является титрование или проведение отгонки SO3. |

Фазовая диаграмма состояния системы серный ангидрид - вода 0% свободного SO3 соответствует 100% H2SO4; 100% свободного SO3 соответствует чистому серному ангидриду |
|
В приведенном выше уравнении значение b = 0 соответствует чистому SO3, белому легкоплавкому веществу с температурой плавления 32°C и точкой кипения 44°C. Довольно узкий температурный интервал, в котором соединение является жидкостью, создает трудности для процесса конденсации при получении SO3 методом пиролиза. Серный ангидрид легко полимеризуется (процесс усиливается под действием H2O и ингибируется P2O5). Вещество образует три модификации с температурами плавления 32°C, 62°C и 95°C.
Если перегонять серную кислоту с b >> a, первоначально будет отгоняться разведенная кислота, причем содержание SO3 будет постепенно увеличиваться, вплоть до достижения точки кипения азеотропа 98%/2% H2SO4/H2O при 337°C. После этого дальнейшее увлечение концентрации SO3 является невозможным. Следовательно, перегонка не может быть использована для получения олеума/SO3, с другой стороны получать концентрированную кислоту из разбавленной этим методом весьма нерационально. |

Серный ангидрид (триоксид серы SO3) - льдоподобная модификация |

Серный ангидрид (триоксид серы SO3) - асбестоподобная (волокнистая) модификация |
|
Система SO3/H2O/Na2SO4
Один из способов получения SO3 основан на использовании кислой соли NaHSO4. Данное вещество можно синтезировать исходя из эквимолярной смеси 100% H2SO4 и средней соли Na2SO4. Водный раствор NaHSO4 эквивалентен такой смеси:2NaHSO4 = H2SO4 + Na2SO4
Под этим выражением следует, прежде всего, понимать соотношение эквивалентности (как и в случае первого уравнения). Поскольку у раствора NaHSO4 относительно высокий рН (1 М раствор имеет рH~2), из приведенного уравнения мы видим, что присутствие Na2SO4 оказывает значительное буферное действие на pH раствора H2SO4, который в случае эквимолярной смеси увеличивается от pH << 0 до pH ~ 2. Таким образом, Na2SO4 проявляет свойства слабого основания, что может объяснить, почему пиросульфат разлагается при относительно низкой температуре (сравните с реакцией CaSO4 => CaO + SO3, которая идет при 950°C < T < 1200°C, т.к. CaO является значительно более сильным основанием). Приведенная выше уравнение не только описывает эквивалентное соотношение в системе, оно также соответствует реакции, которая может быть осуществлена на практике. Действительно, H2SO4 может быть отогнана при разложении кислой соли NaHSO4. Установлено, что эффективность процесса достигает 97%. Сбор дистиллята в виде единой фракции дает 100% H2SO4 с выходом 97%. В отличие от системы SO3/H2O, в системе Na2SO4/SO3 отбор высококипящих фракций позволяет получить олеум; более низкокипящая фракция представляет собой более разбавленную кислоту (а смесь этих фракций дает 100% H2SO4). Можно сказать, что добавка Na2SO4 к H2SO4 устраняет образование азеотропа. В идеализированном виде процесс дистилляции можно представить как совокупность двух реакций, первой из которых является отгонка воды: 2NaHSO4 => Na2S2O7 + H2O; 200°C < T < 650°C в результате второй реакции происходит выделение SO3 и образование соли, которая является слабым основанием: Na2S2O7 => Na2SO4 + SO3; 260°C < T < 780°C
Приведенные температуры были установлены опытным путем, а не взяты из литературных данных, которые почти отрицают перекрытие температурных интервалов приведенных реакций. В действительности обе реакции протекают одновременно в широком промежутке температур, при этом система представляет собой сложную смесь NaHSO4/Na2S2O7/Na2SO4. В то же время, основное количество Н2О выделяется при 200-260°C, когда улетучивание SO3 почти не имеет место, с другой стороны, основная часть SO3 не отгоняется до тех пор, пока температура не достигнет 780°C, тогда выделение воды уже не наблюдается. Именно на этом и основан принцип разделения SO3 и Н2О в процессе пиролиза NaHSO4. Тем не менее, доля SO3, который выделяется ниже "нормальной" температуры деструкции пиросульфата - 450°C, в данном эксперименте составляет около 30%. Именно это и является основным фактором, уменьшающим выход SO3, который в нашем случае составлял 69%. Кроме того, часть воды выделяется одновременно с SO3 при температуре, что соответствует нижней границе протекания второй реакции - 650°C. Этот факт доказывает, что образование пиросульфата является упрощенной идеализацией, в действительности мы имеем дело со сложной смесью Na2SO4/H2O/SO3, которая существует при различных температурах. Эффективность разделения компонентов H2O/H2SO4/олеум/SO3 зависит от гомогенности гидросульфатной композиции (перегонка 100% H2SO4 с эквимолярным количеством Na2SO4 добавленным без предварительного перемешивания приведет к образованию 100% кислоты), а также от скорости нагрева смеси. Понятие выхода и крепости олеума
Следует тщательно оговорить, что подразумевается под выходом продукта в данной системе. Простейшее определение выхода H2SO4 основано на следующем: 100% выход соответствует отгонке (в форме SO3 и H2O) 50% сульфата из NaHSO4 с образованием Na2SO4 в твердом остатке. Однако, многих интересует получение в данном процессе олеума. Для такого варианта процесса, который требует отбора только части дистиллята, выход можно рассчитать исходя из того какая доля SO3 была собрана в приемнике в виде олеума с заданной концентрацией. Очевидно, что чем выше требуемая крепость олеума, тем выше температура, при которой начинается отбор фракции и тем ниже выход. Под крепостью олеума понимают процентное содержание свободного SO3 по отношению к общему весу олеума. Свободным считается SO3, который содержится в системе сверх количества, необходимого для образования 100% H2SO4. Для расчета крепости олеума, который содержит a весовых частей SO3 и b H2O используют формулу: [a - b · (80/18)] / (a + b) 100% SO3 (b=0) соответствует 100% олеуму, а 100% H2SO4 соответствует олеуму с крепостью 0%, который не содержит свободного SO3, который может быть отогнан дистилляцией. При рассмотрении данной формулы можно объяснить трудности, что имеют место при экспериментальном определении концентрации олеума. Вода имеет низкую молекулярную массу, следовательно, ее вес умножается на коэффициент 4.4 (80/18), в результате чего небольшие ошибки в определении массы воды приводят к значительным ошибкам в крепости олеума. С другой стороны, всего лишь 18 гр. Н2О достаточно, чтобы превратить 80 гр. SO3 (100% олеум - легкоплавкое твердое вещество, которое испаряется при 44°C и содержит только свободный SO3), в обыкновенную серную кислоту, которая кипит около 300°C (0% олеум, который не содержит свободного SO3). Следовательно, используемая для синтеза посуда должна быть предварительно высушена во избежание уменьшения выхода. В данной работе отбиралась фракция с температурой кипения от 460°C, что позволяет получить олеум с крепостью 80-100% (большая неопределенность концентрации объясняется причинами, изложенными выше) и выходом 69% - согласно данным титрования свободного SO3. При отборе всего дистиллята выход H2SO4 составляет 97%. Кислотно-основное равновесие между сульфатом и гидросульфатом
Анион гидросульфата является слабым основанием, в соответствии с низким значением константы равновесия:pH раствора HSO4- HSO4- => SO42- + H+, [SO42- ][H+]/[HSO4- ] ~ 10-2 => pKa ~ 2 Значение pKa = 2 существенно больше такового для воды pK = 7, поэтому можно пренебречь протонами, которые образуются при диссоциации воды. С другой стороны, уменьшением количества HSO4- вследствие его диссоциации в растворах с концентрацией 1 М также можно пренебречь. Для начальной концентрации с имеем: [H+] = (c 10-2)1/2 => pH = 1 - 1/2 log c pH раствора SO42-
Данный раствор является слабым основанием, и мы должны использовать ионное произведение воды:[H+][OH- ] ~ 10-14 и уравнение массового баланса протонов [H+]: [OH- ] = [H+] + [HSO4- ] Мы пренебрегаем протонизацией SO42-, концентрация которого равна c (учитывая малое значение pKa, как было отмечено выше) [H+]2 + [H+][HSO4- ] = [H+]2 + [H+]2 c / 10-2 = 10-14 следовательно: pH = 8 + 0.5log c Для 1 М раствора Na2SO4 следует ожидать pH ~ 8. Методология
Все описанные ниже операции были проведены под вытяжкой, работа велась в респираторах и резиновых перчатках в лаборатории, оборудованной осушителем.Температура в лаборатории - 25°C. Процесс разложения NaHSO4 может быть выполнен в одну стадию, но это связано с дополнительным контактом работающего с парами SO3, что имеет место при замене приемника и конденсатора. Следовательно, процесс был проведен в две стадии, что обеспечило выполнение операций, связанных со вскрытием шлифов установки при более низкой (комнатной) температуре. Пример подобной процедуры описан в практикуме по неорганической химии Ю. Третьякова, ст. 235 "После завершения выделения SO2 при действии серной кислоты на сульфит натрия, содержимое было помещено в фарфоровый тигель, который нагревали на песчаной бане до полного отвердения содержимого. Твердый остаток был помещен в термостойкую реторту, горлышко которой охлаждалось ледяной водой. Реторта была нагрета на газовом пламени, SO3 конденсировали в пробирку, которую после опыта запаивали." |
(на рисунке изображен несколько другой процесс - прим. перев.) |
|
Удаление низкотемпературной фракции.
Под действием давления из нагретой установки возможен выброс SO3. Попадание SO3 в глаза приведет к неминуемой слепоте. Используйте защитные очки (маску) и будьте предельно осторожны. 329 гр. NaHSO4 поместили в фарфоровый тигель и нагрели на песчаной бане под вытяжкой. Первоначально температуру бани поддерживали равной 250°C, пока соль не расплавится - это происходит около 190°C (данные измерения температуры поверхности расплава ИК-термометром). Когда температура расплава достигла 210-220°C, началось выделение паров воды, однако оно прекратилось приблизительно через 20 мин - при достижении расплавом температуры 220°C. Фотография расплава приведена ниже. Когда температура бани достигла 350°C, и расплав нагрелся примерно до 260°C, началось выделение густых белых паров серной кислоты. Выделение паров продолжалось при возрастании температуры расплава до 285°C на протяжении примерно 90 мин., повышение температуры ограничивалось теплом, необходимым для испарения серной кислоты. Далее температура бани была установлена на уровне 450°C, температура поверхности повысилась до 337°C и оставалась относительно постоянной примерно в течение часа. По-видимому, это объясняется испарением азеотропа H2SO4. Отгонка была прекращена, когда температура поверхности расплава достигла 425°C (и около 450°C в объеме), при этом реакционная смесь кипела и превратилась в вязкую жидкость, насыщенную пузырьками SO3/H2O. |

|
|
Ни на каком промежутке температур в интервале между нормальными точками плавления NaHSO4 и Na2S2O7 не наблюдалось затвердевание расплава. Абсолютно очевидно, что существенная часть SO3 испарилась именно на данной стадии (это подтверждается уменьшением выхода продукта, которое было отмечено в результате эксперимента). Вероятно, этого можно частично избежать, экранируя расплав от атмосферы - реакция SO3 с влагой воздуха (в дополнение к воде, которая испаряется с поверхности расплава) SO3 + H2O => H2SO4 уменьшает парциальное давление SO3 и согласно принципу Ле Шателье усиливает его испарение. Также вероятно, что выход мог быть увеличен, если бы расплав был выдержан при 240-260°C более чем два часа. Однако, при термостатировании смеси выделение паров со временем значительно ослабевало, кроме того, NaHSO4 - очень дешевый реактив, поэтому экономию рабочего времени следует считать более существенным фактором.
Полученный продукт весил 272 гр. Если бы из смеси улетучивалась только вода, вес остатка составлял бы 304 гр. Следовательно, если допустить, что полученный материал состоит только из смеси Na2S2O7/Na2SO4 (вся H2O испарилась), то можно сделать вывод, что 32 гр. SO3 (или 29% от теоретического) улетучились вместе с H2O в форме H2SO4 во время описанной выше процедуры нагрева. При охлаждении сульфаты уменьшают свой объем сильнее, чем фарфор (в противоположность смеси NaCl/CaCl2, которая растрескивает фарфор), поэтому они могут быть легко отделены путем переворачивания тигля и легкого постукивания. Далее материал был измельчен и размолот в ступке. |

|
|
Пиролиз и отбор высокотемпературной фракции.
Итак, материал помещен в реакционный сосуд, который представляет собой дозатор уксуса стоимостью 50 центов. Данная емкость с легкостью выдерживает 800°C, в процессе работы произошел случай, когда она была помещена в печь при почти вдвое большей температуре. Емкость, однако, предназначена для работы при градиентах температуры, близких к таковым в нашей повседневной жизни, поэтому от резких градиентов температур сосуд непременно расколется, что и случалось в ходе экспериментов (нашим химикам придется подыскать что-то эквивалентное этому фарфоровому сосуду - поскольку вещи, соответствующей приведенному описанию, в отечественных хозмагах нет - прим. перев.). Следовательно, отрезок трубки из боросиликатного стекла (которое имеет один из наименьших коэффициентов расширения по сравнению с другими сортами стекла и температуру размягчения 821°C) был использован как материал, способный выдержать большой градиент температур, который имеет место в работающей установке (прекрасно подойдет и кварцевое стекло, если оно есть в наличии - прим. перев.). Герметизация соединения осуществлялась с помощью накручивания стекловаты. В случае, если необходимо избежать примесей обугленной органики, окрашенную стекловату необходимо выдержать при 500°C для выгорания красителя. 97 гр. смеси, полученной после первой стадии, было помещено в реакционный сосуд. Учитывая форму реакционного сосуда, не стоит его заполнять слишком сильно, в то же время, наклонное расположение реактора делает поверхность расплава максимальной. Несмотря на всю свою простоту, именно эта процедура позволяет обеспечить почти 100% выход (как будет показано ниже).
|

|
|
Далее в конец трубки было вставлено колено, изогнутое под углом 120 градусов. Данный участок нагревается до 200°C, причем следует позаботиться, чтобы он не остыл, когда ток SO3 ослабеет (иначе возможна преждевременная конденсация SO3). Поэтому участок был покрыт стекловатой. Данная установка работала довольно хорошо, за исключением того обстоятельства, что пигмент, который содержался в стекловате, обугливался и придавал коричневый оттенок первым порциям дистиллята олеум/SO3. Длинная стеклянная трубка с тщательно подогнанными концами (чтобы минимизировать потери) служила воздушным холодильником. Далее находилась U-образная трубка, помещенная в воду с температурой ниже 10°C, в ней происходило накопление продукта. Поскольку пары H2SO4 образуют туман, который уловить очень трудно, на выходе из U-образной трубки помещался дополнительный конденсатор (холодильник), охлаждаемый с помощью небольшого водяного насоса, который соединен с охлаждающим резервуаром. Выхлоп из конденсатора попадал в полиэтиленовый шланг, который можно было вывести наружу, однако это оказалось излишним т.к. после последнего конденсатора не оставалось паров. В керамической плите дверцы печки была проделано отверстие для выхода трубки из боросиликатного стекла, которое уплотнили листом асбеста, как показано ниже.
|

|
|
Начальная температура печки была выставлена на уровне 300°C, после достижения равновесия температуру поднимали примерно на 200°C в час. При нагревании примерно до 520°C никаких процессов не было отмечено, если не считать 1-2 капель H2SO4, которые конденсировались в изогнутой трубке и стекали назад, образуя своеобразный аппарат фракционной дистилляции. Та же смесь на первой стадии давала большое количество дыма во время нагревания при 450°C, следовательно, этот процесс в основном обусловлен наличием атмосферной влаги, которая отсутствовала в реакционной трубке. При 550°C белый туман заполнил воздушный конденсатор, а при 600°C его выделение усилилось. Туман заполнил U-образную трубку, в то время как в последнем холодильнике наличие тумана не отмечено, что подтвердило эффективность процесса конденсации. В данном интервале температур эффективное накопление какого либо продукта не наблюдалось. При 650°C в средине U-образной трубки начал собираться твердый олеум, эта температура поддерживалась до тех пор, пока не исчез туман в воздушном конденсаторе.
|

|
|
Повышение температуры до 700°C привело к появлению большого количества плотных белых паров, в конденсаторе стекали струйки жидкости, а в коротком колене изогнутой трубки начали опускаться вниз капли олеума. Под действием паров пигмент стекловаты обуглился. U-образная трубка полностью покрылась твердым конденсатом, дым заполнил несколько первых витков конденсатора, но не более, - верхняя часть холодильника оставалась свободной от аэрозоля. Когда воздушный конденсатор освободился от дыма, температуру снова повысили, такая процедура была повторена при 750°C и 780°C. В последнем случае образование значительных количеств SO3 закончилось, дальнейший нагрев установки до 800°C, а потом и 820°C не привел к образованию конденсата. Последующее взвешивание показало почти 100% эффективность перегонки.
С помощью ИК термометра было установлено, что боросиликатная трубка нагрелась до 220°C в месте, расположенном за 2 см. от выхода из печки и до 120°C в месте соединения с коленом, изогнутым под углом 120 градусов, в это время температура печи достигала максимального значения - 820°C. Воздушный конденсатор при прохождении основной массы продукта нагревался до 80-90°C. Стеклянная трубка продемонстрировала хорошую термостойкость, при необходимости в установке могла быть использована более высокая температура. На рисунках (см. ниже) изображены капли олеума, который конденсируется, а также его белые пары. Произошло практически полное обугливание ближней части полиэтиленовой трубки, соединенной с холодильником. Это случилось при полном отсутствии аэрозоля в верхней части конденсатора, то есть за счет остаточного давления паров SO3 при 10°С. Таким образом, полиэтиленовая трубка является очень полезным индикатором присутствия паров SO3 на выходе из установки. Обращает на себя внимание, что на фотографии излучение из нагретого муфеля кажется фиолетовым (что соответствовало бы температуре около 5000 К), это обусловлено искажениями цвета, которые часто имеют место при съемке: на самом деле цвет при максимальной температуре был ярко-оранжевым. |


|
|
Муфель был выключен, установка разобрана. Конденсатор, который был свободен от аэрозоля на протяжении всей процедуры, после отсоединения от установки стал дымить (см. рисунок ниже).
|

|
|
U-образную трубку отсоединили и плотно закрыли, вес ее содержимого составлял 26.9 гр. Она была быстро завернута в целлофан и помещена в холодильник. Это было сделано с целью предотвращения активного выделения опасных паров SO3. Откровенно признаюсь, что опасность, которую представляет это вещество, меня пугала.
|

При попадании в глаза распыленного SO3 моментально наступит слепота. Пользуйтесь защитными очками и будьте осторожны. |
|
Расчеты, выход и крепость олеума.
Остаток в реакторе после пиролиза весил 67.2 гр. Расчетное количество остатка, который должен образоваться вследствие пиролиза 2NaHSO4 => Na2SO4 + SO3 + H2O из 97 г промежуточного продукта (взятого для отгоники олеума после того, как в результате предварительного нагрева 329 гр NaHSO4 в тигле масса содержимого уменьшилась до 272 гр.) составляет 69.4 гр. [1]. Таким образом, эффективность процесса отгонки практически составляет 100% (эта величина может быть слегка завышена в результате присутствия влаги в "безводной" соли). Данный вывод подтверждается фактом, что при 780°С реакция практически заканчивается. Суммарная масса Na2SO4 (67.2 гр.) и отогнанного олеума SO3/H2O (26.9 гр.) составляет 94.1 гр., что соответствует 97% эффективности процесса пиролиза, потери обусловлены той небольшой частью SO3 или H2O, которая вышла за пределы установки. Нетрудно подсчитать, что теоретическое количество SO3, которое можно получить из 97 · 329 / 272 = 117 гр. исходного NaHSO4 равно 39.1 гр. Если принять, что полученный продукт представляет собой чистый SO3, выход составляет 26.9 / 39.1 = 69% от теоретического. Однако, как было отмечено в теоретической части, полученный продукт представляет собой олеум, крепость которого еще предстоит определить. Присутствие воды может исказить (завысить) величину выхода (но не сильно т.к. молярная масса воды небольшая). Заключительная стадия работы состоит в нахождении соотношения H2O/SO3 и определении крепости олеума для фракции, отобранной начиная с 450°C. Анализ можно провести двумя методами. Во-первых, это титрование. Однако, метод очень неудобен из-за необходимости контакта с парами SO3. Альтернативный метод основан на факте, что отгонка проходила практически со 100% эффективностью. Соотношение H2O/SO3 (имеется в виду "свободный" SO3, который способен отгоняться - прим. перев.) в смеси, использованной для термолиза такое же, как и в полученном олеуме. Следовательно, исходную смесь можно титровать BaCl2 - для определения общего содержания сульфатов, или щелочью - для определения SO3, который улетучивается при термолизе Na2S2O7 и NaHSO4. В данной работе был выбран последний вариант. 11.2 гр. продукта, полученного на первой стадии, растворили в 100 мл. H2O и оттитровали 2% NaOH (точность приготовления раствора - 3%). Для того, чтобы изменить рН раствора от начального pH < 1 до 8.40 в конечной точке титрования потребовалось 3.62 гр. NaOH. Интересно, что к раствору было совсем не обязательно добавлять индикатор (или использовать для титрования рН-метр). Цвет раствора изменялся от бесцветного до насыщенно-желтого в процессе прибавления последних 0.5 мл. титранта (см. рис.). Одновременно выпало небольшое (около 0.1 гр.) количество желто-оранжевого осадка (вероятно - коллоидная сера). Таким образом, в навеске полученного на первой стадии продукта массой 11.2 гр. содержится 3.62 гр. SO3 (NaOH и SO3 реагируют в массовом соотношении 1:1). Содержание Na2SO4 было определено из пропорции: после прокаливания 97 гр. продукта образовался остаток массой 67.2 гр., следовательно, 11.2 гр. продукта содержат ~ 7.7 гр. Na2SO4. Теперь рассчитывает содержание Н2О: 11.2 (+/- 1%) - 3.62 (+/-3%) - 7.7 (+/-2%) = (-0.12 +/- 0.3) гр. H2O Таким образом, 11.2 гр. продукта содержит от 0 до 0.28 гр. воды (отрицательные числа исключаем). Подставляя эту величину в формулу для расчета крепости олеума, получаем значение > 72% (правда, с доверительным интервалом 70%). __________________________________________ 1 Напомню, изначально было взято 329 гр. NaHSO4. Вещество нагрели в тиле для удаления воды, масса полученного остатка - 272 гр. Из этих 272 гр. для отгонки олеума было взято только 97 гр. (поскольку объем реактора для отгонки был слишком мал, чтобы сразу загрузить 272 гр. продукта). 97 гр. остатка соответствует 97 · 329 / 272 = 117 гр. исходного NaHSO4. ( - Прим. перев.) |

|
|
Отгонка SO3 из олеума
Как было отмечено во вступлении, количество SO3 в олеуме можно определить путем отгонки. В данном случае мы напрямую определяем вес SO3, который может быть отогнан из олеума данной крепости, а не вес H2O, поэтому метод значительно более чувствителен, чем описанное выше титрование. В процессе дистилляции возникает опасность контакта работающего с парами SO3, естественно, процесс следует проводить под хорошей тягой. Как и в случае любого процесса дистилляции следует выбрать температуру отбора фракций. В данном случае нагрев производился при 100°C, что было удобно для эксперимента, т.к. позволило использовать водяную баню. Выбор данной температуры был своеобразным компромиссом, учитывая, что некоторое количество воды может улетучиться вместе с SO3, а часть "свободного" SO3 остаться в перегоночной колбе. Давление паров воды над 0% олеумом (100% H2SO4) при 100°C минимально, в то время, как олеум, который остался после перегонки при этой температуре еще содержал 37% свободного SO3 в соответствии с данными:
Отгонка SO3 в интервале температур 140-175°C является более полной, при этом давление паров воды остается незначительным. В U-образную трубку поместили полученный олеум, далее ее соединили с приемником (см. рисунок ниже) и поставили на обогреваемую снизу водяную баню. Первоначальная температура воды составляла 30°C, конечная температура - 100°C (достигнута путем добавления в баню горячей воды). |

|
|
Плавление олеума произошло при 55°C - на этой стадии его можно разлить по разным емкостям. Это показывает, что SO3 не находится в форме одной из двух конденсированных модификаций (с температурами плавления 59°C и 95°C). Данные модификации образуются при последовательном повторении процессов плавления и кристаллизации SO3 (превращение ускоряется в присутствии воды). При температуре 55°C олеум начал кипеть - белый туман заполнил емкость, и стал конденсироваться в бесцветные капли. Образование тумана наблюдается, когда SO3 попадает в емкость, в которой присутствуют следы влаги (чистый SO3 бесцветен). Для того, чтобы SO3 не конденсировался в изгибе трубки, это место было подогрето с помощью тепловентилятора.
Когда весь SO3, способный улетучиться при 100°C, собрался в колбе, U-образную трубку отсоединили. Далее колбу и U-образную трубку сразу же герметично закрыли (см. рис.). |

|
|
Небольшие примеси обугленной органики, которые окрашивали SO3, остались в U-образной трубке вместе с 37% олеумом. В момент разъединения установки и накрытия шлифов пробками образовался дым SO3. Количество дыма было таким большим, что вытяжка не справлялась, и работающим пришлось на время покинуть лабораторию. На любых других стадиях анализа образование дыма не происходило.
Прирост веса приемника составил 22.4 гр. SO3, вес 37% олеума - 4.2 гр. Потери при дистилляции составляли только 0.2 гр. или <1% олеума. 37% олеум содержал 1.5 гр. SO3 и 2.7 гр. 100% H2SO4. Таким образом, крепость олеума по данным дистилляции составляет 90%, что согласуется с данными титрования. Перегонка 90% олеума с образованием чистого SO3 была проведена с эффективностью 94%. Для того, чтобы максимально увеличить выход данной очень простой операции перегонки, автор ждал, пока последние капли SO3 не попадут в приемник (скорость образования последних капель SO3 была низкая и ожидание заняло около 5 мин.). Последние капли застыли в сужении трубки, сформировав подобие сосульки. Это образование не могло быть удалено с помощью нагрева изгиба с внешней стороны. Часть этой массы удалось стряхнуть во время вскрытия установки, причем увеличение выхода составляло явно менее 0.2 гр. После отсоединения изгиба застывший SO3 стал источником активного дымообразования (см. рис.). Таким образом, в процессе дистилляции следует поддерживать приемлемый поток SO3 и не допускать чрезмерного охлаждения приемника. |

|
|
Влияние на здоровье человека
Серный ангидрид не имеет запаха, но, к счастью, при контакте с атмосферой он образует густой туман, который предупреждает об опасности (SO3 использовали как боевой дымообразователь). Вещество очень агрессивно по отношению к металлам и органике, в чем можно было убедиться по моментальному обугливанию полиэтиленового шланга под действием минимального количества SO3, которое соответствовало давлению насыщенных паров при температуре < 10°C. Минимальные следы органики на стекле, например, отпечатки пальцев, обугливаются при контакте с SO3, что приводит к появлению на поверхности черных точек. Особенно это касается шлифов. Серный ангидрид также является канцерогеном. Следующая цитата приводится с целью предупреждения: "Аэрозоли, содержащие серную кислоту, оказывают на людей канцерогенное влияние. Четко установлена зависимость между действием на людей аэрозолей серной кислоты и раковыми заболеваниями. Вдыхание аэрозолей серной кислоты, связанное с профессиональной деятельностью, коррелирует с частотой заболевания раком легких и верхних дыхательных путей. Steenland (1988) и др. сообщают о почти двукратном увеличении частоты рака гортани для выборки, составленной из рабочих металлургической промышленности США, занятых на операциях травления (учитывалась поправка на курение и др. факторы). Через десять лет (1997) для этой же выборки было отмечено двукратное увеличение частоты рака гортани по сравнению с предыдущим десятилетием." http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s164sulf.pdf [ссылка перестала действовать] К счастью, если работать аккуратно и следовать описанной методике, можно избежать действия заметных количеств SO3. ***
Статья содержит очень подробное описание процесса получения серного ангидрида из доступных веществ в условиях лаборатории средней оснащенности. Стиль статьи, очень детальное и исчерпывающее описание операций характерно для немецкой научной школы. По возможность я пытался это сохранить при переводе, что удавалось далеко не всегда. Не лишним будет также упомянуть, что описание взято с форума любителей химии, но много ли профессиональных химиков смогут его воспроизвести? (- Прим. перев.)
|