
Растворение едкого кали (гидроксид калия) в воде




| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2015 Журнал Химиков-Энтузиастов |
Гальванический элемент ч.8 начало в №7 2014 В.Н. Витер, А.В. Зубко |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Гальванический элемент медь - алюминий - едкое кали
В прошлом номере описан гальванический элемент с электродом из алюминия [1]. Роль электролита играл сок фруктов или овощей, который имел кислую реакцию. В кислой среде алюминий вел себя, как металл более пассивный (более электроположительный), чем цинк и железо. Разница потенциалов между электродами из меди и алюминия составляла 0.4-0.5 В, а в случае пары медь - цинк она была раза в два выше. - И это несмотря на то, что алюминий стоит в ряду напряжений левее цинка и железа, т.е. он должен быть более активным металлом.
Дело в том, что алюминий покрыт прочной пленкой оксида, которая препятствует переходу катионов металла в раствор - в результате алюминий ведет себя, как более пассивный металл. Однако в растворе щелочи (например: едкий натр, едкое кали) оксидная пленка алюминия легко растворяется и металл начинает реагировать с водой с выделением водорода, что демонстрирует истинную - высокую - активность алюминия. Интересно было бы посмотреть, как ведет себя гальванический элемент с электродами из меди и алюминия, которые опущены в раствор щелочи (т.е. когда в качестве электролита выступает щелочь). Налил в стакан дистиллированную воду и стал добавлять в нее гранулы едкого кали - небольшими порциями, при перемешивании и по мере растворения предыдущих порций. Заодно поместил в стакан термометр - чтобы наблюдать за повышением температуры в процессе растворения едкого кали. При растворении гидроксидов натрия и калия в воде выделяется много тепла, в результате раствор может достаточно сильно нагреться. Под конец раствор нагрелся до 50°С. После добавления очередной порции едкого кали растворение щелочи замедлилось - раствор стал близок к насыщенному. Приступил к опыту. __________________________________________________ 1 Гальванический элемент ч.5. Фруктовая батарейка (алюминий) [ссылка] |

Растворение едкого кали (гидроксид калия) в воде |

|

|

|

|
|
Электродами служили медная и алюминиевая проволоки, подключенные к тестеру. Для удобства оба электрода были примотаны изолентой к деревянной прищепке. Я имел неосторожность прикоснуться к прищепке влажной рукой, на которую попал раствор щелочи. Этого оказалось достаточно, чтобы запустить гальванический элемент: дерево пропиталось раствором щелочи, причем смоченное место одновременно соприкасалось с медью и алюминием. В результате тестер показал потенциал около 50 мВ (0.05 В) - еще до того, как я опустил электроды в щелочь.
Когда опустил электроды, потенциал в первые секунды был около 1200-1300 мВ (1.2-1.3 В), причем он быстро стал падать. Померил силу тока - 57 мА (0.057 А), ток также быстро падал: секунд за 20 ток упал ниже 10 мА (0.01 А). Снова переключил тестер на измерение напряжения: сначала напряжение было около 400 мВ, потом поднялось до 900. Таким образом, напряжение (и ток) нашего элемента были довольно значительны, но они быстро падают со временем, когда цепь замкнута (а именно, когда к гальваническому элементу подключен тестер, переключенный в режим измерения силы тока, а не напряжения [2].). В процессе работы алюминий довольно активно реагировал со щелочью - с выделением водорода. Если цепь разомкнуть, но оставить электроды в растворе, алюминий, разумеется, не перестанет реагировать со щелочью, поэтому для прекращения работы гальванического элемента я поднял электроды из раствора. Через минуту снова опустил - чтобы посмотреть, какой будет потенциал. Оказалось, что потенциал стабилизировался на уровне около 900 мВ (0.9 В). __________________________________________________ 2 Я совсем не специалист в электротехнике, но коллега объяснил, что при измерении напряжения гальванического элемента с помощью тестера потенциал измеряемого гальванического элемента компенсируется направленным ему навстречу потенциалом батарейки тестера, в результате суммарный ток минимален (ресурс гальванического элемента "не расходуется"). В случае измерения силы тока с помощью тестера, ток в цепи максимален (что сильно "садит" исследуемый гальванический элемент) [K1]. |

Гальванический элемент медь - алюминий - едкое кали. Напряжение, мВ |

|

Сила тока, мА |

Сила тока, мА |

Напряжение, мВ |

|

|

Напряжение, мВ |

|
|
Тестер - это, конечно, хорошо, но хотелось подключить к гальваническому элементу какой-то устройство, работающее от электрического тока. Например, светодиод. У коллеги оказалось сразу несколько красных светодиодов средних размеров. Но какое нужно минимально напряжение, чтобы светодиод мог светиться? Коллега сказал, что вольта два. Решили проверить: коллега подключил диод к блоку питания с регулируемым напряжением. Поднимаем напряжение - ноль эффекта. Коллега вспомнил, что светодиод - это диод (простите за каламбур), а диод пропускает электрический ток только в одном направлении. Этим светодиод отличается от электрической лампы накаливания. Поменяли полярность - диод загорелся.
Оказалось, что минимальное необходимое напряжение - около 1.7 В, а при 2 В диод горит гораздо ярче. Коллега загнул положительный контакт светодиода, чтобы он отличался от отрицательного. К положительному контакту светодиода следует подключить медный электрод гальванического элемента (+), к отрицательному контакту - алюминиевый (-) электрод. Если минимальное напряжение - 1.7 В, то одного гальванического элемента медь - алюминий - щелочь явно мало. Нужно, как минимум, два. Взял бюкс, перелил в него часть раствора едкого кали со стакана, опустил в бюкс еще одну медную и одну алюминиевую проволоку. Получилось два гальванических элемента, соединил их последовательно - см. рисунок. Подключил светодиод (соблюдая полярность!) 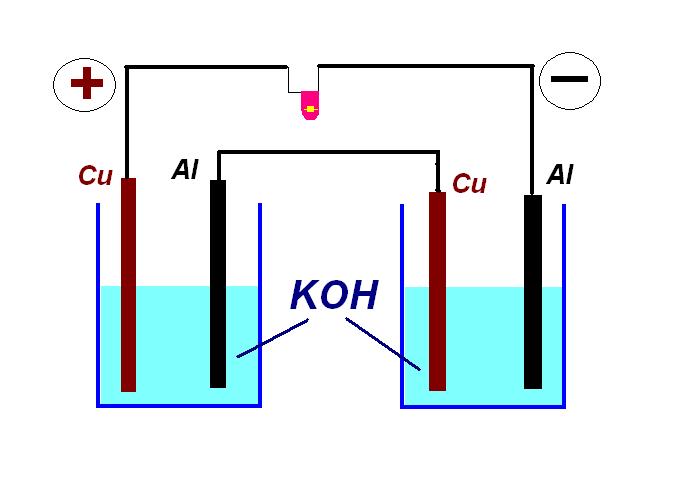 В бюксе электроды опущены в электролит (щелочь), в стакане - подняты над поверхностью раствора - таким образом, цепь разомкнута. Чтобы замкнуть цепь, нужно опустить электроды в стакан с едким кали, а чтобы разомкнуть цепь, достаточно поднять электроды из стакана. Единственное, алюминий в бюксе постоянно опущен в раствор щелочи - и он будет реагировать: даже тогда, когда цепь разомкнута - так что время не ждет. Опустил электроды в стакан, - замкнув цепь из двух гальванических элементов и одного светодиода. Светодиод загорелся. Сначала более ярко, потом - более тускло. Чтобы заснять свечение на видео, пришлось погасить свет в лаборатории (сначала - частично, потом - полностью). После съемки свечения отсоединил светодиод, подключил тестер. Оказалось, что напряжение двух соединенных последовательно гальванических элементов около 1.8 В. - Не удивительно, почему диод светил тускло. С другой стороны, напряжение в 1.8 В ровно в два раза выше, чем напряжение единичного гальванического элемента медь - цинк - щелочь в прошлом опыте (0.9 В). |
 Гальванический элемент медь - алюминий - едкое кали и светодиод |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
Комментарии
К1
Вероятно, разные типы таких приборов имеют разный метод измерения напряжения. Вообще говоря, компенсационный метод не самый распространенный. Скорее всего, рядовые тестеры имеют простой высокоомный вход с операционным усилителем. Входное сопротивление и емкость прибора должны быть указаны в инструкции к нему, иногда - и на его корпусе. Для большинства тестеров в режиме вольтметра оно составляет 1-2 МОм (1-2·106 Ом) при емкости несколько десятков пФ. Таким образом, при напряжении гальванического элемента порядка 1 В в измерительной цепи будет протекать ток порядка 1 мкА.
К1-1 Утверждение, что потенциал измеряемого гальванического элемента компенсируется направленным ему навстречу потенциалом батарейки тестера, не соответствует действительности. Просто тестер в режиме измерения напряжения имеет очень высокое входное сопротивление, а значит - малый ток. Кроме того, ток элемента падает по причине поляризации. |