Химия и Химики № 1 2021
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2021 Журнал Химиков-Энтузиастов |
Титрование соды Titration of soda Добрьій Химик |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
В числе прочего-прочего у нас в лаборатории проводятся синтезы амидов высших жирных кислот. Для этого используются разные амины: диэтаноламин (ДЭА), этилендиамин, N,N-диметиламинопропиламин, диэтилентриамин (ДЭТА), триэтаноламин (ТЭА), глюкозамин и прочие, и прочие… (Про триэтаноламин я пошутил - он амидов не образует, как и другие третичные амины). Критерием окончания реакции является остаточное содержание амина в реакционной смеси - его определяют с помощью титрования. Берем навеску реакционной смеси, растворяем в небольшом количестве спирта, разбавляем водой и титруем примерно 0.01N раствором соляной кислоты. Потом по объему соляной кислоты рассчитываем содержание амина.
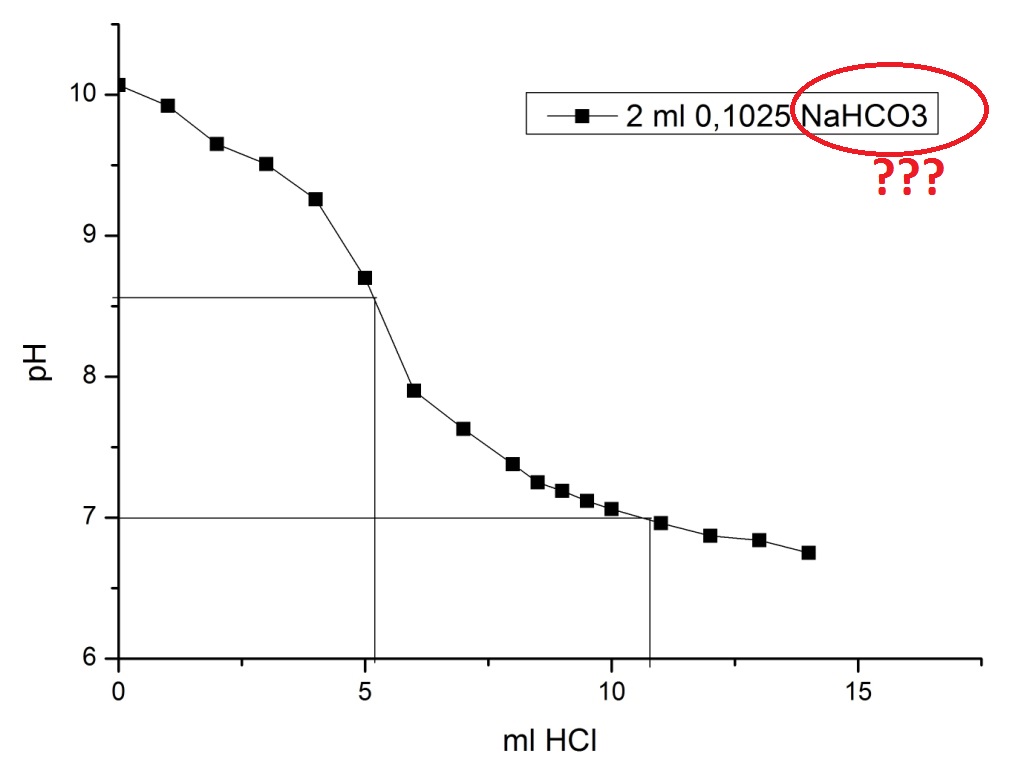
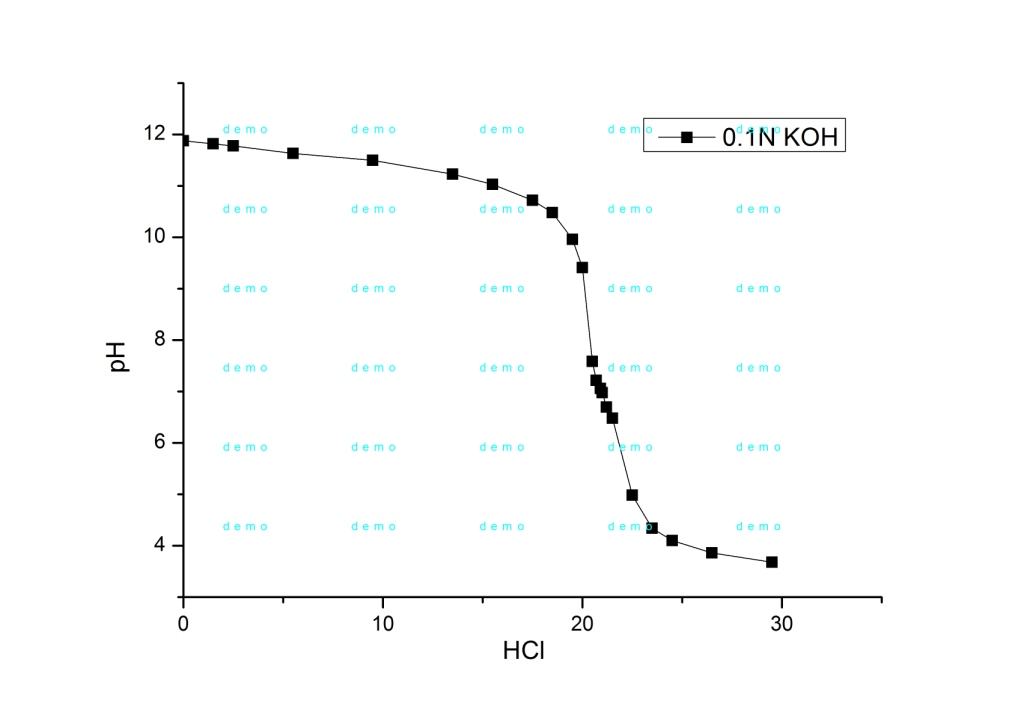
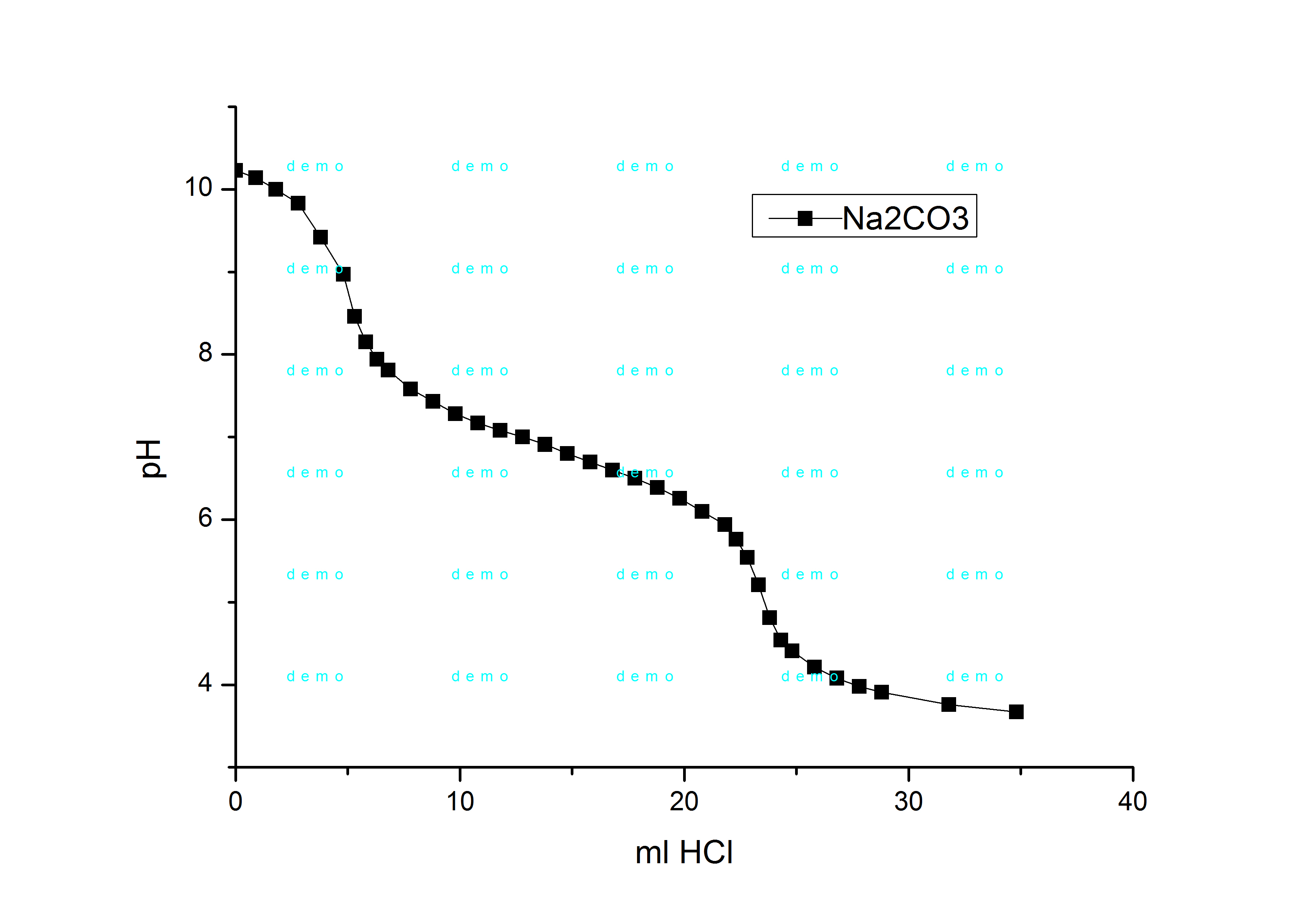
Что насторожило: концентрация соляной кислоты была не точно 0.01N, а 0.00911818, т.е., раствор кислоты явно готовили не из фиксанала. Но до поры до времени это меня не беспокоило - до тех пор, пока все, кто тут долго работал, не уехали в командировку, а у меня в бюретке кончился раствор. Искал фиксаналы солянки - не нашел. Позвонил спросить - оказывается, что они готовят титрованный раствор соляной кислоты из 15% раствора, а потом определяют точную нормальность по… буре. Или можешь взять в колбе раствор гидрокарбоната натрия с точно известной нормальностью, но лучше - возьми буру. Не лучше совсем, т.к. бура - кристаллогидрат Na2B4O7·10H2O, содержание воды в котором может колебаться: никакой точности не будет. Раствор гидрокарбоната натрия тоже явно готовили по навеске, и он явно был квалификации "пищевой" (т.е., даже не "ч.д.а."), но питьевая сода хоть не гигроскопична. Нашел 25-мл мерную колбы с этикеткой "NaHCO3 0.1025 M", нашел пипетку на 2 мл. Хорошо. Посчитал, сколько нужно 15% солянки, взял навеску, разбавил в мерной колбе до 1 л. Заполнил раствором бюретку. Теперь нужно нормализовать раствор (определить его нормальную концентрацию). Обычно растворы кислот (соляной, серной) готовят из фиксаналов. Нет фиксанала - готовишь раствор из навески вещества (или из расчетного объема жидкости), потом титруешь приготовленным раствором аликвоту раствора щелочи (с точно известной нормальностью) - по этим данным рассчитываешь нормальность раствора соляной кислоты. Маленькая деталь - вместо раствора щелочи у меня раствор питьевой соды (гидрокарбонат натрия). Если титруешь соль слабой кислоты сильной кислотой, то скачок титрования размыт и сдвинут в кислую область (pH<7) - поскольку в точке эквивалентности мы имеем соль сильной кислоты + слабую кислоту, которая тоже понижает pH. Но угольная кислота разлагается, углекислый газ улетает, значит, сода при титровании должна вести себя, так же, как гидроксид натрия? Утверждения неверное (не весь СО2 улетает в процессе титрования, более того: при стоянии дистиллята в нем растворяется углекислый газ из воздуха), но в конце дня я был уставший - думать было тяжело, поэтому принял эту неверную мысль. И ждал скачка титрования в районе рН=7. Индикаторов у нас в лабе нет, поэтому придется титровать потенциометрически. Взял 2 мл примерно 0.1 N гидрокарбоната натрия (если верить этикетке), развел дистиллятом до 100 мл, приготовился титровать соляной кислотой. Первый сюрприз: начальный рН раствора - почти 10.1: ничего себе гидрокарбонат натрия! Для питьевой соды рН раствора - около 8, рН за 10 дает кальцинированная сода (карбонат натрия), но на этикетке четко написано "NaHCO3" - гидрокарбонат натрия! Титрую - второй сюрприз: скачек титрования был не при рН=7, а около 8.5. Сначала - не понял юмора, оттитровал чуть ниже рН=7, посчитал в уме, что что-то совсем не так: концентрация соляной кислоты получалась в 2 раза выше, чем я готовил. Сказал вслух, что человека, который приготовил этот раствор соды, нужно бить ногами и пошел строить график. В процессе - все понял: если в растворе был не гидрокарбонат, натрия, а карбонат - так и должно быть: соль двухосновной кислоты, значит, на кривой титрования должно быть два скачка. До второго скачка я не дотитровал, а первый соответствует переходу гидрокарбоната в карбонат (как раз в районе 8.5). Второй скачек был бы в кислой области - он соответствует образованию смеси хлорида натрия и растворенного в воде углекислого газа. Т.е., даже если знать точно, какой там карбонат, считать нужно не по количеству кислоты, необходимому для достижения рН=7, а по кислоте, израсходованной в точке эквивалентности (точка перегиба на кривой титрования). Если так, то концентрация кислоты получалась уже не в 2, а в 4 раза больше расчетной. Но раз формула вещества написана ошибочно, ошибочно может быть указана и концентрация. Позвонил коллеге. Он сказал, что титровал карбонаты с индикатором (метилоранж). Метод - капризный, в процессе часто наблюдался пульсирующий переход окраски индикатора. Причина - растворенный в воде углекислый газ, который, то летит, то нет. Для борьбы с этим рекомендовали нагревать раствор. Т.е., карбонат для нормализации кислоты подходит плохо (даже если концентрация карбоната точная и вещество именно то, что указано на этикетке). Я уверился окончательно в своем выводе насчет "ногоприкладства", сказал коллеге: - Я был не прав, когда сказал: "Того, кто приготовил этот раствор, нужно бить ногами". - Разумеется: его нужно бить, и ногами, и руками (она сразу поняла, что я имел в виду). Ну и что делать? Вспомнил, что несколько недель назад купили фиксаналы едкого кали: я таких раньше не видел - вместо стеклянных ампул - пластиковые бутылочки. Где же коробка с фиксаналами? Искал долго, вышло, как в анекдоте про долгий поиск очков, которые, в конце концов, нашлись (оказались на лбу). Коробка лежала на видном месте возле самой бюретки. Я ее видел, но коробка была белой, а я ошибочно запомнил, что она коричневая. В результате обратил на эту коробку внимание только когда перерыл всю лабораторию. Зато готовить раствор из таких фиксаналов - одно удовольствие: открыл бутылочку и высыпал содержимое в колбу, сполоснул бутылочку промывалкой, растворил вещество и довел объем раствора до метки. Не нужно играть в игру "разбей стеклянный боек об дубовый фиксанал". Получился 0.1N раствор едкого кали. Отобрал 2 мл, титрую. Титровать сильное основание сильной кислотой - одно удовольствие! Это не амины с размытыми переходами (которых неизвестно где ждать)… Начальный рН был за 11 и первые миллилитры кислоты слабо на него влияли. Потом дело пошло быстрее и вблизи точки эквивалентности (рН=7, разумеется), я добавлял уже по 0.1 мл (когда титровал амины, минимальная порция титранта была 0.5 мл). Опустился ниже рН=7, постепенно стал добавлять кислоту большими порциями, чуть ниже рН=4 - закруглился. Построил кривую титрования, посчитал нормальность кислоты, вышло - 0.0095694 N, совсем другое дело! Теперь можно титровать амины. Потом все-таки не выдержал и заново протитровал раствор соды из колбы с надписью "NaHCO3 0.1025 M" - на этот раз до конца (рН=3,8). На кривой титрования получилось 2 скачка, которые примерно соответствуют рН=8.7 и рН=5.2. Т.е., это - карбонат натрия, он же - кальцинированная сода (не питьевая). Даже вычислил концентрацию раствора карбоната натрия - 0.1116 N. В процессе титрования заодно вспомнил предостережение коллеги о том, что при титровании карбонатов кислотой наблюдается пульсирующий переход окраски индикатора (метилоранж) в результате неравномерного перехода углекислого газа из раствора в газовую фазу. С аналогичным явлением я столкнулся, наблюдая за показаниями рН-метра, которые в процессе титрования в некоторых областях прыгали в обе стороны, как зайцы. Чтобы подавить это безобразие, добавил обороты магнитной мешалки по максимуму. |

|

|

|

|

|

|

|

|

|

|

|
|
|

|

|

На самом деле в колбе готовится раствор KOH (не HCl) |

|

|

|

|

|

|

|
|

|

|

|

|
|