Химия и Химики № 1 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2022 Журнал Химиков-Энтузиастов |
Железо, кобальт и никель (эксперименты) ч.1, 2, 3, 3a Iron, cobalt and nickel (experiments) В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Инвар (решетка из кинескопа) и соляная кислота / Invar (grille) and hydrochloric acid
Товарищ занимается методом формования полимерных нитей, который получил название электроспиннинг (электроформование, англ. - electrospinning) - вытягивание нитей из раствора или расплава полимера в высоковольтном электрическом поле. Для конструирования установок он использует кинескопы от старых телевизоров или компьютерных мониторов, которые все еще встречаются в наше время. Одна из деталей - маска кинескопа представляет собой металлическую сетку, расположенную непосредственно перед экраном. В зависимости от используемой в конкретной электронно-лучевой трубке (ЭЛТ) технологии она называется или теневая маска, или апертурная решетка [1].Электронный луч проходит сквозь отверстия этой сетки, попадает на люминофор, где и возникает изображение. Товарищ решил приспособить сетку из кинескопа и для других целей, в частности, для изготовления электродов электрохимических установок (т.е., в совсем иной области). В литературе пишут, что маску кинескопа изготавливают из сплава инвар, который обладает малым коэффициентом температурного расширения. Инвар (или FeNi36) - сплава железа с никелем, поэтому от него следует ожидать большей химической стойкости, чем от черных сталей. Однако у товарища возникли сомнения: "А не сделали ли именно эту маску кинескопа из черной стали? Термические деформации? Но их можно компенсировать рядом способов". Я взялся проверить. План эксперимента был такой: растворить кусок сетки в соляной кислоте. Уже на этом этапе станет видно, черная это сталь или легированная (первая растворяется в кислоте гораздо быстрее). Потом нужно провести качественную реакцию на никель: добавить к раствору сетки в кислоте избыток аммиака, отфильтровать гидроксиды железа. Гидроксид никеля (если там есть никель) должен перейти в раствор в виде аммиачного комплекса. Далее - добавить к этому комплексу спиртовый раствор диметилглиоксима, в случае наличия никеля выпадет ярко-красный осадок комплекса. Будь дело в лаборатории, можно было бы провести и количественное определение никеля, но мне придется ограничится качественной пробой. Заодно планировал провести качественные реакции на двух- и трехвалентное железо (для демонстрационных целей). Итак, к обрезку сетки добавил концентрированную соляную кислоту. Раствор сразу же стал желто-зеленым, потом - желтым с зеленоватым оттенком. В первый момент наблюдалось лишь слабое выделение газа (отдельные пузырьки), но через полминуты выделение водорода резко усилилось. Наблюдалась реакция средней интенсивности, которая потом ослабла. Выделение водорода стало медленным, но сравнительно равномерным. Раствор был интенсивно-желтым с зеленым оттенком - он немного напоминал флуоресцеин. Добавил еще кислоты (соляная кислота была в явном избытке), но даже через 7 часов сплав все еще не растворился, хотя наблюдались явные признаки утончения и разрушения сетки. Полное растворение произошло примерно за 10 часов, т.е. железо, безусловно, легированное. Но кроме никеля, сталь (для предания ей коррозионной стойкости) легируют и другими металлами, например, хромом. К утру заметил, что верхняя часть раствора стала коричневой, а через 30 часов весь раствор был коричневым - цвета хлорида железа (III). __________________________________________________ 1 На случай, если интересны подробности классификации масок кинескопов, нашел фрагмент из старой книги: 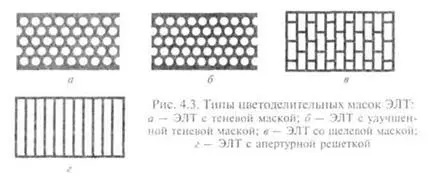 |

Инвар (сетка из кинескопа) |

|

Инвар и концентрированная соляная кислота |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Железо (II) и (III): качественные реакции / Iron (II) and (III): qualitative reactions
Итак, у нас была сетка от кинескопа старого телевизора, предположительно из сплава инвар (т.е., железо и никель). Задача - доказать присутствие в сплаве никеля. Для начала я растворил сетку в концентрированной соляной кислоте. Теперь предстояло провести качественные реакции на железо. Зачем? Нам ведь нужен никель! Качественные реакции на железо уже были описаны в недавних статьях журнала, а до этого - в дюжине других [2]. Никелем мы займемся чуть позже. А пока нужно ответить на один интересный вопрос по степеням окисления железа. Дело в том, что используемые в упомянутых статьях реакции позволяют обнаружить не просто "общее железо", но двух- и трехвалентное железо по отдельности. А для нашего объекта (раствора сплава железа и никеля в соляной кислоте) это интересно. Всего я провел два качественных анализа раствора, каждый из анализов включал по две качественные реакции - на Fe(II) и Fe(III). Первую пробу я провел, когда сетка еще продолжала растворяться в соляной кислоте: структура сетки уже распадалась, но на дне еще оставалось немало металла, выделяющего водород. Зачем? Чтобы определить, в каком валентном состоянии находится железо в растворе. На первый взгляд ответ известен заранее: Fe + 2HCl = FeCl2 + H2 Т.е., образуется двухвалентное железо. Однако, есть два "но". 1. Двухвалентное железо при стоянии растворов на воздухе окисляется кислородом до трехвалентного. В щелочной среде этот процесс идет быстро: гидроксид железа (II) буквально на глазах буреет, переходя в гидроксид железа (III). В кислой среде процесс окисления Fe(II) в Fe(III) протекает более медленно, но идет, а в нашем случае растворение сетки в кислоте продолжалось уже долго (т.е., было достаточно времени, чтобы двухвалентное железо частично окислилось до трехвалентного) . 2. Одним из способов устранить примесь железа (III) в растворе хлорида железа (II) - добавить к нему соляную кислоту и металлическое железо. В результате железо (III) перейдет в железо (II). С сульфатом двухвалентного железа - аналогично (добавляют серную кислоту и металлическое железо). Раньше в статьях и монографиях писали, что причина этому - "водород в момент выделения", или атомарный водород. Считалось, что при реакции кислот с металлами (или т.п.) водород первоначально образуется в форме атомов H·, которые обладают неспаренным электроном и фактически являются свободными радикалами. За счет этого водород в момент выделения является активным восстановителем, в нашем случае он переводит Fe(III) в Fe(II). Позже выяснилось, что восстановителем, который передает электроны, являются не атомы водорода, а непосредственно поверхность металла (в нашем случае - железа). Сути дела это не меняет: если часть железа (II) окислится воздухом (до Fe(III)), оно должно снова перейти в двухвалентное состояние под действием металлического железа, которое все еще реагирует на дне с кислотой. Имеем два противоположных фактора, один из которых переводит железо из двухвалентного состояния в трехвалентное, второй - осуществляет обратный переход. Вопрос: - Будет ли трехвалентное железо в растворе? Прогноз: - Думаю, - да, но трехвалентного железа будет мало. Скорее всего - на пределе чувствительности реакции. Итак, проба #1. В одном стакане я приготовил раствор красной кровяной соли (реактив на двухвалентное железо), во втором - раствор тиоцианата калия (реактив для обнаружения трехвалентного железа). Обе реакции - довольно чувствительны. Добавляю в оба стакана по несколько капель исследуемого раствора. В стакане с красной кровяной солью появляется интенсивно-синяя окраска (почти черная): двухвалентное железо в растворе есть и его много. Ожидаемый результат. В стакане с роданидом калия появилась слабая коричнево-красная окраска (а скорее - просто коричневая): трехвалентное железо в растворе есть, но его мало. На уровне примесей. С некоторыми химическими реактивами, которые не должны содержать железа вообще (в заметных количествах), роданид дает окраску примерно такой же интенсивности. __________________________________________________ 2 См., например, подборку статей Качественные реакции. Qualitative Chemical Analysis [ссылка] |

Инвар (Fe - Ni) растворяется в соляной кислоте |

|

Качественная реакция на трехвалентное железо (с роданидом калия) |

|

Качественная реакция на двухвалентное железо (с красной кровяной солью) |

|

|

|
|
Время шло, металлическая сетка полностью растворилась в соляной кислоте, выделение водорода прекратилось. Желтый раствор стал коричневым - как раз цвета хлорида железа (III). Как у него с содержанием трехвалентного железа? Казалось бы - это очевидно: трехвалентного железа там много, а двухвалентное - могло остаться, а могло и нет. Когда-то давно назад такой ответ, может, и показался бы убедительным.
Вспомнился случай из школы. Учитель математики во время доказательства теоремы по геометрии упомянул, что в древнеиндийских манускриптах использовался простой способ доказательства, который сводился к одному слову. Он написал его на доске: "СМОТРИ!" Поскольку мы живем не в древней Индии, для установления химического состава пробы мало одного слова (даже если написано оно большими буквами). Нужно провести качественную реакцию. А еще лучше - количественный анализ. Строго говоря, качественные реакции предназначены для обнаружения определенного вещества (есть вещество или нет), но часто одну и ту же реакцию можно использовать, как для качественного, так и для количественного анализа. Или, как в нашем случае, - полуколичественного (если вещество есть, то много его или мало?) Для этого раньше строили шкалу сравнения. Сначала - готовили стандартный раствор анализируемого вещества. Например, раствор, который содержит 1 мг/мл трехвалентного железа. В мерные колбы (например, на 100 мл) добавляли все возрастающие объемы раствора, например, чтобы в каждую колбу попало: 1, 2, 3, 5, 7, 9, 11, 13 и 15 мг железа. Потом добавляли реактивы, буферные растворы и т.п. - чтобы в колбах образовалось окрашенное соединение. Доводили объем раствора "до метки" дистиллированной водой (чтобы в каждой колбе было по 100 мл раствора). Приготовленные таким способом растворы представляли собой шкалу сравнения. Их окраска возрастает по мере увеличения концентрации определяемого вещества (в нашем случае - железа). Потом брали анализируемый раствор (строго определенный объем - аликвоту), помещали его в такую же колбу, добавляли к нему такие же реактивы, в таких же условиях и тоже доводили объем до метки (в нашем случае - 100 мл). А потом сравнивали окраску исследуемого раствора с окраской колб эталонной шкалы. Например, если окраска колбы с анализируемым раствором сильнее, чем в эталонной колбе, где было 3 мг железа, но слабее, чем в колбе с 5 мг железа, то это означает, что в отобранном объеме анализируемого раствора было больше 3, но меньше 5 мг железа (III). Такой метод анализа называется визуально-колориметрическим. В некоторых случаях окраску исследуемых растворов сравнивали не со стандартными растворами, а с окраской цветной шкалы, которую печатали на бумаге или на пластике. Точность такого определения ниже, зато нет потребности возиться с приготовлением стандартной шкалы растворов. Часто срок хранения таких растворов ограничен. Помню как-то формальная начальница хотела заставить меня определять висмут в гальванической ванне. Для этого нужно было ставить методику. Задача реальная, но я этого делать не хотел, тем более, что мои предшественники такой анализ не делали. Когда она привела директора завода, то я ткнул их обоих в визуально-колориметрическую шкалу: ряд высоких пробирок с нарастающей концентрацией висмута и добавленными к нему реактивами для появления окраски. Пробирки эти мирно пылилась за аналитическими весами неизвестно какой уже год. Шкала была примечательна тем, что некоторые пробирки с более высокой концентрацией висмута имели более слабую окраску, чем пробирки с более низкой концентрацией. То ли окраска изменилась от долгого хранения, то ли их готовили люди с не совсем прямыми руками, а, возможно, и сама методика не действовала (бывает и такое - липовые методики). Даже до директора дошло... Но и когда визуально-колориметрический метод исправно работает, точность его невысока. Сейчас данный метод имеет преимущественно историческое значение, поскольку человеческий глаз заменили приборы - спектрофотометры, с помощью которых химики выполняют анализ точнее и быстрее (чем при определении окраски "на глаз"). Вместо шкалы сравнения строят калибровочный график для фотометра. Принцип - тот же, только вместо определения окраски "на глаз": сначала измеряют оптические плотности растворов на фотометре, а потом строят график зависимости "Оптическая плотность - концентрация" (причем, концентрации нужно подобрать так, чтобы этот график представлял собой прямую линию). |
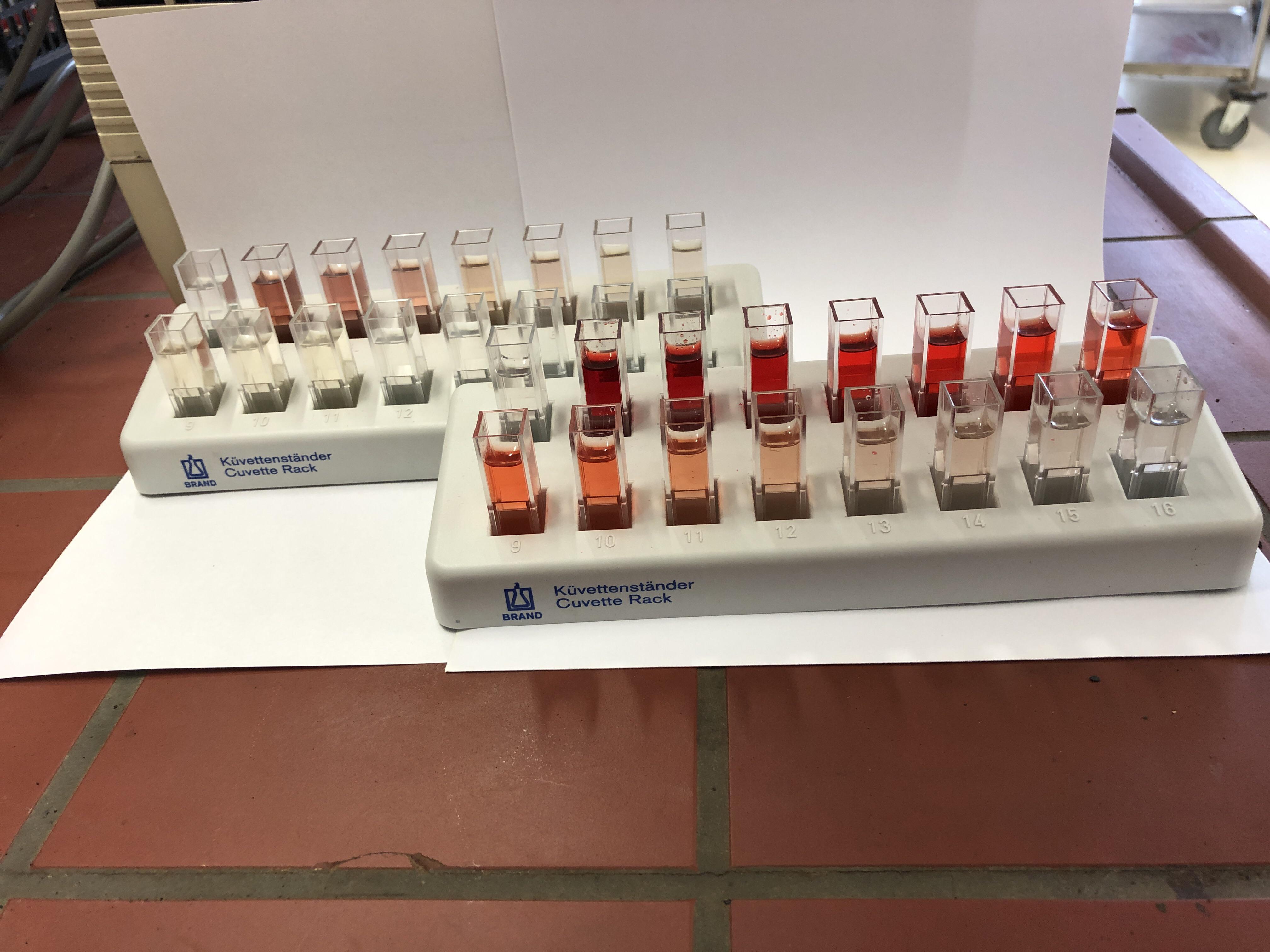
Построение калибровочных графиков - ряд стандартных растворов |

Построение калибровочных графиков - ряд стандартных растворов |

Построение калибровочных графиков - ряд стандартных растворов |

Построение калибровочных графиков - ряд стандартных растворов |
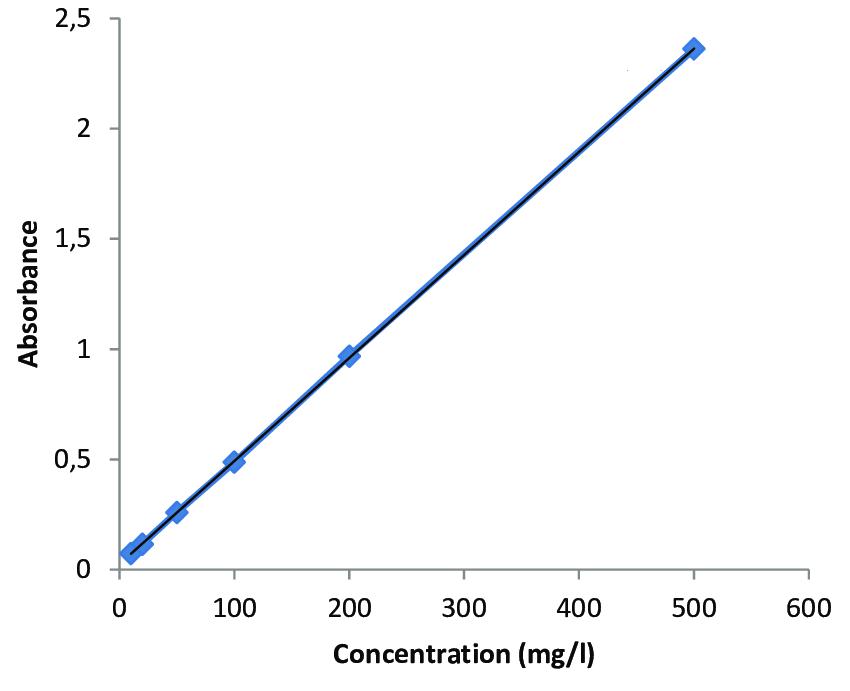
Пример калибровочного графика: по оси ординат - оптическая плотность, по оси абсцисс - концентрация меди (взято из научной статьи) |
|
Хотя, полоски универсального индикатора до сих пор используются в лабораториях для определения рН (т.е. - концентрации ионов водорода), а они - одна из разновидностей визуально-колориметрического метода. Равно, как и ампулы газоанализаторов, которые изменяют цвет в зависимости от концентрации определяемой примеси (например, отравляющего вещества в воздухе).
|

Универсальная индикаторная бумага (полоски и шкала сравнения) |

Универсальная индикаторная бумага (была опущена в растворы с разным рН) |

Колориметрические трубки (индикаторные трубки) / Colorimetric Tubes |

Колориметрические трубки (индикаторные трубки) / Colorimetric Tubes |
Колориметрические трубки (индикаторные трубки) / Colorimetric Tubes |
|
Итак, проба #2. Приготовил раствор роданида калия примерно такой же концентрации (как и для пробы #1), добавил к нему несколько капель исследуемого раствора, который простоял к том времени на воздухе уже 5 дней. Результат был очевиден заранее - темно-красная, почти черная окраска: в растворе много трехвалентного железа.
Позже спохватился (хорошо, что не успел вылить исследуемый раствор) и провел качественную реакцию на двухвалентное железо. В раствор красной кровяной соли добавил несколько капель исследуемого раствора. Появилась темно-синяя окраска: в растворе все еще осталось достаточно двухвалентного железа. |

Тот же раствор 5 дней спустя |

Качественная реакция на трехвалентное железо (с роданидом калия) |

|

|

|

|

|

Качественная реакция на двухвалентное железо (с красной кровяной солью) |

|

|

|

Качественная реакция на никель |

Добавим исследуемый раствор в избыток аммиака |

|

|

|

|

Попытка отфильтровать гидроксиды железа |

|

|

Частицы гидроксидов железа частично прошли через фильтр |

Добавим диметилглиоксим |

Образовался красный комплекс - никель обнаружен |

|

Железо (II), никель и диметилглиоксим: исследуемый раствор, содержащий хлориды железа и никеля |

Раствор диметилглиоксима в спирте с избытком водного аммиака (качественный реактив на никель, он не допускает избытка железа) |

Добавим исследуемый раствор в спиртовый раствор диметилглиоксима с избытком водного аммиака |

Образовались красные комплексы железа (II) и никеля с диметилглиоксимом |

|

|

|

|

|
|
Комментарии
К1
Нас когда-то учили такому приему открытия никеля: берут круг фильтровальной бумаги средней плотности диаметром 8-9см, пропитывают раствором гидрофосфата калия и сушат до воздушно-сухого состояния. Затем в центр наносят 2-3 капли исследуемого раствора, после чего туда же медленно прикапывают дистиллированную воду до увлажнения круга диаметром 4-5 см. Затем обрабатывают парами аммиака в течение приблиз. полминуты и проявляют водно-спиртовым раствором диметилглиоксима (поливом или опрыскиванием из пульверизатора). Никель дает малиново-розовое кольцо по краю, медь - бурое кольцо в середине. Сущность методики основана на различной подвижности фосфатов различных металлов, наиболее подвижен фосфат никеля. Насколько я помню, наименее подвижен фосфат серебра.
|