Химия и Химики № 1 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2022 Журнал Химиков-Энтузиастов |
Железо, кобальт и никель (эксперименты) ч.9, 9a, 10 Iron, cobalt and nickel (experiments) В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Железо (II) и диметилглиоксим / Iron (II) and dimethylglyoxime
Работая с раствором, который содержал железо (двух- и трехвалентное) вместе с двухвалентным никелем, я случайно узнал, что железо (II) тоже дает комплекс с диметилглиоксимом, окрашенный в красный цвет. В отличие от аналогичного никелевого комплекса он растворим в воде. Сульфат железа (II) я нашел, диметилглиоксим остался. Более того, саму реакцию я уже провел - получилось. Раз так, почему бы не заснять образование комплекса двухвалентного железа с никелем? Для начала приготовил раствор железного купороса в воде - сравнительно крепкий. Раствор имел коричневый цвет (из-за примеси трехвалентного железа). В другом стакане смешал концентрированный раствор аммиака и раствор диметилглиоксима в спирте. В раствор диметилглиоксима с аммиаком добавил по каплям раствор сульфата железа (II). В результате образовались кроваво-красные капли, которые опустились на дно. Размешал - получился темно-красный раствор, который напоминает кровь или скорей - красное вино. В тонкой пленке был заметен малиновый цвет. Прочитал, что при определении никеля при избытке железа последнее маскируют сегнетовой солью. Сегнетовой соли или винной кислоты под рукой не оказалось. Решил попробовать лимонную кислоту - добавил ее в раствор, в надежде, что она разрушит комплекс. Не разрушила - красная окраска так и осталась, только стала менее интенсивной (из-за разбавления). Провел контрольный опыт: к твердой лимонной кислоте добавил раствор диметилглиоксима и раствор железного купороса. Красная окраска не появилась. Но стоило добавить каплю аммиака, как в этом месте возникала яркая малиновая окраска. Потом она исчезала (лимонная кислота нейтрализовала аммиак и среда в месте попадания капли снова становилась кислой). В следующем опыте раствор диметилглиоксима и аммиака дополнительно разбавил водой, раствор железного купороса взял то же самый. Добавил по каплям сульфат железа (II) в раствор диметилглиоксима с аммиаком. В результате образовались малиновые "жидкие хлопья", которые опустились на дно, не смешиваясь с раствором в стакане. Перемешал. Раствор сначала стал розовым, потом - красным. В нем стали четко заметны твердые частицы осадка. Новые порции железа (II) вызвали образование очередных порций осадка. В конце выпал объемный розово-фиолетовый осадок, а окраска раствора стала довольно темной. Несмотря на хорошую растворимость, комплекс диметилглиоксима с железом таки образовал твердую фазу. Третий раз провел взаимодействие в более разбавленных растворах: развел не только аммиак с диметилглиоксимом, но и прибавляемый железный купорос. Результат - малиновые волокна и вихревые кольца, которые опускались на дно медленнее, чем в предыдущих случаях. Потом - от новых порций сульфата железа (II) раствор стал красным. В этот раз окраска была гораздо слабее и раствор сохранил прозрачность. Разница цветов: розовый - малиновый - красный может быть обусловлена разной концентрацией одного и того же комплекса (а в случае твердых осадков - разным размером частиц). Например, перманганат калия розовый в разбавленных растворах и фиолетовый в более крепких растворах; красные кристаллы красной кровяной соли при растирании становятся желтыми. Возможно, однако, что в растворе образуется несколько разных комплексов: в зависимости от соотношения железа и диметилглиоксима, и эти комплексы имеют разные цвета. В заключении решил провести экстракцию диметилглиоксимата железа (II) бутанолом-1. Почему именно н-бутанолом? Во-первых, данный растворитель оказался под рукой, а другие - токсичные и/или огнеопасные органические растворители дома хранить не хочется. И, во-вторых, н-бутанол экстрагирует роданидные (тиоцианатные) комплексы кобальта и железа, а также - перекись шестивалентного хрома - что используется в аналитической химии при проведении соответствующих качественных реакций. Т.е., такой выбор растворителя вполне оправдан. Итак, я добавил бутанол-1 в стакан с раствором комплекса железа (II) с диметилглиоксимом и перемешал. Когда шарики бутанола всплыли и объединились в верхний слой жидкости, органический растворитель стал розовым. Т.е., часть комплекса перешла в органику. Какие могут быть применения комплекса двухвалентного железа с диметилглиоксимом? Например, в книге Г. Шарло - Методы аналитической химии (1965) [ссылка] он описан, как индикатор для окислительно-восстановительного титрования. "Комплекс диметилглиоксима с железом (II) и аммиаком. Диметилглиоксим образует с солями железа (II) в присутствии аммиака интенсивно окрашенное в красный цвет комплексное соединение 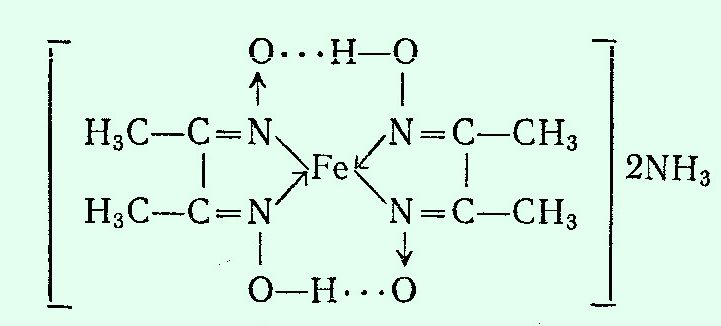 которое может быть использовано в качестве окислительно-восстановительного индикатора. Реактив. Одну каплю 0.02 М раствора сульфата железа (II) прибавляют к 3 -4 каплям 14%-ного спиртового раствора диметилглиоксима и приливают несколько капель раствора аммиака. Реактив на воздухе окисляется. На 100 мл титруемого раствора прибавляют 2 капли этого реактива. На уничтожение его окраски расходуется 0,1 мл 0,01 н. раствора окислителя. Свойства. Реактив окрашен в красный цвет в восстановительной среде и в бледно-коричневый при потенциале, равном -0,25 В в буферном растворе, рН которого равен 9,2. Приготовляется смешением растворов аммиака и хлорида аммония (к 70 мл концентрированного раствора аммиака прибавляют 50 г хлорида аммония и смесь разбавляют водой до 1 л). Реактив устойчив в границах рН от 5-6 до 10. Применение. Индикатор служит для проведения титрования в аммиачной среде. Хорошим титрующим раствором в этих условиях является раствор гексацианоферрата (III). Так можно определять гидросульфиты, сульфиды и т.п." Кстати, комплекс железа (II) с диметилглиоксимом - далеко не единственное производное железа (II), которое обладает свойствами окислительно-восстановительного индикатора. Другой пример - ферроин. С данным индикатором я не работал, хотя должен был: на предприятии планировали запустить гальваническую линию. Меня туда взяли, чтобы я составил списки всего необходимого и дал заявки на закупку. Одна из методик титрования была как раз с ферроином. Этот индикатор купили - даже повертел баночку в руках, но линия стоит до сих пор. Титровать с ферроином так и не пришлось. Что такое ферроин? Приведу цитату из той же книги: "Из индикаторов этого типа больше всего исследованы комплексные соединения железа с органическими веществами, молекулы которых содержат группировку: 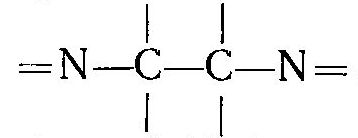 Важнейшими из последних являются о-фенантролин (или 1,10-фенантролин) и 2,2'-дипиридил. 1,10-Фенантролин-Fe2+ ("Ферроин"). O-Фенантролин образует с солями железа (II) чрезвычайно интенсивно окрашенные в красный цвет комплексные ионы: 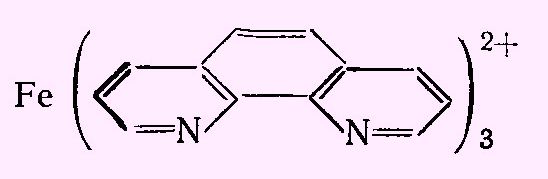 Этот комплекс является прекрасным окислительно-восстановительным индикатором. При окислении его получается бледно-голубое соединение. Реактив. Раствор 0,025 М комплексного соединения о-фенантролина с железом (II). Растворяют в воде 0.7 г сульфата железа (II) FeSO4·7H2O и 1.5 г 1,10-фенантролина C12H8N2·H2O; раствор разбавляют до 100 мл. На 100 мл титруемого раствора вносят каплю реактива. Для окисления этого объема реактива требуется 0.1 мл 0.01 н. раствора окислителя". |

Сульфат железа (II) |

Водный аммиак, диметилглиоксим (в спирте) и раствор сульфата железа (II) |

|

Образование комплекса двухвалентного железа с диметилглиоксимом |

|

|

|

|

|

|

|

|

|

|

|

|
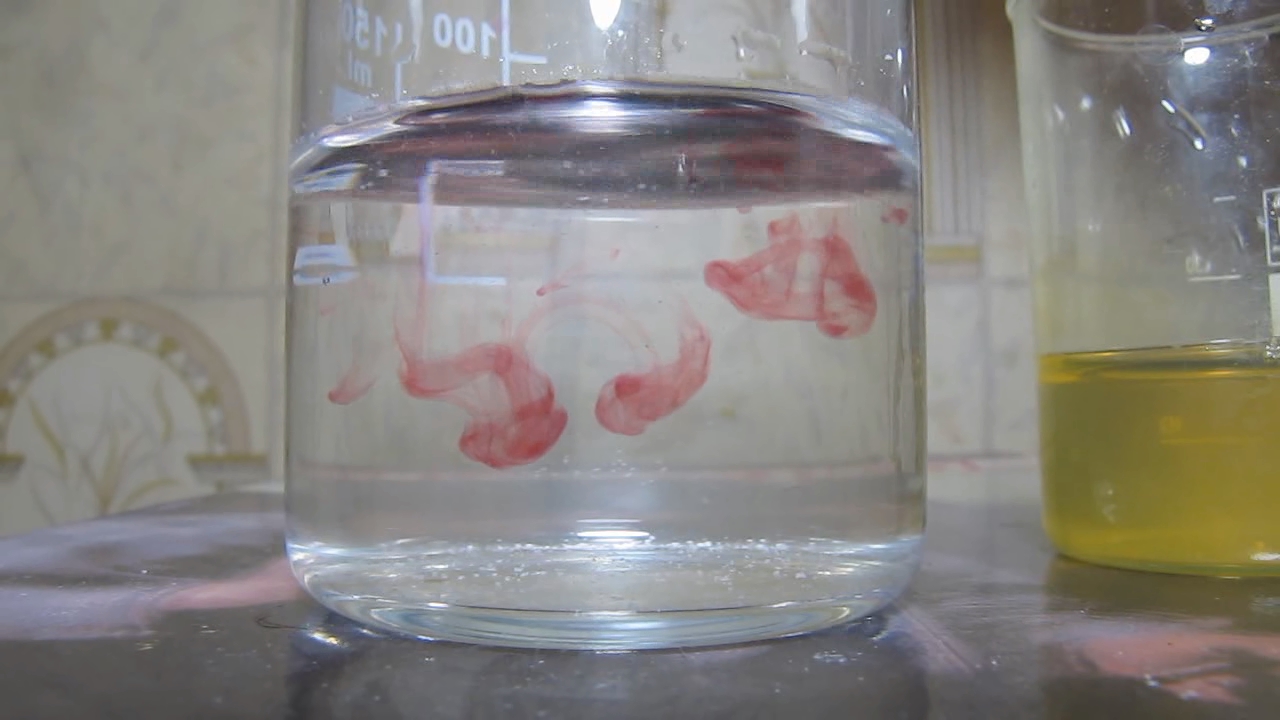
|

|

|

|

|

|

Экстракция комплекса н-бутанолом |
|
Железо (II), (III), диметилглиоксим и перекись водорода / Iron (II), (III), dimethylglyoxime and hydrogen peroxide
Комплекс двухвалентного железа с диметилглиоксимом легко окисляется и может служить окислительно-восстановительным индикатором (что означает контрастный переход окраски) - см. ч.9 [ссылка]. С другой стороны, получить этот комплекс очень просто. Раз так - почему бы не попробовать.
В два стакана налил смесь растворов аммиака в воде и диметилглиоксима в этаноле. В первый стакан добавил несколько капель раствора сульфата железа (II) (технический железный купорос). Раствор стал ярко-красным - образовался комплекс Fe(II) с диметилглиоксимом. Во второй стакан для сравнения добавил несколько капель раствора хлорида железа (III) (он содержал избыток соляной кислоты, что в нашем случае несущественно, если не считать образования белого дыма). Содержимое стакана стало желто-коричневым: выпал гидроксид железа (III). Теперь в первый стакан с ярко-красным комплексом добавил несколько капель пергидроля (30% раствор перекиси водорода). Выделился газ, раствор в стакане стал желто-коричневым. Двухвалентное железо окислилось до трехвалентного, в результате комплекс разрушился и перешел в гидроксид железа (III). Таким образом, содержимое первого стакана (в который добавили двухвалентное железо) стало похоже на содержимое второго - в который изначально добавили трехвалентное железо. Так и работает данный индикатор: от избытка окислителя ярко-красная окраска индикатора исчезает, переходя в желтую (коричневую). Перекись водорода в качестве титранта практического значения не имеет (использовать можно, только никто этого не делает - неудобно), но другие окислители влияют на данный индикатор аналогично. |

Аммиак с диметилглиоксимом (одинаковый раствор в двух стаканах) |

В правый стакан добавим FeSO4 |

В левый стакан добавим FeCl3 |

|

|

|

Окисление комплекса двухвалентного железа с диметилглиоксимом при добавлении пергидроля |

|

|

Окисление комплекса двухвалентного железа с диметилглиоксимом при добавлении пергидроля (в верхнем левом углу - исходный комплекс) |
|
Нитрат кобальта, аммиак и диметилглиоксим / Cobalt nitrate, ammonia and dimethylglyoxime
В предыдущих частях статьи были описаны эксперименты с аммиакатами меди и никеля. А также - образование комплексов этих металлов с диметилглиоксимом. Решил проделать аналогичные эксперименты с кобальтом. Благо, бутылку с нитратом кобальта принес с прошлой работы. Там я его использовал для приготовления катализаторов, в этот раз - пусть послужит на благо демонстрационных экспериментов. Перед тем, как что-то делать, рекомендуется посмотреть литературу (чтобы не изобретать велосипед в сотый раз). Еще до этого помнил, что эксперименты с аммиачными комплексами двухвалентной меди и никеля есть во многих практикумах по неорганической химии, с кобальтом я таких опытов именно в практикумах не встречал. Может, и есть, но явно - их рекомендуют не так часто. Почему? Ведь кобальт сравнительно доступен, имеет большое практическое значение и дает много яркоокрашенных соединений. Практикумы с демонстрационными экспериментами - учебная литература, а те, кто учат, - любят простоту. Частично это оправданно: ведь во время изучения алфавита не задают писать огромные поэмы. Но если злоупотреблять простотой, есть риск выучить вместо химии ее муляж, оторванный от реальности. С медью (II) и никелем все сравнительно просто: в избытке аммиака они дают комплексы [Me(NH3)6]2+, а какой там анион (во внешней сфере) - в большинстве случаев неважно. Кроме того, как в составе исходной соли, так и в составе аммиаката, металл находится в одной и той же степени окисления (+2). С кобальтом - сложнее. Он дает с аммиаком и аминами много разных комплексов, во внутреннюю координационную сферу которых кроме аммиака и аминов (а также - воды) могут входить разные анионы или нейтральные молекулы. Возможны и другие сюрпризы, включая полиядерные комплексы и транс-цис изомерию комплексов (она бывает не только в органической химии). Некоторые из аммиачных комплексов кобальта получили тривиальные названия, например, [Co(NH3)5Cl]Cl2 - пурпуреохлорид (хлорид хлоропентаамминкобальта(III)); цис-[Co(NH3)4Cl2]Cl·H2O - виолеохлорид (хлорид 1,2-дихлоротетраамминкобальта(III)) и др. В результате анион из внешней координационной сферы также имеет значение, поскольку он может занять место во внутренней координационной сфере, поменявшись местами с одним из лигандов. Т.е., хлорид, нитрат или сульфат кобальта - для таких экспериментов - не одно и то же: они могут вести себя схоже (как с медью и никелем), а могут быть и отличия. Кроме того, кобальт (II), как и железо (II) легко окисляется в щелочной среде до кобальта (III) даже кислородом воздуха, хотя в кислой среде трехвалентный кобальт - сам сильнейший окислитель (он способен окислить даже воду до кислорода). В этом его отличие от меди (II) и никеля. Зато, в отличие от железа (III), кобальт (III) дает в водных растворах устойчивые аммиачные комплексы. Как отмечалось, таких комплексов очень много и их уже давно исследуют. Впервые аммиакатами кобальта заинтересовался еще А. Вернер - родоначальник теории координационных соединений. Собственно химия комплексных соединений началась с изучения соединений двух металлов: кобальта и платины. Посмотрел монографию Пятницкий И.В. - Аналитическая химия кобальта (1965) [ссылка]. Там есть подраздел "Комплексы с аммиаком и органическими аминами", но сведений в нем - не густо. Сказано только, что комплексы этого типа используются для фотометрии и полярографии кобальта, а также - при маскировке. Вместо обзора свойств и методов получения - только отрывчатые сведения. Логично: тема очень обширная, и, если освещать вопрос более детально, места в книге не хватит. Но кое-что интересное я нашел даже в монографии по аналитической химии - значения констант нестойкости аммиачных комплексов кобальта (II) и кобальта (III): аммиачные комплексы кобальта (II) не отличаются устойчивостью, зато [Co(NH3)6]3+ - чрезвычайно устойчив. Значит, почти наверняка в процессе образования аммиачных комплексов двухвалентный кобальт окислится кислородом воздуха до трехвалентного. Коллега подтвердил это допущение. Кстати, с бесцветным аммиакатом одновалентной меди [Cu(NH3)2]+ аналогично: раствор этого комплекса окисляется на воздухе до синего аммиаката двухвалентной меди [Cu(NH3)4]2+. Процесс происходит насколько быстро, что бесцветный раствор синеет буквально при переливании. Насчет комплекса кобальта с диметилглиоксимом. Раньше имел с ним дело. Во время работы над диссертацией я синтезировал много образцов фосфатов, которые одновременно содержали кобальт и никель (твердые растворы замещения между средними фосфатами, гидрофосфатами и дигидрофосфатами кобальта и никеля). Сам синтезировал - сам и анализировал, сам подбирал методики анализа. Как определить кобальт в присутствии никеля и никель в присутствии кобальта? Суммарное содержание этих металлов отлично определялось обратным комплексонометрическим титрованием (титрант - сульфат цинка, индикатор - ксиленоловый оранжевый, среда - уротропиновый буфер). Никель в присутствии кобальта я осаждал диметилглиоксимом из аммиачного раствора: диметилглиоксимат никеля нерастворим, диметилглиоксимат кобальта - растворим. В методике писали, что нужно повторное переосаждение (т.е., осадок комплекса никеля с диметилглиоксимом, вместо того, чтобы сразу взвешивать, нужно растворить в кислоте и повторно осадить никель диметилглиоксимом). Зачем? Чтобы не было соосаждения кобальта. Раз или два попробовал переосаждать - результаты не отличались от анализа с однократным осаждением в пределах точности метода. Как определить кобальт? Зная сумму: кобальт + никель и содержание никеля, кобальт рассчитывал по разнице. Начнем эксперимент. Для начала - взаимодействие нитрата кобальта с аммиаком в водном растворе, потом - получение комплекса кобальта с диметилглиоксимом. Потом - обратный порядок прибавления растворов: в нитрат кобальта небольшими порциями добавим аммиак. Разбавил концентрированный раствор аммиака примерно в 2 раза. Добавил в него по каплям красно-коричневый раствор нитрата кобальта (II). Раствор опустился на дно, где сразу же образовался голубой осадок гидроксида кобальта (II). Слой раствора над ним окрасился в коричневый цвет - аммиачный комплекс кобальта (для простоты буду употреблять слово "комплекс" в единственном числе, хотя кобальт дает с аммиаком много разных комплексов). Перемешал. Осадок преимущественно растворился, раствор стал коричневым. Следующие порции раствора нитрата кобальта вызвали схожий эффект. Хотел добавить спиртовый раствор диметилглиоксима, но аммиачный раствор нитрата кобальта получился слишком интенсивно окрашенным (был риск не разглядеть цвет комплекса кобальта с диметилглиоксимом), добавил в стакан воды - в результате коричневый раствор стал зеленым (на видео не заснял). По-видимому, это тоже аммиачный комплекс кобальта, но другой (а, может, это - основная соль кобальта). Чистый аммиак закончился. Остался только раствор, который долго хранился в стеклянной бутылке, от чего в нем плавали белые блестящие чешуйки. Не совсем эстетично, зато для нашего эксперимента допустимо. Разбавил концентрированный раствор аммиака примерно в 3 раза. Добавил в него нитрат кобальта. Результат - голубой осадок, над ним - коричневый раствор, при перемешивании осадок растворился, жидкость стала зеленой. Добавляя новые порции аммиака и нитрата кобальта, удалось достичь коричневой окраски раствора. Позже переделал этот же эксперимент и установил, что при стоянии зеленый раствор разделяется на две фазы: зеленый осадок и коричневый раствор. А во время монтажа видео заметил еще один факт: при стоянии коричневого аммиаката кобальта на воздухе его окраска углубляется. Причем начинается этот процесс возле поверхности раствора, что напоминает упомянутую выше реакцию окисления аммиаката одновалентной меди [Cu(NH3)2]+ воздухом. В нашем случае двухвалентный кобальт переходит в трехвалентный. |

Нитрат кобальта |

Нитрат кобальта и аммиак |

Добавим раствор нитрата кобальта в аммиак |

|

|

|

|

|

|

Нитрат кобальта и аммиак |

Добавим раствор нитрата кобальта в аммиак |

|

|

|

|

|

|

Нитрат кобальта и аммиак |

Добавим раствор нитрата кобальта в аммиак |

|

|

|

|

|

Зеленый раствор после отстаивания разделился на две фазы: коричневый раствор и зеленый осадок |
|
Провел эксперимент с концентрированным раствором аммиака (не разведенным водой) - в этот раз при добавлении соли кобальта голубой осадок почти не образовывался, раствор сразу стал коричневым. Добавил диметилглиоксим в спирте - раствор стал темно-коричневым. Именно таким я запомнил диметилглиоксимат кобальта - темно-коричневый раствор над красным осадком диметилглиоксимата никеля.
Тоже повторил эксперимент, чтобы получить более качественное видео, и столкнулся с неожиданностью: сначала образовался темно-коричневый раствор комплекса никеля с диметилглиоксимом. Он немного постоял и, когда я перемешал содержимое стакана стеклянной палочкой повторно,.. раствор существенно посветлел. Такое я наблюдал и в первый раз, но тогда я перед повторным перемешиванием добавил в раствор немного дистиллята (чтобы цвет темного раствора было легче разглядеть). По-видимому, дело в конкуренции между лигандами: аммиаком и диметилглиоксимом. Аммиачные комплексы трехвалентного кобальта исключительно прочные (в отличие от аммиакатов двухвалентного никеля). |

Добавим раствор нитрата кобальта в аммиак |

|

|

Добавим диметилглиоксим |

|

|

Добавим раствор нитрата кобальта в аммиак |

|

|

Добавим диметилглиоксим |

|

|
|
Теперь - обратный эксперимент: добавляю концентрированный раствор аммиака в крепкий раствор нитрата кобальта. От первых капель аммиака на поверхности раствора образовался розовый осадок. Это - тоже гидроксид кобальта (II), но другая модификация. Потом стал образовываться голубой осадок (более устойчивая модификация гидроксида кобальта), при перемешивании весь раствор превратился в голубую взвесь осадка. Добавляю аммиак дальше, верхний слой становится коричневым (раствор аммиачного комплекса кобальта). В отличие от гидроксидов меди и никеля, растворение осадка шло плохо и не до конца. Получилась взвесь зеленого осадка в коричневом растворе. Опять зеленый осадок! При стоянии раствор и осадок разделились.
Вопрос: осадок имеет зеленый цвет или это тот же голубой осадок гидроксида кобальта (II), который растворился не полностью, несмотря на избыток аммиака (сильный запах из раствора)? Интенсивно-окрашенный раствор может искажать видимый цвет осадка. Чтобы ответить - надо отфильтровать осадок и промыть его водой. Профильтровал, промыл дистиллятом - осадок так и остался зеленым, объем осадка - небольшой, но он есть. Таким образом, при взаимодействии избытка аммиака с нитратом кобальта мы получили коричневый раствор и зеленый осадок. Раствор - аммиачный комплекс кобальта, осадок - вероятно, тоже (другой вариант - это основная соль кобальта). Как видите, простотой и однозначностью в данном эксперименте и не пахнет. Нашел статью в Википедии по аммиачным комплексам кобальта, но после обнаружения двух ссылок на несуществующие источники потерял к ней интерес. Желающие познакомиться более подробно с аммиачными комплексами кобальта (и никеля) могут, например, обратиться к книге: Ф.М. Перельман, А.Я. Зворыкин - Кобальт и Никель (1975) [ссылка], С.69 и далее. |

Нитрат кобальта и аммиак |

|

Добавим аммиак в раствор нитрата кобальта |

Сначала образовался розовый осадок (гидроксид двухвалентного кобальта) |

Потом - голубой осадок (другая модификация гидроксида двухвалентного кобальта) |

|

|

|

По мере добавления аммиака осадок стал зеленым и частично растворился |

|

|

|

|

|

|

|

Содержимое стакана при стоянии разделилось на две фазы: коричневый раствор и зеленый осадок |

|

Фильтрование и промывка осадка |

|

|

|