Химия и Химики № 1 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2022 Журнал Химиков-Энтузиастов |
Электрохимический синтез хлората калия KClO3 электролизом хлорида натрия NaCl с последующей реакцией обмена с едким кали KOH Electrochemical synthesis of potassium chlorate KClO3 by electrolysis of sodium chloride NaCl followed by exchange reaction with potassium hydroxide KOH Максим |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
На основании предыдущих опытов и изучения литературы была уточнена методика проведения препаративного синтеза хлората калия KClO3, методика проверена в ходе настоящей работы.
Общая идея методики
1. Электролизу подвергается близкий к насыщенному раствор хлорида натрия NaCl, взятый в избытке, при температуре 40-60°С. В этих условиях образующийся в электрохимическом процессе гипохлорит NaClO диспропорционирует до хлората NaClO3 и хлорида NaCl, последний вновь подвергается электролизу. Хлорат натрия NaClO3, обладая высокой растворимостью, полностью остается в растворе, даже с учетом электрохимического расхода воды. При этом шлам, остатки нерастворившегося хлорида натрия NaCl и т.п. могут быть отделены фильтрованием, таким образом возможно использование недорого графитового анода, а также удаление побочных нерастворимых продуктов электролиза (отложений на контактах и т.п.).2. К отфильтрованному раствору, содержащему NaClO3, NaCl, растворенные примеси, добавляется измельченный (гранулированный или чешуйчатый) гидроксид калия KOH в соответствие с расчетом. Высокая растворимость KOH, NaOH обеспечивает практически полный переход твердой щелочи в раствор, при этом малорастворимый хлорат калия KClO3 выпадает в осадок. При добавлении щелочи порциями с хорошим перемешиванием реакционная смесь постепенно разогревается, завершая процесс диспропорционирования гипохлорита ClO-. 3. Смесь с полученным осадком охлаждается до 10°С (при этом основная масса KClO3 выпадет в осадок, а остальные компоненты останутся в растворе), фильтруется и промывается несколькими небольшими порциями воды до нейтрального pH на фильтре. 4. Преимущество KOH по сравнению с KCl (для реакции обмена) в высокой растворимости гидроксидов калия и натрия по сравнению с хлоридами, что позволяет осадить относительно чистый хлорат калия без необходимости проведения трудоемкой дробной кристаллизации. (KCl/NaCl при данных массовых отношениях веществ частично окажется в осадке, что потребует разделения перекристаллизацией.) Недостаток - более высокая цена KOH, но для препаративного синтеза в небольших количествах это несущественно.
Химический процесс
1. Электрохимическое преобразование NaCl в водном растворе:NaCl + H2O = NaClO + H2 Cl- - 2e → Cl+ 2H+ + 2e → H2 2. Диспропорционирование гипохлорит-иона при температуре 40-60°С в водном растворе: 3NaClO → 2NaCl + NaClO3 3Cl+ → 2Cl- + Cl5+ 3. Обменная реакция осаждения хлората калия: NaClO3 + KOH → KClO3 + NaCl В процессе электролиза NaCl (вернее, хлорид-ионы) расходуется, превращаясь в NaClO, и частично вновь возвращается в электролит в результате преобразования гипохлорита, с коэффициентом 2/3 от исходного количества в предыдущей фазе реакции. Массовый процесс может быть описан посредством нисходящей геометрической прогрессии, но для целей препаративного синтеза можно упрощенно допустить, что при избытке NaCl его расчетное количество полностью преобразуется в NaClO3 по следующему суммарному уравнению (1+2): NaCl + 3H2O → NaClO3 + 3H2 Cl- - 6e → Cl5+ 6H+ + 6e → 3H2 Это уравнение необходимо для примерного расчета количества электроэнергии и продолжительности электрохимического процесса и расхода воды из раствора. Таблица растворимости веществ, участвующих или получающихся в ходе синтеза Растворимость веществ, г в 100 мл воды
Из таблицы видно, что электролиз NaCl дает обладающий высокой растворимостью NaClO3, что позволяет, при необходимости, использовать изначальный избыток NaCl, который будет постепенно переходить в раствор, близкий к насыщению, при этом NaClO3 останется в растворе и может быть отфильтрован от избытка остаточного NaCl и шлама.
Материальный расчет и уточнения
Предельная растворимость NaCl при 25°C: 35,9 г в 100 г воды = 88,5 г в 245 мл воды = 270 мл раствора. С учетом конструкции электролизера желательный объем электролита 350 мл (электроды погружены в раствор примерно на 90%, но без погружения коммутационных деталей анода). Таким образом, для сохранения пропорций необходимо 350/270*88,5 = 115 г NaCl и 350/270*245 = 318 мл воды. Приготовим раствор NaCl из 115 г NaCl и 320 мл H2O. Расчет времени электролиза будем проводить исходя из начальной массы NaCl (88.5 г), допустив, что избыточный NaCl остается в растворе для обеспечения достаточной полноты электрохимического преобразования.
Схема электролизера
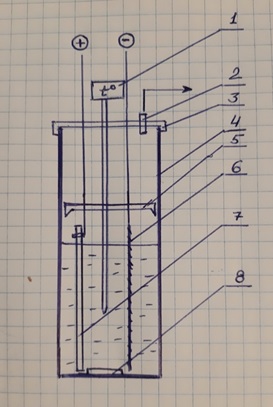 1 - термометр. В данной работе использовался цифровой термометр с металлическим щупом, погруженным в герметичную стеклянную трубку с водой. Однако над промежуточной крышкой-вставкой металл щупа заметно корродировал (сквозная коррозия). В дальнейшем лучше использовать обычный стеклянный термометр. 2 - газоотводная трубка, связанная с предохранительной склянкой и далее склянкой с раствором Na2S2O3 для улавливания избытка Cl2 (выделяется, в основном, в начале процесса из холодного электролита). 3 - герметичная крышка. 4 -электролизер - прямоугольный высокий стакан из ПЭТ (пищевой контейнер) с градуировкой объема, объем около 750 мл. 5 - негерметичная ПЭТ крышка-вставка для фиксации электродов (вырезана из обычной крышки для пищевых стеклянных банок). 6 - титановый сетчатый катод (который когда-то был платинированным). 7 - прямоугольный графитовый анод, примерно одного размера с катодом (10*5*0,5 см). Токовод - изолированный медный провод 2,5 мм2, присоединенный стальным болтом-стяжкой через просверленное в аноде отверстие. Место соединения и неизолированная часть провода покрыты изоляционным слоем клея из полистирола. 8 - вставка фарфоровая на дне электролизера для фиксации положения электродов.
Подготовка электролита
115 г NaCl хч растворили в 320 мл дистиллированной H2O при 22°С. На дне стакана осталось немного нерастворенной соли. После этого растворили 1,4 г K2CrO4 и раствор поместили в электролизер. Исходный объем раствора отметили меткой на корпусе.
Электролиз
Расчет продолжительности электролизаПараметры тока: 5,18А и 4,6-5,5V. Эти параметры взяты из предыдущих опытов. При этом имеющийся источник тока отдает почти максимальную мощность, а электролит в данных условиях стабильно удерживается в темепературном диапазоне 45-55°С, не требуя дополнительной терморегуляции (за исключением небольшого пассивного водяного охлаждения в последние часы вследствие расхода воды и уменьшения массы электролита). m = Q/F*M/z (закон Фарадея) M/z = 107/6 = 17,83 160,5 = Q/96485*17,83 Q = 868527 Кл При I = 5.18A время электролиза = 868527/(5,18*3600) = 46,57 час = примерно 2 суток, на теоретическое количество NaCl (88,5 г), избыточный NaCl останется в растворе. |

Электролизер, подготовленный к запуску |

Установка в сборе |
|
Установка
Справа налево:- лабораторный источник тока; - электролизер; - предохранительная склянка; - склянка с 10% р-ром тиосульфата натрия (для улавливания остаточного хлора).
Выполнение синтеза
Электролиз проводился 53 часа при I = 5,18 А, U = 4.6-5.5V. Ток был стабильным, напряжение немного менялось в процессе работы. После выхода на стабильный режим работы (где-то через 1 час) Т раствора в диапазоне 45-55°С самоподдерживалась при внешней температуре около 20°С. Ближе к концу синтеза для предотвращения избыточного роста температуры электролизер поместили в кювету с водой комнатной температуры.В начале электролиза (при холодном электролите) ощущался небольшой запах хлора, который по мере нагревания электролита исчез и впоследствии не проявлялся. Пробулькивание пузырьков газа (H2+O2) через промывную склянку происходило в первой 1/3 процесса, затем прекратилось (возможно из-за неполной герметичности контейнера и выхода газов через неплотности), ближе к концу процесса снова возобновилось. Объем электролита уменьшился на 90 мл. Т.к. конструкция электролизера практически исключает потерю воды в виде пара в данных условиях, можно считать это чистым расходом воды в электрохимическом процессе. По завершению электролиза установка разобрана. Графитовая пластина-анод осталась целой, без каких-то внешних следов коррозии. Немного корродировали контакты с тоководом из-за проникновения электролита под слой клея. Катод тоже целый, без признаков разрушения. Цифровой термометр, несмотря на меры предосторожности, вышел из строя. Нижняя часть, погруженная в геметизированную пробирку с водой, осталось невредимой, но часть щупа над внутренней вставкой электролизера подверглась сквозной коррозии, из-за чего прибор вышел из строя в конце электролиза. Электролит очищен от шлама вакуум-фильтрованием, бумажный фильтр "черная лента". Фильтрование достаточно долгое, т.к. фильтр быстро забивается мелкодисперсным шламом. Фильтрат - прозрачная жидкость желтого цвета без запаха. |

|
|
Для осаждения KClO3 взят KOH хч в количестве на 10% больше расчетного (111 гр вместо 100,6 гр).
KOH (чешуйки) добавляли небольшими порциями к фильтрату, налитому в большой стакан, при хорошем перемешивании фарфоровой ложкой, до визуального растворения щелочи. Почти сразу началось образование осадка, объем которого значительно вырос ближе к концу обменной реакции. Смесь сильно разогрелась. Ближе к концу добавления расчетного количества щелочи стакан поместили в контейнер с холодной водой во избежание закипания смеси. |

Фарфоровая ложка стоит в выпавшем обильном осадке |
|
После растворения всей щелочи смесь вынесли на холод (2-3°С) на несколько часов, после чего фильтровали осадок по следующей схеме.
1) Весь осадок отфильтровали на фильтре Шотта (в несколько приемов) под вакуумом и перенесли в стакан, куда добавили 40 мл воды, хорошо перемешали и снова охладили; 2) 2/3 осадка отфильтровали под вакуумом на воронке Бюхнера и промыли там же сперва 10 мл, затем 5 мл воды с максимальным отжимом вакуумом; 3) 1/3 осадка сняли с верхней части фильтра, остаток на фильтре промыли 10 мл воды с последующим отжимом; 4) далее сняли еще 1/3 исходного объема осадка, и оставшуюся 1/3 промыли еще 10 мл воды с отжимом, остаток собрали; 5) 1/3 основного промытого осадка (п.1) отжали, затем добавили 10 мл воды с отжимом, далее 5 мл воды с отжимом и еще 5 мл воды с отжимом. Промывками добивались почти полного обесцвечивания последних порций фильтрата (хромат калия дает желтый цвет даже при очень небольшой концентрации) и нейтрального pH взвеси пробы осадка в воде. Весь собранный осадок перенесли на фильтровальную бумагу в эмалированную чашку и сушили 12 ч при комнатной температуре, затем 2 раза по 35 минут при 90°С в сушильном шкафу. Получили однородное мелкокристаллическое вещество белого цвета (с чуть сероватым оттенком из-за мелких примесей графита). |

|
|
Проба на поджигание смеси хлората калия с сахаром с помощью концентрированной серной кислоты успешна.
Выход 130 г (72% от теоретического, без учета остатка в маточном растворе после первичной фильтрации и промывок). С учетом примерного остатка в маточниках (14,6+6,9 = 21,5 г) общий расчетный выход 83%. ***
Методика достаточно удобна для препаративного синтеза технического хлората калия KClO3, хорошо воспроизводится, не требует сложного оборудования и постоянного контроля. Вполне возможно использовать менее чистые реактивы, например, неиодированную пищевую поваренную соль.
|
|
Комментарии
К1
Подобный способ не очень любят из-за проблем с изгнанием ионов натрия из хлората. Вроде мелочь, а цветную пиротехнику может загадить на раз-два и целая куча хлората может отправиться в отходы.
При применении хлористого калия, итоговый хлорат обычно чист на натрий, пламя не желтое, а фиолетовое. И, да, использование "дешевого графического анода" при 60°C редко кончается хорошо ввиду его быстрого разрушения не в холодном растворе и загаживания раствора мелкой труднофильтруемой взвесью. Лучше графит двуокисью свинца покрыть. А исходный азотнокислый свинец получить посредством сплавления аммиачной селитры и окиси свинца, получаемой подсыпанием свинца в расплав калийной селитры(нитрит калия как бонус). Годится даже грязный свинец вроде дроби, но реакции проводить на улице или с вытяжкой. Вроде сложновато, но практически все хозмаговское и дробь продается без каких-либо бумаг в ближайшем оружейном всем кому ни лень. К1-1 С комментарием я не согласен, но поместил его в порядке обсуждения. Сам не делал (точнее делал, только не успел выделить хлорат из раствора ДО ухода из НИИ - вместо этого я просто забрал банку реактивного хлората), но знакомые рассказывали, что 1-2 перекристаллизаций вполне достаточно, чтобы избавиться от желтого оттенка пламени из-за натрия (- прим. ред.) К1-1-1 Поддерживаю. При правильной технологии натрий не соосаждается с хлоратом калия. Его примесь заключается лишь в маточном растворе, пропитывающем выпавшие кристаллы. В личной практике, ни разу не сталкивался с проблемами остаточного натрия (а циклов электролитического получения хлората, произвёл пару десятков). На сколько помню, всегда проводил двойную перекристаллизацию - первичную в обычной водопроводной воде, и вторую - в дистиллированной. Между этапами кристаллы на фильтре рекомендуют промывать ледяной водой, но этот пункт я в большинстве случаев упускал. Получаемый хлорат калия годился на любые нужды (и в первую очередь - на цветные огни). Произведёнными его запасами, я пользуюсь и по сей день. А вот на счёт покрытия анода оксидом свинца - это мысль интересная, её бы практически проверить. Тем не менее, и сам по себе графит держится весьма сносно: обычного графитового башмака троллейбуса хватает на три-четыре цикла (по 1.5 литра электролита). При температуре процесса - около сорока градусов Цельсия, но не выше. К2 По графитовому аноду, кстати, вообще интересная история. В первых опытах использовался цилиндрический анод, сначала один, затем два (катод - сетка в центре во втором случае). К концу электролиза анод сильно разрушался (до 30-40% объема, визуально). В последних двух работах был использован плоский прямоугольный анод (вернее, тонкий параллелепипед), площадью примерно равной катоду. Разрушение - в ходе двух последовательных электролизов - минимальное (визуально на аноде его вообще не видно, обнаруживается только в электролите и при вакуум-фильтровании в виде тонкого осадка на фильтре). Почему такая разница - вопрос для специалистов, то ли свойства самого графита в силу отличия технологии производства изделий, то ли значительная разница в течении процессов на поверхности цилиндрического и плоского электрода (напр., распределения плотности тока и т.п.). К3 Площадь анода цилиндрического достаточная была? Разрушение анода часто связано со слишком высокой плотностью тока. |