Chemistry and Chemists № 1 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2025 Journal of Chemists-Enthusiasts |
Alcoholometer Sank in Ethanol Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
The hydrometer (alcoholometer) sank in ethyl alcohol. The label on the industrial alcohol canister indicated "94%," while the hydrometer was calibrated up to 96%.
 If it weren't for the constant missile and drone attacks on our city, and the exhaustion from work, I might have been alarmed by this photo. In fact, I should have been. But fatigue had drained my ability to feel fear. There could have been two reasons why the alcoholometer sank in the alcohol. The first possibility was that the alcoholometer was of poor quality, perhaps "Made in China," and its readings were incorrect. The second, more concerning reason can be understood by answering this question: "Which alcohol is lighter than ethanol?" The correct answer is methanol. Let me explain. In the lab, I was juggling several tasks at once. Some were simple, requiring little time or mental effort. Others were physically demanding but didn't strain my thought processes. And then there were tasks I wasn't even sure could be solved in practice - because in theory, as we know, anything is possible, even "antimatter in your pocket" or a superluminal engine (a warp drive). One of the more feasible, but labor-intensive, tasks I dealt with was filtering metal powders suspended in ethyl alcohol. The metals varied, and some were toxic, such as nickel, antimony, cobalt, and vanadium. Fortunately, I had recently been filtering mainly non-toxic aluminum. The only inconvenience with aluminum was that its particles stained everything: hands, clothes, glassware, furniture, and the lab floor. Large particles left silver stains, while the smallest ones left black marks. As I write this, I've been filtering suspensions of different types of aluminum in alcohol for several weeks. I have a fume hood in my lab, but it's currently occupied with other work. As a result, I have to filter and dry the products directly on the lab tables, allowing ethyl alcohol vapors to freely enter the lab air. I understand that some might see this as a dream job. However, I don't drink alcohol, and that changes everything. My blood contains a low concentration of alcohol dehydrogenase, the enzyme responsible for metabolizing alcohol. During my last test, the doctor even remarked on the unusually low results, asking, "You don't drink alcohol at all?" This low enzyme level complicates my work. Alcohol vapors are absorbed through the lungs, and liquid alcohol can be absorbed through the skin. For me, even these small amounts are enough to cause significant health issues. In contrast, people who drink alcohol moderately have sufficient levels of alcohol dehydrogenase to neutralize small amounts of ethanol, but that's not my case. Moreover, ethyl alcohol lowers blood pressure, and mine is already low. As a result, I felt unwell for several weeks. No one was forcing me to stay in the lab - I could step outside for a break, or even take a day or two off. In fact, as the head of the lab, I only reported to the director. However, no one else was going to do the filtering for me, so I had to endure the atmosphere of alcohol vapors day after day. Even if the alcohol had been pure, this work would still be unhealthy. However, this was technical-grade alcohol. The odor filled half the corridor, but my colleagues couldn't tell it was ethyl alcohol just by the smell - they described it as "chemicals" or "the smell of chemistry." In reality, the alcohol I was working with smelled more like butanol or isoamyl alcohol (components of fusel oil) than ethanol. But these alcohols are denser than ethanol. Yet somehow, this mixture was lighter than 96% ethanol! What alcohol is lighter than ethanol? Methanol! It was entirely possible that the sellers had added methanol to the technical ethyl alcohol - or worse, sold methanol in place of it. A colleague on the forum argued that it is much more difficult to buy methanol than high-quality ethanol in our country. Legally speaking, that's true. The sale of methyl alcohol has been under strict regulation for many years, mainly because of the tragic incidents where people mistakenly consumed methanol, thinking it was ethanol, with fatal consequences. However, the production cost of technical methanol is quite low, and a significant portion of its trade happens illegally. It has been reported multiple times that methanol is added to household chemicals instead of ethanol. In fact, it was once legal to add methanol to household products specifically to prevent people from drinking them, encouraging the purchase of legally available alcoholic beverages (which are heavily taxed). Therefore, it was quite possible that the "ethyl alcohol" I was using contained a high concentration of methanol. It was also possible they sold methanol as ethanol. I've come across empty canisters labeled "methyl alcohol" several times before. While we don't use it in our work, these empty methanol canisters were purchased from a company for other uses. But if methanol and ethanol are being sold by the same supplier, it's not hard to imagine the possibility of accidental mislabeling - methanol being poured into canisters meant for ethanol. As I mentioned earlier, I'd been exposed to this alcohol for several weeks while filtering and drying samples in the lab. The alcohol occasionally got on my hands, but I was constantly breathing in the vapors. I have a fume hood, but it's often occupied, and when it's free, I hesitate to use it for a long time - the motor doesn't sound reliable, and I worry it might burn out if overworked. Then one day, a colleague sent me a photo of a "sunk" alcoholometer, with a comment that it was taken after filtration. At first, I was pleased. Here's what I thought: The original concentration of alcohol was 94%, according to the label, but after the process of dispersing aluminum particles, it appeared to be over 96%! The aluminum had been pulverized using either cavitation (one option) or electrical discharges (another). During the process, a side reaction occurred - aluminum reacted with water, producing aluminum hydroxide and hydrogen. This reaction was a drawback because it consumed aluminum. But this reaction meant the obtained finely dispersed aluminum was highly active, which was a good thing. I often observed hydrogen bubbles forming in the suspension. While aluminum can react with both water and ethyl alcohol, the reaction with water is much faster, so it made sense to me that the alcohol concentration would increase. However, after I sent my reply, my colleague deleted their original message and sent new photos with updated comments. It turned out the photo of the sunken hydrometer wasn't of the alcohol after the filtration process - it was alcohol from the original canister, labeled "94%." The hydrometer, calibrated up to 96%, had sunk in it before the alcohol was used for our process of aluminum pulverization. In the new photos, the hydrometer dipped in the alcohol after the pulverizing and filtering process had also sunk below the 96% mark, but it still floated on the surface. In other words, the concentration of the alcohol hadn't increased after the aluminum pulverization - it had actually decreased. What a twist! 
Water 
Ethyl alcohol (initial) 
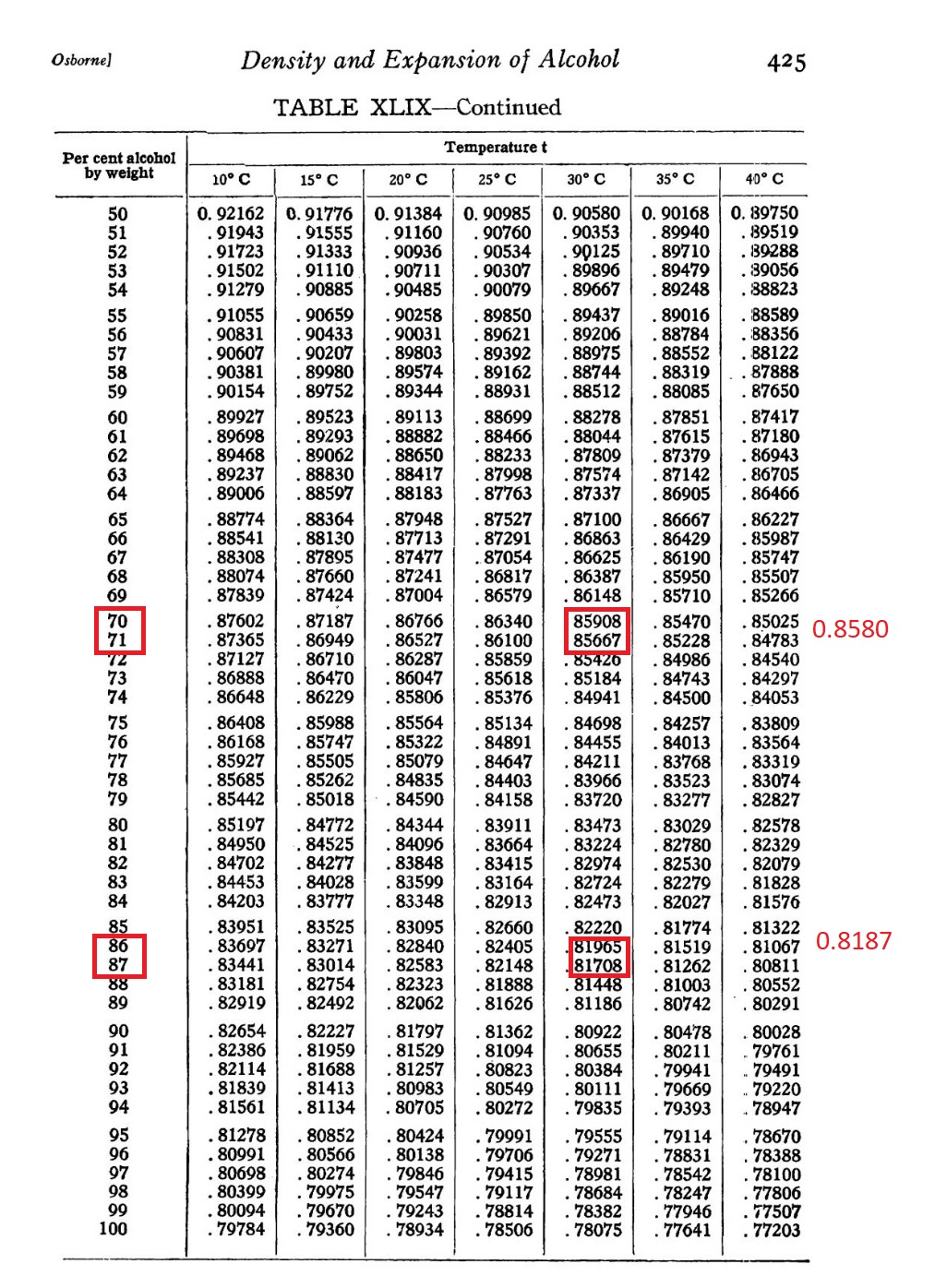
Ethyl alcohol (after the process) At first, I responded to my colleague with, "Try using another alcoholometer," but he didn't have one available. So, I decided to determine the density of the technical alcohol by weighing it. To do this accurately, analytical scales (with a precision of 0.0002 g) and pycnometers are typically used. First, you weigh the empty pycnometer, then fill it with the liquid up to a marked volume and weigh it again. The difference in weight gives you the mass of the alcohol, which is then divided by the volume to calculate its density. I didn't have a pycnometer or analytical scales. Instead, I used a 100 ml measuring flask and weighed it on a technical scale (with an accuracy of 0.005 g). After weighing the flask filled with the original alcohol, I calculated the density and arrived at a value of 0.8187. Consulting a reference table (for a temperature of 25°C), this corresponded to an alcohol concentration of 88%. My colleague then clarified that the actual temperature was not 25°C but closer to 30°C. I searched for a thermometer but couldn't find one, so I checked the temperature on my smartphone, which also indicated about 30°C. Later, I remembered I had a stack of mercury thermometers - checking one, it showed nearly 30°C. At that temperature, the alcohol concentration would be around 86-87%. This meant the alcohol was more diluted than the seller had claimed. The good news was that my suspicion about the presence of methanol in the ethanol was ruled out. Next, I measured the alcohol concentration after filtration. It came out to be about 70-71%. The bad news is that I had recently assured my colleague that the alcohol could be reused after the process, at least one more time. Now, I think that's impossible. During the process, the liquid not only heats up but also evaporates. Furthermore, water evaporates less readily than alcohol, so it accumulates in the remaining liquid. This water then reacts with the aluminum, contaminating it with aluminum hydroxide, which disrupts the process. P.S. Later, a colleague clarified that methanol was produced in our country in the city of Severodonetsk. Some of this methanol was sold illegally, so the price was cheap. Now the city of Severodonetsk has been captured and destroyed by the Russian army. We are forced to import methanol from abroad, which imposes additional transportation costs. Consequently, there is no more cheap methyl alcohol in our country. I did not know these facts at the time of the events described in the article. |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
|
Комментарии
К1
Я не знаю, был ли это единственный такой завод, просто знал, что они выпускали такие важные для производства продукты, как метанол и уксусная кислота.
Кстати, а отчего изначально было такое предположение, что плотность метанола должна быть заметно ниже плотности этанола? 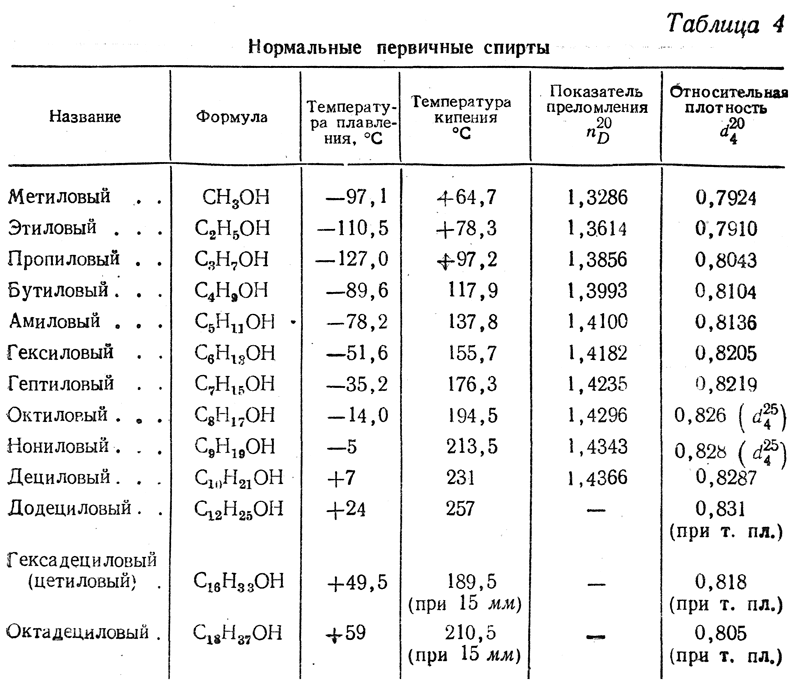 Второе, там ведь в канистре не чистый этанол, а технический спирт, кто знает, что там намешано. Если это "головка" от спиртовой фракции, там полно альдегидов. Видимо, на этикетке не зря указано содержание спирта 94%, а не 96%. Не знаю, правда, может ли эта примесь так кардинально понизить плотность, чтобы спиртометр утонул, может, действительно данный спиртометр имеет погрешность. Кстати, одно время был в продаже технический абсолютированный спирт и он был относительно недорогой. Его плотность действительно заметно ниже плотности азеотропа. К1-1 В начале гомологического ряда плотность веществ растет с ростом молярной массы, причем чем дальше - тем слабее. Это видно, например, по приведенной таблице. В случае метанола и муравьиной кислоты эту зависимость, видимо, нарушают более сильные водородные связи. Но о таких мелочах я тогда не подумал (тем более - надышавшись этанола). Насчет завода метанола - там колонна, аналогичная колонне синтеза аммиака. Как правило они были на том же производстве. Заводов, выпускающих аммиак, у нас было несколько. Горловка и Северодонецк - потеряны. Черкассы - город, слава богу, стоит, что с "Азотом" - не знаю. Вряд ли он работает. В любом случае, метанол он не делал. К1-1-1 Рассмотрел внимательнее фото ареометра. Это бытовой спиртометр, для самогонщиков. Он запросто может давать очень приблизительную точность. У меня такой похожий где-то был. И был еще нормальный лабораторный спиртометр, он размером побольше и шкала у него более подробная. "Азот" в Каменском, по-моему, тоже стоит. Но там метанол и не делали. Аммиак, карбамид, каустик, хлор, солянка, гипохлорит. За гипохлоритом когда-то сам на завод ездил. Кстати, когда-то там были целых два отдельных цеха фосгена. На изоцианаты. К2 А на дистильованій воді перевіряли колбу? Показало щось подібне до 1000 г/дм3? К2-1 Потреби немає. Калібрування мірного посуду проводять, коли він використовується для серйозного хімічного аналізу, не щоб перевірити побутовий спиртометр. |