Chemistry and Chemists № 1 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2025 Journal of Chemists-Enthusiasts |
Precipitation of iron(III) hydroxide during freezing of water Volodymyr M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Precipitation of iron(III) hydroxide during freezing of water
When seawater partially freezes, fresh ice is formed. It almost doesn't contain salt. Icebergs consist of fresh water, which is quite suitable for drinking, unlike seawater, which contains too many dissolved salts to be potable. Prolonged consumption of seawater causes kidney failure. Many people who have been shipwrecked at sea did not die from drowning, sharks, or "evil pirates", but from thirst. Surrounded by an ocean of water, they had nothing drinkable!
Осаждение гидроксида железа (III) при замораживании воды But enough lyrical digressions. At the initial stages of seawater freezing, only pure water transitions into the solid phase, while sodium chloride and other dissolved salts remain in the liquid solution. This principle forms the basis for a method of purifying drinking water, including low-quality tap water. Water is poured into plastic bottles and placed in a freezer, where it is left until some of it freezes. The remaining liquid water is discarded (or used for technical purposes) because its salt concentration is higher than that of the original tap water. The resulting ice is then melted and used as purified water - it contains significantly fewer salts than the original [1]. Now, here's a question: what happens if the water is completely frozen and then melted? For instance, let's consider freezing tap water or seawater. Initially, only pure water transitions to the solid phase, causing salts to accumulate in the remaining liquid solution. As the concentration of salts increases, the solution's freezing point decreases. Eventually, when the concentration of dissolved salts reaches a certain threshold, the salts will also begin to form solid phases. At this stage, the entire solution will freeze. If such ice is melted, the solid salts will dissolve back into the water. The resulting water will be identical in composition to the original. I did not doubt the correctness of the above conclusions, so I didn't even think to verify them. However, it turned out that the latter conclusion is not always true, and I discovered this by chance. During a synthesis, I needed to cool the reaction mixture with ice. I poured tap water into a plastic container and froze it. As the synthesis progressed, the ice melted, leaving liquid water in the container once again. Later, I noticed a compact brown precipitate of iron (III) hydroxide at the bottom of the container. The original water had no visible precipitate but did contain dissolved iron salts. When left at room temperature, this water sometimes produced a brown precipitate and sometimes didn't. Even when the precipitate formed, it created a suspension that settled very slowly. However, after the freeze-thaw cycle, a compact brown precipitate immediately formed at the bottom. I believe this phenomenon can be explained as follows: During the freezing process, pure water begins to solidify first, which increases the concentration of dissolved salts in the remaining liquid. In my city, tap water is slightly alkaline due to the partial hydrolysis of dissolved salts, such as bicarbonates. As the concentration of these salts increases, the solution becomes more alkaline (pH rises). This increased alkalinity can cause the precipitation of iron (III) hydroxide and sharply accelerate the oxidation of dissolved iron (II) to iron (III). Additionally, the higher electrolyte concentration can cause the coagulation of iron (III) hydroxide particles. Consequently, instead of forming a colloidal solution or a slowly settling suspension, a compact precipitate is produced. Note that the resulting iron (III) hydroxide does not dissolve once the ice melts. Many chemical and physical transformations that occur during the freezing of aqueous solutions can be irreversible when the ice melts. Here, we have examined just one example. __________________________________________________ 1 Note, that such water requires boiling or using another method of disinfection since many bacteria survive freezing. Обратите внимание, такая вода требует кипячения или применения другого способа обеззараживания, поскольку многие бактерии переживают заморозку. |
|
Осаждение гидроксида железа (III) при замораживании воды
При частичном замерзании морской воды образуется пресный лед. Он почти не содержит соли. Айсберги состоят из пресной воды, вполне пригодной для питья, в то время как морскую воду пить нельзя - она содержит слишком много растворенных солей. В случае длительного употребления такой воды у человека отказывают почки. Много людей, потерпевших кораблекрушение в море, погибли не от утопления, не от акул и не от "злых пиратов", а от жажды: вокруг простирался целый океан воды, а пить было нечего!
Но хватит лирических отступлений. На начальных стадиях замерзания морской воды в твердую фазу переходит только чистая вода, в то время как хлорид натрия и другие растворенные соли накапливаются в растворе. На данном принципе основан метод отчистки питьевой воды, в частности, некачественной водопроводной воды. Воду наливают в пластиковые бутылки, которые помещают в холодильник и выдерживают до тех пор, пока часть воды не замерзнет. Воду, которая осталась жидкой, отбрасывают (или используют для технических целей) - концентрацию солей в этой воде выше, чем в исходной водопроводной воде. Образовавшийся лед растапливают и используют как чистую воду - она содержит гораздо меньше солей, чем исходная вода [1]. Внимание, вопрос: что будет, если воду заморозить полностью, а потом растопить? Например, начнем охлаждать водопроводную или морскую воду. Сначала в твердую фазу будет переходить исключительно вода, а соли будут накапливаться в оставшемся жидком растворе. Температура замерзания раствора будет понижаться по мере увеличения концентрации солей. Когда концентрация растворенных солей достигнет определенного предела, соли также начнут переходить в твердую фазу. В результате весь раствор затвердеет. Если такой лед растопить, твердые соли опять растворятся в воде. Полученная вода будет идентична исходной воде. В достоверности приведенных размышлений я не сомневался, поэтому даже не думал их проверять. Оказалось, что последний вывод не всегда соответствует действительности. Узнал об этом я случайно. Для синтеза понадобилось охлаждение реакционной смеси льдом. Я налил водопроводную воду в пластиковую емкость и заморозил ее. Провел синтез, в его процессе лед растаял, и в емкости снова была жидкая вода. Позже я заметил, что на дне пластиковой емкости образовался компактный коричневый осадок гидроксида железа (III). Исходная вода видимых частиц осадка не содержала, зато она содержала растворенные соли железа. При стоянии такой воды при комнатной температуре коричневый осадок иногда выпадал, а иногда нет. Даже, когда осадок формировался, он образовывал суспензию, которая оседала очень медленно. Зато после цикла заморозки - размораживания воды на дне сразу образовался компактный коричневый осадок. Я считаю, что описанное явление можно легко объяснить. Итак, в процессе охлаждения раствора сначала начинает замерзать чистая вода, в результате концентрация растворенных солей увеличивается. Водопроводная вода в нашем городе слабощелочная из-за частичного гидролиза растворенных солей, например, гидрокарбонатов. Увеличение концентрации растворенных солей делает раствор более щелочным (pH растет), что может вызвать осаждение гидроксида железа (III), а также резко ускорить окисление растворенного железа (II) до железа (III). Кроме того, увеличение концентрации электролитов может вызвать коагуляцию частиц гидроксида железа (III). В результате вместо коллоидного раствора или медленно оседающей суспензии образуется компактный осадок. Обратите внимание, что образовавшийся гидроксид железа (III) уже не растворится после того, как лед растает. Много химических и физических превращений, которые происходят при замерзании водных растворов, могут быть необратимыми при таянии льда. Здесь мы рассмотрели только один пример. |
_hydroxide_during_freezing_water-1.jpg)
Precipitation of iron(III) hydroxide during freezing of water |
_hydroxide_during_freezing_water-2.jpg)
|
_hydroxide_during_freezing_water-3.jpg)
|
_hydroxide_during_freezing_water-4.jpg)
|
_hydroxide_during_freezing_water-5.jpg)
Water jet pump: after long-term operation, iron hydroxide (III) precipitate formed on the glass walls |
Does methylene blue dye white flowers? Volodymyr M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
My friend is a nuclear physicist, but her hobby is growing indoor plants, particularly orchids. One day, she told me she had watered a white orchid with a solution of methylene blue (a dye), and as a result, the orchid's flowers turned blue!
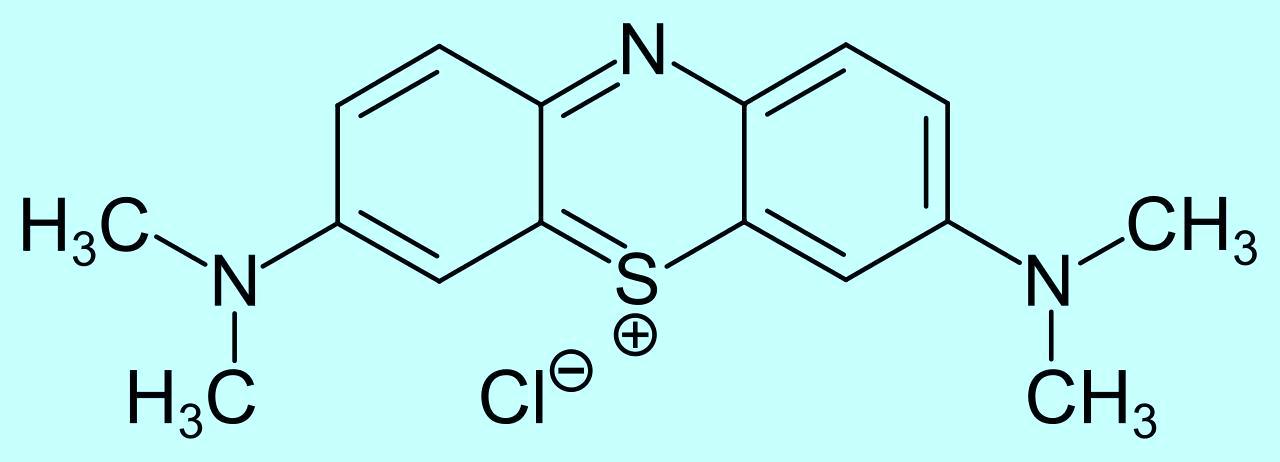

Methylene blue This piqued my curiosity - it sounded like a fascinating experiment! However, I had my doubts. Back in my school days, I had conducted similar experiments. For instance, I placed cut stems of plants with white flowers in a beaker of methylene blue solution, but neither the flowers nor the leaves turned blue - not even a hint of a blue tint appeared. It is easy to predict that watering the soil where plants with white flowers grow with a dye solution will not cause the flowers to change color. I am a chemist, not a biologist, but I do recall what we were taught in school biology lessons: plant roots absorb inorganic substances but not organic ones. The cells in plant roots act as a selective membrane. For example, roots can absorb ammonium nitrate but not substances like sugar or organic dyes. Of course, if you immerse plant stems directly in a methylene blue solution instead of watering the roots, this restriction is bypassed. The solution comes into direct contact with the capillaries of the plant stem, creating the possibility for the dye to reach the flowers and alter their color. Nevertheless, in my school experiments, even under these conditions, the flowers remained white. In any case, this experiment is easy to replicate. Methylene blue is readily available, and since it was spring and white flowers were blooming everywhere, I decided to give it a try. First, I picked several white flowers growing near the laboratory and placed their stems in a jar filled with a methylene blue solution. I didn't know the name of the plant, but that wasn't necessary for a preliminary trial. The flowers stood in the solution for a day, then began to wilt, yet their color remained unchanged - no trace of blue was visible. Next, I tried the experiment with a stem bearing white cherry blossoms. Again, the blossoms didn't turn blue. Finally, I used stems with pale pink apple blossoms, which also showed no color change. In all cases, neither the white nor the pink blossoms altered their natural hues when their stems were placed in the methylene blue solution. |

When treated with a methylene blue solution, the white and pink flowers did not change color |

|

|

|

|

|

|

|

|

|

|
|
The only part of the experiment that pleased me was dissolving methylene blue in water; the process was unexpectedly beautiful.
So, what conclusion can be drawn? My friend had deceived me. Later, I realized this wasn't unusual for her - she often finds enjoyment in deception, treating it as a kind of psychological game, even when it brings no benefit. After that, I became a bit more cautious about taking people at their word! |
|
Единственная часть эксперимента, которая меня порадовала, - растворение метиленового синего в воде: процесс неожиданно оказался красивым.
Какой можно сделать вывод? Знакомая меня обманула. Позже я заметил, что она часто так делает - обман доставляет ей моральное удовольствие, даже когда он не приносит никакой выгоды. Для человека это что-то вроде психологической игры. Вот и верь после этого людям! |
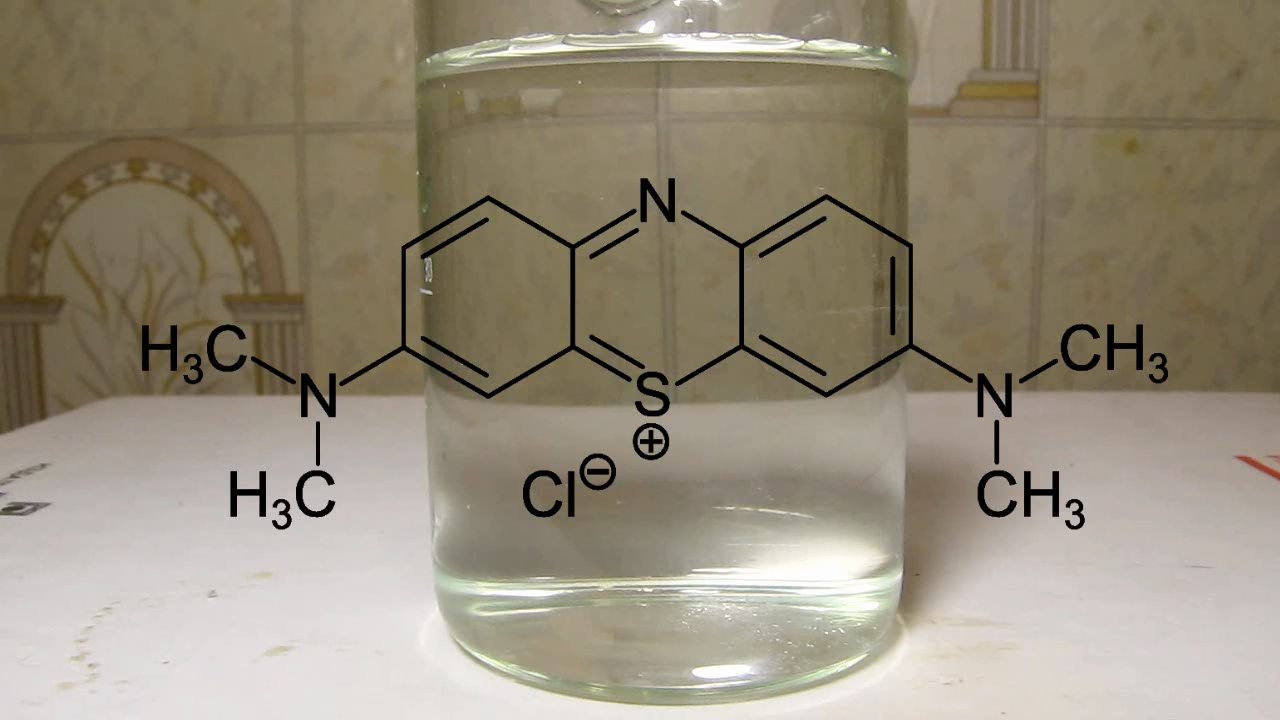
Methylene blue is dissolving in water |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|