Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Как известно, при электролизе водных растворов солей щелочные металлы не выделяются в индивидуальном виде, поскольку в электрохимическом ряду напряжений они стоят гораздо левее водорода. Более того, все щелочные металлы при комнатной температуре активно взаимодействуют с водой. Литий реагирует с водой спокойно, но, начиная с натрия, реакция щелочных металлов с водой может сопровождаться воспламенением и взрывом.
Оказывается, есть способ обойти даже такой запрет, как невозможность выделения щелочных металлов из водного раствора. Способ простой: электролиз с ртутным катодом. Чтобы не изобретать велосипед, приведу цитату из книги Гроссе Э., Вайсмантель X. - Химия для любознательных. Основы химии и занимательные опыты [ссылка].
С самого начала надо привыкать работать с малыми количествами веществ (это экономит химикаты и время и приучает к точности). Поэтому выберем несколько небольших сосудов, применяемых, например, для полумикроанализа. Возьмем маленькие фарфоровые тигли (высотой 1,5 см). В один из них нальем немного ртути. Затем поставим его в химический стакан на 50 мл, который на 3/4 наполним концентрированным раствором поваренной соли. Стакан поставим в плоскую чашку или кювету. Теперь нужны два электрода. Анод должен быть графитовый, так как на нем выделяется химически активный хлор. Воспользуемся угольным стержнем от батарейки для карманного фонарика или сделаем графитовый стержень. Катодом может служить вязальная спица, которую надо заплавить в стеклянную трубку так, чтобы с одной стороны торчал кончик длиной 1,5-2 мм (см. рисунок). Этим концом погрузим катод в ртуть (стеклянная трубка также должна смачиваться ртутью).
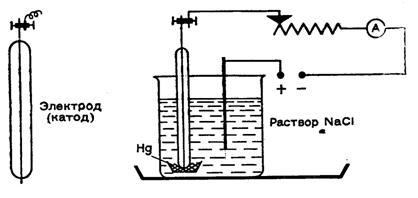
Теперь можно включить цепь постоянного тока. Удобнее всего работать с напряжением 12 В (аккумулятор), поддерживая в течение 3-5 мин ток 1 А. Работайте без страха, ведь так же протекает процесс в батарее карманного фонарика! Конечно, в цепь желательно ввести переменное сопротивление и амперметр. Мы заметим, что на угольном стержне образуются мелкие пузырьки газа, в котором легко узнать хлор - и по запаху, и с помощью влажной крахмальной бумажки, смоченной иодидом калия (посинение). На катоде, если ртуть чистая, ничего не наблюдается.
Через некоторое время прекратим подачу тока и пинцетом или тигельными щипцами вытащим тигель из стакана. Осторожно сольем раствор поваренной соли, находящийся в тигле над ртутью. Оставшиеся капли высушим полоской фильтровальной бумаги. Затем наполним тигель до середины дистиллированной водой, которую также быстро сольем и вновь высушим ртуть. Таким образом, мы удалим оставшиеся на ртути следы поваренной соли.
Выльем ртуть в маленькую пробирку (через воронку!) и нальем в нее примерно 3 мл дистиллированной воды. Через некоторое время на поверхности ртути начнут выделяться пузырьки газа. Как уже упоминалось, мы имеем дело не с чистой ртутью, а с амальгамой натрия, которая при соприкосновении с водой образует гидроксид натрия, в то время как водород улетучивается.
Отберем пипеткой пробу жидкости и подействуем на нее одним из индикаторов - лакмусом, фенолфталеином или метиловым оранжевым. Красная лакмусовая бумажка в основной среде посинеет, бесцветный спиртовой раствор фенолфталеина сильно покраснеет, а раствор метилового оранжевого приобретет желтую окраску.
Для получения кислой среды (проверим с помощью лакмуса) добавим к другой пробе того же раствора разбавленную азотную кислоту и затем несколько капель раствора нитрата серебра. Если осадок не выпадет, то это означает, что полученный едкий натр не загрязнен хлором. В противном случае образуется белый осадок хлорида серебра:
Хлорид серебра растворяется при добавлении нескольких капель концентрированного водного раствора аммиака, в результате образуется диамминохлорид серебра (I):
Если вас интересует только рабочая установка для получения амальгамы натрия путем электролиза хлорида натрия с ртутным катодом, рекомендую сразу перейти к описанию второго эксперимента [ссылка]. Ниже дано описание не совсем удачного первого опыта.
Решил разделить катодное и анодное пространства, поместив катод и анод в два разных стаканчика на 100 мл. Налил в них насыщенный раствор хлорида натрия (приготовлен из каменной соли с последующим фильтрованием). Стаканчики соединил перевернутой U-образной трубкой, заполненной раствором. Чуть позже - дополнительно соединил стаканы дополнительным мостиком - U-образной трубкой с раствором хлорида натрия, загущенным крахмалом (до консистенции геля).
На дно одного стаканчика налил 100 г ртути, опустил в него железную проволоку в оболочке из стеклянной трубки (концы трубки загерметизировал термоклеем). Анод - графитовый стержень (электрод для резки металла).
Скажу сразу: описанное "усовершенствование" установки для электролиза с ртутным катодом было явной глупостью. Включил блок питания - сразу выставил напряжение 12 В (тоже глупость: если бы сопротивление ячейки было меньше - мог сгореть блок питания, т.к. ток вырос бы слишком сильно). Но оказалось, что ток был всего 0.01 А - мизер.
Значит сопротивление ячейки слишком высокое. БОльшую часть этого сопротивления давала U-образная трубка с раствором. Попробовал перенести графитовый электрод в стаканчик со ртутью (т.е. два электрода в одном стакане). От контакта графита с поверхностью раствора раздался резкий треск, ток быстро подскочил до 0.8 А. Сразу же убрал графит, чтобы не сгорел блок питания (иначе ток вырос бы гораздо сильнее). Вернул графитовый электрод в другой стаканчик.
Электролиз пошел. На графитовом аноде - слабое выделение пузырьков газа, запах хлора. На поверхности ртутного катода, увы, - выделение пузырьков водорода. У Гроссе написано, что такое происходит, если ртуть не чистая. Выделение пузырьком водорода с поверхности ртути было довольно интенсивным. Универсальная индикаторная бумажка показала в катодном пространстве рН=10, в анодном рН = 3. Высокое рН католита (раствора возле катода) свидетельствует, что вместо ионов натрия на ртути разряжаются ионы водорода - т.е. надежды, что в опыте получится амальгама натрия, уже тогда было мало.
Со временем раствор в стаканчике с ртутным катодом стал бело-мутным. Вероятная причина - осаждение гидроксидов кальция и магния (в каменной соли содержится достаточно этих металлов).
У Гроссе было рекомендовано пропускать ток 1 А при напряжении 12 В в течение 3-5 мин. Я пропускал ток 0.01-0.02 А при напряжении 12 В в течение 3.5 ч. Потом выключил ток, вылил из стаканчика со ртутью электролит и промыл содержимое несколько раз дистиллированной водой. Налил свежую порцию дистиллированной воды. Выделение водорода с поверхности ртути не наблюдалось. При стоянии над ртутью дистиллированная вода не только не стала щелочной (что имело бы место при реакции амальгамы натрия с водой), но даже имела слабокислый рН (это обычное явление, т.к. в воде растворяется углекислый газ из воздуха).
Вывод: ртуть после электролиза практически не содержала растворенного натрия.
Какие возможные причины неудачи? На форуме участники подсказали: в промышленности при электролизе со ртутным катодом в рассоле регламентируется содержание кальция и магния. Некоторые тяжелые металлы, в частности хром и ванадий, даже в мизерных количествах отрицательно влияют на процесс электролиза. Приведу цитаты из книги Томилов А.П. Прикладная электрохимия (1984) [ссылка].
На процесс электролиза значительное влияние оказывают некоторые примеси, присутствующие в рассоле, поэтому их содержание в рассоле регламентировано. Так, содержание кальция в рассоле может быть не более 1 г, магния - 0.005 г/л. При более высоком содержании ионов этих металлов образуются гидроксиды, которые осаждаются на ртутном катоде, экранируя часть его поверхности. Участки катода, свободные от нерастворимых гидроксидов, работают при высоких плотностях тока и на них образуется концентрированная амальгама, разлагающаяся в электролизере с высокой скоростью с образованием щелочи и водорода.
Установлено, что существенное влияние на катодный процесс оказывают ионы некоторых металлов, которые могут находиться в рассоле в количестве десятых и сотых долей миллиграмма. К таким металлам относятся германий, ванадий, молибден и хром. Очистку рассола от ионов этих металлов рекомендуется проводить с помощью амальгамы натрия или применять сорбционные методы, основанные на пропускании рассола через колонны, заполненные ионообменными смолами.
Оказывается, есть способ обойти даже такой запрет, как невозможность выделения щелочных металлов из водного раствора. Способ простой: электролиз с ртутным катодом. Чтобы не изобретать велосипед, приведу цитату из книги Гроссе Э., Вайсмантель X. - Химия для любознательных. Основы химии и занимательные опыты [ссылка].
С самого начала надо привыкать работать с малыми количествами веществ (это экономит химикаты и время и приучает к точности). Поэтому выберем несколько небольших сосудов, применяемых, например, для полумикроанализа. Возьмем маленькие фарфоровые тигли (высотой 1,5 см). В один из них нальем немного ртути. Затем поставим его в химический стакан на 50 мл, который на 3/4 наполним концентрированным раствором поваренной соли. Стакан поставим в плоскую чашку или кювету. Теперь нужны два электрода. Анод должен быть графитовый, так как на нем выделяется химически активный хлор. Воспользуемся угольным стержнем от батарейки для карманного фонарика или сделаем графитовый стержень. Катодом может служить вязальная спица, которую надо заплавить в стеклянную трубку так, чтобы с одной стороны торчал кончик длиной 1,5-2 мм (см. рисунок). Этим концом погрузим катод в ртуть (стеклянная трубка также должна смачиваться ртутью).
Теперь можно включить цепь постоянного тока. Удобнее всего работать с напряжением 12 В (аккумулятор), поддерживая в течение 3-5 мин ток 1 А. Работайте без страха, ведь так же протекает процесс в батарее карманного фонарика! Конечно, в цепь желательно ввести переменное сопротивление и амперметр. Мы заметим, что на угольном стержне образуются мелкие пузырьки газа, в котором легко узнать хлор - и по запаху, и с помощью влажной крахмальной бумажки, смоченной иодидом калия (посинение). На катоде, если ртуть чистая, ничего не наблюдается.
Через некоторое время прекратим подачу тока и пинцетом или тигельными щипцами вытащим тигель из стакана. Осторожно сольем раствор поваренной соли, находящийся в тигле над ртутью. Оставшиеся капли высушим полоской фильтровальной бумаги. Затем наполним тигель до середины дистиллированной водой, которую также быстро сольем и вновь высушим ртуть. Таким образом, мы удалим оставшиеся на ртути следы поваренной соли.
Выльем ртуть в маленькую пробирку (через воронку!) и нальем в нее примерно 3 мл дистиллированной воды. Через некоторое время на поверхности ртути начнут выделяться пузырьки газа. Как уже упоминалось, мы имеем дело не с чистой ртутью, а с амальгамой натрия, которая при соприкосновении с водой образует гидроксид натрия, в то время как водород улетучивается.
Отберем пипеткой пробу жидкости и подействуем на нее одним из индикаторов - лакмусом, фенолфталеином или метиловым оранжевым. Красная лакмусовая бумажка в основной среде посинеет, бесцветный спиртовой раствор фенолфталеина сильно покраснеет, а раствор метилового оранжевого приобретет желтую окраску.
Для получения кислой среды (проверим с помощью лакмуса) добавим к другой пробе того же раствора разбавленную азотную кислоту и затем несколько капель раствора нитрата серебра. Если осадок не выпадет, то это означает, что полученный едкий натр не загрязнен хлором. В противном случае образуется белый осадок хлорида серебра:
Ag+ + Сl- < = > AgCl (нерастворим)
В уравнении непременно нужно ставить двойную стрелку, так как все реакции осаждения равновесные. В данном случае равновесие почти полностью смещено в сторону AgCl. Хлорид серебра растворяется при добавлении нескольких капель концентрированного водного раствора аммиака, в результате образуется диамминохлорид серебра (I):
AgCl + 2NH3 < = > [Ag(NH3)2]Сl (растворим)
После окончания опыта все сосуды хорошо вымоем. Еще раз промоем водой ртуть и поместим ее в хорошо закрывающуюся склянку. Если вас интересует только рабочая установка для получения амальгамы натрия путем электролиза хлорида натрия с ртутным катодом, рекомендую сразу перейти к описанию второго эксперимента [ссылка]. Ниже дано описание не совсем удачного первого опыта.
Решил разделить катодное и анодное пространства, поместив катод и анод в два разных стаканчика на 100 мл. Налил в них насыщенный раствор хлорида натрия (приготовлен из каменной соли с последующим фильтрованием). Стаканчики соединил перевернутой U-образной трубкой, заполненной раствором. Чуть позже - дополнительно соединил стаканы дополнительным мостиком - U-образной трубкой с раствором хлорида натрия, загущенным крахмалом (до консистенции геля).
На дно одного стаканчика налил 100 г ртути, опустил в него железную проволоку в оболочке из стеклянной трубки (концы трубки загерметизировал термоклеем). Анод - графитовый стержень (электрод для резки металла).
Скажу сразу: описанное "усовершенствование" установки для электролиза с ртутным катодом было явной глупостью. Включил блок питания - сразу выставил напряжение 12 В (тоже глупость: если бы сопротивление ячейки было меньше - мог сгореть блок питания, т.к. ток вырос бы слишком сильно). Но оказалось, что ток был всего 0.01 А - мизер.
Значит сопротивление ячейки слишком высокое. БОльшую часть этого сопротивления давала U-образная трубка с раствором. Попробовал перенести графитовый электрод в стаканчик со ртутью (т.е. два электрода в одном стакане). От контакта графита с поверхностью раствора раздался резкий треск, ток быстро подскочил до 0.8 А. Сразу же убрал графит, чтобы не сгорел блок питания (иначе ток вырос бы гораздо сильнее). Вернул графитовый электрод в другой стаканчик.
Электролиз пошел. На графитовом аноде - слабое выделение пузырьков газа, запах хлора. На поверхности ртутного катода, увы, - выделение пузырьков водорода. У Гроссе написано, что такое происходит, если ртуть не чистая. Выделение пузырьком водорода с поверхности ртути было довольно интенсивным. Универсальная индикаторная бумажка показала в катодном пространстве рН=10, в анодном рН = 3. Высокое рН католита (раствора возле катода) свидетельствует, что вместо ионов натрия на ртути разряжаются ионы водорода - т.е. надежды, что в опыте получится амальгама натрия, уже тогда было мало.
Со временем раствор в стаканчике с ртутным катодом стал бело-мутным. Вероятная причина - осаждение гидроксидов кальция и магния (в каменной соли содержится достаточно этих металлов).
У Гроссе было рекомендовано пропускать ток 1 А при напряжении 12 В в течение 3-5 мин. Я пропускал ток 0.01-0.02 А при напряжении 12 В в течение 3.5 ч. Потом выключил ток, вылил из стаканчика со ртутью электролит и промыл содержимое несколько раз дистиллированной водой. Налил свежую порцию дистиллированной воды. Выделение водорода с поверхности ртути не наблюдалось. При стоянии над ртутью дистиллированная вода не только не стала щелочной (что имело бы место при реакции амальгамы натрия с водой), но даже имела слабокислый рН (это обычное явление, т.к. в воде растворяется углекислый газ из воздуха).
Вывод: ртуть после электролиза практически не содержала растворенного натрия.
Какие возможные причины неудачи? На форуме участники подсказали: в промышленности при электролизе со ртутным катодом в рассоле регламентируется содержание кальция и магния. Некоторые тяжелые металлы, в частности хром и ванадий, даже в мизерных количествах отрицательно влияют на процесс электролиза. Приведу цитаты из книги Томилов А.П. Прикладная электрохимия (1984) [ссылка].
На процесс электролиза значительное влияние оказывают некоторые примеси, присутствующие в рассоле, поэтому их содержание в рассоле регламентировано. Так, содержание кальция в рассоле может быть не более 1 г, магния - 0.005 г/л. При более высоком содержании ионов этих металлов образуются гидроксиды, которые осаждаются на ртутном катоде, экранируя часть его поверхности. Участки катода, свободные от нерастворимых гидроксидов, работают при высоких плотностях тока и на них образуется концентрированная амальгама, разлагающаяся в электролизере с высокой скоростью с образованием щелочи и водорода.
Установлено, что существенное влияние на катодный процесс оказывают ионы некоторых металлов, которые могут находиться в рассоле в количестве десятых и сотых долей миллиграмма. К таким металлам относятся германий, ванадий, молибден и хром. Очистку рассола от ионов этих металлов рекомендуется проводить с помощью амальгамы натрия или применять сорбционные методы, основанные на пропускании рассола через колонны, заполненные ионообменными смолами.




















































