Химия и Химики № 2 2018
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2018 Журнал Химиков-Энтузиастов |
Определение концентрации гипохлорита натрия в чистящем средстве ''Белизна'' Determination of sodium hypochlorite in bleach ''Belizna'' Alexandrio |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Каждый из нас не обходится без применения такого чистящего и дезинфицирующего средства как " Белизна". Средство представляет собой водный раствор гипохлорита натрия, обладает окислительным (обесцвечивающим), обеззараживающим и моющим действием - за счет активного хлора и щелочи. Различных торговых марок, под которыми в наше время выпускают это средство, великое множество. Нечто вроде: "Белизна-люкс", "Супер-Белизна", "Мега-Белизна", "Белизна-Вы-Такой-Еще-Не-Видели" и т.д. - чего только не придумают маркетологи, чтобы продать свой товар....
Кстати, о товаре. Часто приходится покупать средство "Белизна" разных торговых марок, и при этом мы редко задумываемся над выбором продукции конкретного производителя. Примерно, как при покупке спичек: "Дайте мне, пожалуйста: два черных пакета, мыло - вон то и бутылку "Белизны"". Однако замечаешь, что не вся "Белизна" одинакова. Средство "Белизна" одних производителей (а то и вообще - одних партий) работает хорошо, а других - не очень. Иногда "плохие" и "хорошие" образцы чистящего средства можно отличить по запаху, по цвету, но восприятие цветов и запахов - сугубо индивидуально. И невольно задумываешься - а каким относительно простым способом можно определить качество сего продукта? И способ был найден: измерение плотности раствора при определенной температуре. Такой подход вызывает ряд возражений, - которые мы рассмотрим в конце. Для начала проверим предложенный способ определения качества "Белизны" с помощью более серьезного метода - химического анализа. А именно - йодометрии. Йодометрия - метод, который помог подтвердить, что чем больше плотность средства "Белизна", тем больше в ней активного вещества (а им является гипохлорит натрия). А теперь - практика! Были куплены три средства "Белизна" разных производителей (образцы пронумерованы в порядке возрастания цены). |
№1 
|
№2 
|
№3 
|
|
Замеры плотностей (при 25°C) показали следующее:
r1 = 1.029 г/мл, r2 = 1.065 г/мл, r3 = 1.010 г/мл. А результаты вычисления массовой концентрации оказались таковы [K1]: C1(NaClO) = 2.2 %, C2(NaClO) = 4.0 %, C3(NaClO) = 0.8 %. Это подтверждает, что можно обойтись замером плотности. И совсем не обязательно для этого пользоваться ареометром. Нужно иметь электронные весы с точностью 0.01 г, шприц на 10 мл и термометр. А если интересующие пробы и шприц поместить в какое-нибудь место, где нет резких перепадов температур, то можно обойтись и без "градусника". Ниже приведен ход анализа пробы №1 при помощи йодометрии. 1) Взвесил 10.00 г "Белизны", 2) разбавил данную массу в 25 раз, 3) поместил 10.00 г полученного разбавленного р-ра в коническую колбу на 250 мл
4) Добавил 10 мл 10 % раствора KI
5) Прибавил 20 мл 0.5 М раствора серной кислоты
и поместил в темное место на 5 мин. 6) Начал добавлять 0.1 М раствор тиосульфата натрия до получения соломенно-желтой окраски жидкости
На это действие ушло 2.16 г раствора Na2S2O3. 7) Для более точного титрования добавил 3 мл раствора крахмала
8) Дотитровал р-р до обесцвечивания.
На это действие израсходовал еще 0.18 г раствора Na2S2O3. Всего было израсходовано: 2.16 + 0.18 = 2.34 г раствора тиосульфата. По формуле вычисления массовой доли гипохлорита получается: w(NaClO) = mr(Na2S2O3)*w(Na2S2O3)*M(NaClO)/2M(Na2S2O3)*k/mr(NaClO) = 2.34*(1/64)*74.5/(2*158)*25/10.00 = 0.022 = 2.2 % Как видите... И вот что интересно. Инструкции у средств №1 и №2 одинаковы! Конечно, не слово в слово, но все же... Еще бросается в глаза состав, указанный на упаковке! Если поделить на 10 задекларированное содержание гипохлорита натрия во всех трех образцах средства, то получится более-менее истинный состав. Трудно сказать, почему именно с такими фактическими концентрациями продается данный продукт. То ли фирма-посредник разбавляет белизну, то ли технология производства такова, что сразу же получаются разбавленные растворы гипохлорита. В данном случае фальсификация состоит в подаче неверной информации о составе продукта. По имеющимся сведениям производители (возможно, - посредники) разбавляют водой раствор гипохлорита натрия, который продается в виде средства "Белизна". Причин две. Первая - более-менее крепкие растворы гипохлорита неустойчивы и быстро разлагаются при хранении. Вторая причина - жадность: хочется продать воду по цене чистящего средства. Специально пошел в ванную и посмотрел этикетку "Белизны", которая там стояла. Указано, что "концентрация гипохлорита натрия >30%" - как же, как же: оставьте такую "информацию" для себя. Ну не верю я, что раствор такой крепкий. Вообще есть два основных средства фальсификации различных продуктов (пищевых и не только) - вода и соль. - Прим. ред. А теперь - теоретические возражения относительно корректности нашего метода (определения концентрации гипохлорита натрия в "Белизне" по плотности). Гипохлорит натрия ведь может просто разложится при хранении - на хлорид натрия и кислород? А плотности растворов гипохлорита и хлорида натрия отличаются не сильно. - Да, разумеется, это верно. Но основная проблема - не разложение гипохлорита натрия при хранении "Белизны" перед продажей, а то, что ее разбавляют водой. Если, к примеру, предположить, что начальная концентрация гипохлорита была 10 %, то даже после полного разложения на кислород и поваренную соль конечная плотность раствора при 25 °C будет равна 1.055 г/мл, а концентрация поваренной соли составит 8 %. Т.е., ну не может плотность раствора "Белизны" из-за неправильного хранения снизиться от 1.068 г/мл (это плотность 10 % раствора NaClO при 18 °C) до 1.010 г/мл. Для домашнего обывателя это может и не так критично. Зато, например, какова может быть реакция дачника, который пригласил гостей к себе на вечер, и увидел в бассейне цветущую и "благоухающую" воду вместо чистой. Резюмируя, можно сказать следующее: 1) Концентрация действующего вещества сильно отличается от заявленной на этикетке 2) Цена - далеко не показатель качества сего продукта. Образец №3 оказался самым дорогими и самым разбавленным водой 3) Лучше покупать данную продукцию местного (или относительно местного) производителя, хоть это правило и не всегда верно. |
Получение уротропина Hexamethylenetetramine synthesis Юрий Денисов |
|
Уротропин (гексаметилентетрамин) - твердое кристаллическое вещество со специфическим запахом, хорошо растворим в воде (в холодной лучше, чем в горячей). При нагревании возгоняется. Некоторые сравнивают запах уротропина с запахом тухлой рыбы: запах действительно неприятный, но тухлую рыбу не напоминает.
Образуется уротропин при взаимодействии водных растворов аммиака и формальдегида. 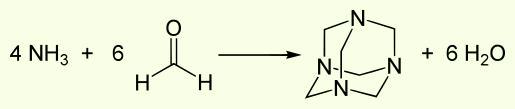
Также уротропин уже более ста лет используется в медицине - главным образом для борьбы с инфекцией в мочевых путях. Патогенные бактерии понижают рН среды (закисление), в результате разложение уротропина с образованием формальдегида происходит именно в очагах воспаления (в щелочной среде уротропин не разлагается). Формальдегид уничтожает бактерии, вызывая денатурацию их белков. В последнее время уротропин и содержащие его препараты исчезли из аптек, поскольку дешевый уротропин пытаются заменить дорогими антибиотиками. Но дело не только в деньгах (которые пытаются вытянуть из пациентов): действие антибиотиков неспецифично и может привести к привыканию к ним бактерий - выживают и развиваются штаммы, устойчивые к данному антибиотику. Дальнейшие попытки лечения дают мало эффекта. К счастью, уротропин все еще продается в ветеринарных аптеках. Еще одно важное применение уротропина - ингибитор коррозии. Разбавленный раствор серной или соляной кислоты с добавкой уротропина разрушает ржавчину, но почти не затрагивает металл. В промышленности уротропин используется для синтеза фенолформальдегидных смол, а также для получения белковых и других пластмасс. Другое применение уротропина - сырье для получения гексогена. В свое время основным взрывчатым веществом в армии был тринитротолуол. Человечество изготовило его столько, словно пыталось взорвать местное скопление галактик. Когда спохватились, многие производства тринитротолуола пришлось закрыть - из-за избытка готового продукта. Но со временем запасы тротила на складах стали заканчиваться - взрывчатки опять стало не хватать. Тогда оказалось, что наладить производство гексогена выгоднее, чем восстанавливать установки по производству тротила. Даже несмотря на то, что гексоген опаснее в обращении и не такой стабильный. В химии уротропин используется для приготовления буферных растворов (уротропиновый буфер), а также как реагент при проведении некоторых реакций. Решил провести синтез уротропина. Нашел такую методику: "Отмерьте с помощью мерной пипетки 1 мл 25 %-ного водного раствора аммиака, перенесите отмеренный объем в стакан и добавьте 1 каплю фенолфталеина. Отмерьте с помощью мерного цилиндра 12 мл формалина (40 %-ного водного раствора формальдегида), прилейте его к полученному в стакане малиновому раствору и тщательно перемешайте реакционную смесь стеклянной палочкой. Если спустя 1-2 мин. раствор в стакане не обесцветился, добавьте с помощью пипетки еще 1-2 мл формалина и вновь перемешайте стеклянной палочкой. Осторожно упарьте содержимое стакана до появления первых кристаллов уротропина (нельзя допускать перегрева, поскольку происходит сильное разбрызгивание реакционной массы). Охладите содержимое стакана до комнатной температуры, добавьте 5 мл этилового спирта, отмеренного с помощью мерного цилиндра. Перемешайте содержимое стакана стеклянной палочкой, тщательно смывая остатки уротропина со стенок. Полученный раствор аккуратно перелейте в фарфоровую чашку и упарьте на водяной бане досуха. Охладите чашку с полученными кристаллами уротропина до комнатной температуры. Полученный уротропин аккуратно перенесите (с помощью выданного Вам шпателя) на предварительно взвешенную кальку и определите массу (запишите ее!) полученного уротропина." Проблема в том, что у меня не было фенолфталеина. По-видимому, вместо него подойдет любой другой кислотно-основный индикатор - с такой областью перехода, чтобы можно было определить, что среда уже не сильнощелочная. Например, полоски универсальной индикаторной бумаги. 25% аммиака также не было, пришлось вместо него использовать 10% аптечный раствор. Итак, описание эксперимента по синтезу уротропина: сначала я подготовил и сфотографировал все необходимые реагенты и вспомогательные материалы: |

|

|

|

|
|
Далее к двум с половиной миллилитрам 10% раствора аммиака прилил 12 миллилитров формалина, размешал смесь, подождал 2 минуты, проверил индикаторной бумажкой - среда щелочная. Прибавил еще ~ 2 мл формалина, подождал немного и проверил среду - среда была нейтральной. Именно в этот раз я уронил индикаторную бумагу в раствор - в результате и раствор, и синтезированный уротропин стали зелеными. Поставил выпариваться.
Неожиданно я понял, что что-то не так, а " не так" было с концентрацией формальдегида в воздухе - побежал открывать окна, но это уже не помогло - в горле першило, глаза слезились - сцена получилась сентиментальной. Побежал в ванну захватив при этом очки и противогаз (РПГ-67 - респиратор противогазного типа с двумя фильтрами класса А1). Там я умылся, прополоскал горло и одел противогаз. Уже в таком виде продолжил эксперимент: |

|
|
Вывод: синтез нужно проводить под тягой или на открытом воздухе.
Раствор выкипал и наконец показались "первые кристаллы уротропина". Выключил плитку и поставил смесь остывать. Когда содержимое стакана остыло, прилил 5 мл спирта и помешал палочкой - твердое вещество растворялось плохо, поэтому прибавил еще пару мл спирта. Уротропин растворился, я перелил зеленую жижу в фарфоровую чашку и упарил на водяной бане. После испарения жидкой фазы отделил прилипший уротропин от чашки и взвесил: |

|

|

|

|

|

|

|

|

|

|
|
В результате было получено 0.34 г зеленого уротропина (как уже было сказано, такой цвет из-за того, что я уронил в раствор индикаторную бумажку). Продукт хоть и грязный, но это уротропин (его запах после приготовления аммотропина я ни с чем не спутаю).
По сравнению с "получением" уротропина из пачки "Сухого горючего" описанный способ затратный и не совсем полезен для здоровья (одновременно вы получаете "терапию" формальдегидом и просто "плачете" от радости), но всегда интересно синтезировать вещество самому, а не использовать готовый продукт. |
|
Комментарии
К1
В странах бСССР, в частности в России, гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76. Существуют две рецептуры: марка А с содержанием активного хлора не менее 190 г/л (около 26% NaClO) и марка Б, содержащая не менее 170 г/л активного хлора (примерно 22% NaClO), но вдвое-втрое больше щелочи, чем марка А. Но в продажу населению такие растворы никогда не поступали. Их использовали в промышленности либо там, где нет возможности возить лишний балласт, в частности, для чистки и дезинфекции на речных и морских судах. Действующие стандарты для бытовых отбеливателей намного менее жесткие. Для примера, российский ГОСТ Р 51696-2000 устанавливает только максимальное содержание активного хлора в отбеливателе - 200 г/л. Вроде бы неплохо, но о минимальном содержании в документе нет ни слова. Это полностью отдано на откуп производителю, который имеет право сам устанавливать технические условия на свою продукцию. И уж он постарается, будьте уверены. Вот, например, сравнительно честный российский производитель - компания БашБытПром из города Стерлитамак: http://bbprom.ru/katalog/belizna.html. Средство "Белизна" выпускается в соответствии с техническими условиями ТУ 2382-106-70864601-2007 по двум рецептурам: с содержанием активного хлора 7% и 4%. Но в принципе, производителю ничто не мешает установить технические условия на какую-нибудь "Белизну-Ultra с запахом лимона", где будет присутствовать отдушка, а содержание гипохлорита будет снижено для ослабления неприятного запаха. Тем более и пример имеется буквально рядом - в Стерлитамаке находится производство содовых "инноваторов". В случае, описанном в статье, все еще печальнее. Образцы №1 и №3 откровенно разбавлены водой. И скорее всего обычной водопроводной, ибо так дешевле всего. Авторы сего чуда разбавили не только гипохлорит, но также и его стабилизаторы: щелочь и комплексообразующие добавки, связывающие ионы переходных металлов. И дополнительно загрязнили раствор этими ионами. Так что ни о каком гарантированном хранении такой продукции не может быть и речи. В принципе, отбеливатель с содержанием гипохлорита 0.8%, как и с надписью "содержание активного хлора 30%" есть 100% повод для вмешательства надзорного ведомства. Но видимо инновации оказались важнее...
К1-1 Как-то нашел еще один продукт фирмы ООО "Бытовая химия" - "отбеливатель древесины". У него плотность оказалась равной 1.114 г/мл, а цена была не сильно накрученной, всего в 3 раза. Не совсем понятно, каким образом из 190 г/л было получено число 26 %. Мой случай был такой: 193 г/л (паспортные данные), 1.270 г/мл (а это уже сам намерял при 18 °C). Расчет получился такой: w(NaClO) = C(Cl2)/M(Cl2)*M(NaClO)/(1000*r) = 193/71*74.5/1270 = 0.159 = 15.9 %. К1-1-1 Да, 26% NaClO - это несомненная опечатка, попавшая из другого текста без дополнительной проверки. Хотя цифра изначально выглядела завышенной. На самом деле содержание гипохлорита натрия в растворах гипохлорита марки А и Б составляет примерно 16 и 14.5 процентов. Это подтверждается расчетом и соответствует данным технологического регламента по очистке воды от загрязнителей. К тому же получение раствора с концентрацией гипохлорита натрия 25% и выше значительно сложнее технологически. К2 (По синтезу уротропина) Для изучения характера протекания реакции при смешивании концентрированных растворов был добавлен теплый 54 % раствор формальдегида к 25 % раствору аммиака. Произошел выброс большей части смеси. Наверно, раствор аммиака следовало бы охладить как можно сильнее, например, до -25 °C. P.S. Вышеуказанный концентрированный раствор формальдегида при комнатной температуре не существует. |
|
К3
Error: (NaClO) = 2.2 %,
Comment: https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%BF%D0%BE%D1%85%D0%BB%D0%BE%D1%80%D0%B8%D1%82_%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F концентрация выше 4% у вас ошибка в 2 раза во всех результатах? К3-1 Перед тем, как указывать на ошибку, всегда полезно дочитать текст до конца. В частности ту его часть, где отмечено, что при хранении раствор гипохлорита натрия разлагается с образованием кислорода и хлорида натрия. Последний остается в растворе, повышая его плотность, однако, окислительными свойствами не обладает (не содержит активного хлора, который определяется титрованием). Это - не учитывая, что препарат мог изначально содержать разные добавки, влияющие на плотность. |