Chemistry and Chemists № 2 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 2 2025 Journal of Chemists-Enthusiasts |
Experiments with Thermite - pt.1, 2 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Combustion of Thermite: Copper(II) Oxide/Aluminum (Part 1)
I have been conducting chemical experiments since I was 12. Over the years, I have performed a variety of experiments, ranging from simple to complex, and from safe to extremely risky - some so dangerous that survival was not guaranteed.
Эксперименты с термитом Горение термита оксид меди(II)/алюминий (часть 1) Most people develop an interest in science and experiments during childhood, but as they grow older, this curiosity often fades. In my case, my passion has remained strong. In fact, many of the classic experiments that chemistry enthusiasts typically conduct in childhood, I first performed after turning thirty. For example, I synthesized nitrogen iodide when I was already a scientist. The same was true for the glow of luminol, the "mercury heart" experiment (a pulsating drop of mercury), singlet oxygen, and ammonium nitrate explosions. At 35, I made several unsuccessful attempts to obtain nitrogen chloride. I had planned to try again, but I still haven't gotten around to it. Now, at 48, there are still many well-known chemistry experiments I have never performed or even seen in person. One item on my "bucket list" is thermite combustion. Classic thermite consists of a mixture of aluminum powder and iron oxides (FeO, Fe3O4, and/or Fe2O3). However, many other thermite compositions exist. Thermite is notable for its extremely high combustion temperature. In the reaction between aluminum metal and iron oxides, molten iron forms and flows through a hole in the bottom of a clay pot. You read that correctly: thermite combustion demonstrations are often conducted in unglazed clay pots, making this one of the most visually spectacular chemistry experiments.  Of course, thermite is not just a chemistry demonstration. It is used industrially for metal production, welding, and in various military applications, such as incendiary compositions. I had originally planned to experiment with thermite back in school, but I never got around to it. At that time, the only available aluminum powder was aluminum pigment. However, a book on inorganic synthesis mentioned that such aluminum might not be suitable for thermite, as it contains aluminum oxide. Another book stated that the aluminum particles should not be too fine (as they are in aluminum pigment), or else the thermite reaction would burn too vigorously. Since I was conducting my chemistry experiments in the bathroom at the time, the risk of setting my apartment on fire was not particularly appealing. The question remained: how to ignite thermite? Sources recommended magnesium ribbon, a gas burner, or an incendiary mixture containing barium peroxide. However, I had none of these materials during my school years. Interestingly, I recently found a video in which a thermite mixture did not ignite despite being exposed to the flame of a powerful gas burner, even though its surface reached 800°C. This demonstration was meant to highlight the safety of commercially manufactured thermite mixtures. As an adult, I finally had access to everything I needed to experiment with thermite - except for time. When I was younger, it was the opposite: I had plenty of free time and enthusiasm but lacked the necessary reagents, materials, and equipment. I also lacked knowledge and colleagues who could provide guidance. Now, I have all of that, but time and energy are in short supply. When I finally decided to experiment with thermite, I chose to start with a CuO/Al composition, as it ignites more easily and burns more vigorously than FexOy/Al thermite. To minimize fire hazards, I initially worked with only small amounts of reactants. Beyond scientific curiosity, I also had a practical goal. During aluminum wire production, waste material is generated, consisting of aluminum particles mixed with a special liquid used for lubrication and cooling during metal processing. These liquids are used not only in aluminum wire manufacturing but in metalworking in general. I hypothesized that this aluminum waste could be used to produce thermite (Al/FexOy). If successful, it could serve as a substitute for high-quality aluminum powder in thermite compositions. Before testing thermite made from aluminum waste, I needed a baseline composition for comparison, so I planned to prepare thermite using commercially available aluminum powder and iron oxide. However, before even working with aluminum/iron oxide thermite, I decided to start with a thermite composition that ignites more easily - hence, my choice of copper(II) oxide/aluminum thermite. For my first experiment, I used 1 g of fine aluminum powder and calculated the required amount of CuO based on the reaction: 3CuO + 2Al = 3Cu + Al2O3
1·79.54·3/(2·26.98) = 4.42 g Thus, for 1 g of aluminum, 4.42 g of copper(II) oxide is required. Experiment Winter was cold, and since the laboratory was unheated, I put my experiments on hold. By mid-March, the temperature in the lab had risen to 10°C, making the working conditions relatively comfortable. I took out jars of copper(II) oxide and aluminum powder. Expecting to find black powder inside the jar of copper oxide, I was surprised to see spherical granules instead. However, I didn't think this would be a problem. I weighed the required amounts of copper oxide and aluminum, then placed the copper oxide granules in an agate mortar and attempted to crush them. The granules turned out to be extremely hard and durable - apparently, this batch of copper oxide was designed for "chemists who do bodybuilding." Afraid of damaging the agate mortar, I transferred the copper oxide to an iron mortar. Unfortunately, grinding it in the iron mortar was just as difficult. Some particles had to be placed on an anvil and smashed with a hammer. Once I had finally crushed the copper oxide, I mixed it with aluminum powder and placed the mixture in a small aluminum foil dish. Then, I directed the flame of a gas burner at it. The mixture ignited easily, producing a bright white flash. Large sparks flew in all directions, and I immediately regretted positioning my smartphone too close to the reaction - any of the hot particles could have seriously damaged it. There was another reason the smartphone should have been placed much farther away: the intense flash completely blinded the camera. In the recorded video, the flash appeared as a solid white screen - like a photograph of a blank sheet of paper. After this, I moved on to experiments with Al/Fe3O4 thermite. These experiments were mostly successful and will be described in later parts of the article. For now, I will only note that the combustion of Al/Fe3O4 thermite never blinded the camera, even when I used much larger quantities of reactants. Midway through this series of experiments, I decided to re-record the combustion of 1 g of aluminum with 4.42 g of copper(II) oxide, this time placing my smartphone at a much greater distance. However, despite the increased distance, the flash once again blinded the camera. The only difference was that this time, there was no scattering of large particles - since I had crushed the copper oxide much more thoroughly. |
|
Эксперименты с термитом
Химическими экспериментами я занимаюсь с 12 лет. За это время провел много разных химических экспериментов: от простых до сложных, от безопасных до очень рискованных (экспериментов, которые можно было и не пережить).
Горение термита: оксид меди(II)/алюминий (часть 1) Обычно люди интересуются наукой и экспериментами в детском возрасте, а по мере взросления этот интерес часто угасает. В моем случае интерес сохранился. Более того, много экспериментов, которые энтузиасты проводят в детском возрасте, я впервые осуществил после тридцати лет. Например, йодистый азот синтезировал уже, будучи научным сотрудником. Аналогично было со свечением люминола, экспериментом "ртутное сердце" (пульсирующая капля ртути), синглетным кислородом и взрывами аммиачной селитры. Хлористый азот я несколько раз пытался получить в 35 лет - неудачно. Планировал повторить попытку, но до сих пор не дошли руки. Сейчас мне 48 лет, однако, осталось много популярных химических экспериментов, которые я никогда не делал сам и не видел в исполнении других. Одним из пунктов в моем "bucket list" [1] является горение термита. Классический термит представляет собой смесь порошка алюминия с оксидами железа (FeO, Fe3O4 и/или Fe2O3). Существует также много других вариантов составов термитов. Особенностью термитов является высокая температура горения. Железо, которое образуется в реакции алюминия с оксидами железа, плавится, стекая вниз через отверстие в дне глиняного горшка. Вы не ошиблись: демонстрацию горения термита часто проводят в неглазурированном глиняном горшке, что делает этот эксперимент одним из самых эффектных.  Разумеется, термит используется не только как "учебное пособие" для студентов. Горения термитов применяют для получения металлов, сварки, а также в военном деле (зажигательные составы). Я планировал приготовить термит еще, будучи в школе, но до сих пор так и не сделал. Тогда единственной доступной формой алюминиевого порошка была алюминиевая пудра (aluminum powder), которая продается в качестве пигмента. Однако в книге по неорганическому синтезу отмечалось, что такой алюминий может не подойти для термита, поскольку он содержит оксид алюминия. В другой книге было сказано, что частицы алюминия не должны быть слишком мелкими (как в упомянутом алюминиевом пигменте), иначе горение термита будет происходить слишком активно. Учитывая, что я тогда проводил химические эксперименты в ванной комнате, перспектива сжечь квартиру меня не радовала. Оставался неясным вопрос, как поджечь термит? Чтобы инициировать горение термита FexOy/Al рекомендовали использовать магниевую ленту, газовую горелку или зажигательную смесь, содержащую перекись бария. Ничего из причисленного у меня в школьные годы не было. Кстати, недавно я нашел видеоролик, в котором термит НЕ загорелся от пламени мощной газовой горелки, хотя его поверхность нагрелась до 800°С. Таким способом производители термитных смесей демонстрировали безопасность их продукции. Во взрослом возрасте все необходимое для экспериментов с термитом у меня было, не хватало только времени. В детстве было все наоборот: много свободного времени, очень много энтузиазма, зато не хватало реактивов, материалов и оборудования. Также не хватало знаний и коллег, которые могли бы посоветовать. Сейчас многое из этого есть, но времени не хватает, да и силы уже не те. Когда я, наконец, занялся термитом, сначала решил приготовить состав CuO/Al, который легче загорается и горит активнее, чем термит FexOy/Al. Чтобы избежать проблем с пожарной безопасностью, для начала ограничился минимальными количествами веществ. Кроме научного интереса у меня была и чисто практическая задача. При производстве алюминиевой проволоки образуются отходы, которые представляют собой частицы алюминия в смеси со специальной жидкостью, которая добавляется для смазки и охлаждения во время механической обработки металлов (не только в процессе изготовления алюминиевой проволоки). Я предположил, что из этих отходов алюминия можно изготовить термит (алюминий/оксид железа). В случае успеха отходы могли бы заменить продажный алюминиевый порошок в термитных смесях. Перед тем как приступить к изготовлению термита из отходов алюминия, необходимо было провести эксперимент сравнения. Для этого было нужно приготовить термит из продажного порошка алюминия и оксида железа. В свою очередь перед экспериментами с термитами алюминий/оксид железа я решил приготовить термит, который легче загорается, чем состав FexOy/Al. Как вы уже знаете, был выбран термит: оксид меди/алюминий. Решил использовать 1 г алюминия в виде мелкого порошка. Провел расчет. 3CuO + 2Al = 3Cu + Al2O3
1·79.54·3/(2·26.98) = 4.42 g На 1 г алюминия необходимо использовать 4.42 г оксида меди (II). Эксперимент Зимой было холодно: лаборатория не отапливалась, поэтому я не занимался экспериментами. В средине марта в лаборатории потеплело до 10°С, в результате условия работы стали относительно комфортными. Взял баночки с оксидом меди (II) и алюминиевым порошком. Открыл баночку с оксидом меди, ожидая увидеть внутри черный порошок. Однако внутри оказались сферические гранулы - я не видел в этом проблемы. Взвесил оксид меди и алюминий. Поместил гранулы оксида меди в агатовую ступку и попытался их измельчить. Гранулы оказались твердыми и исключительно прочными, вероятно этот оксид меди был предназначен для "химиков, которые занимаются бодибилдингом". Боясь повредить агатовую ступку, перенес оксид меди в железную ступку. Измельчать оксид меди в железной ступке тоже оказалось непросто. Некоторые частицы пришлось перенести на наковальню и разбить молотком. Смешал вещества, поместил смесь оксида меди с алюминием в тарелочку из алюминиевой фольги, направил на нее пламя газовой горелки. Смесь легко инициировалась пламенем. Произошла яркая белая вспышка. Полетели крупные искры, и я пожалел, что закрепил смартфон слишком близко к смеси: любая из раскаленных частиц могла сильно его повредить. Была и вторая причина, почему смартфон следовало бы поместить на значительно большем расстоянии. Вспышка ослепила камеру - на видео вспышка выглядела как сплошное белое свечение (полностью белые кадры, словно фотография листа бумаги). Дальше я перешел к экспериментам с термитом Al/Fe3O4. Они прошли преимущественно успешно, и будут описаны в следующих частях статьи. Сейчас скажу только, что горение термита Al/Fe3O4 никогда не ослепляло камеру, хотя и я использовал намного большие количества веществ. Посреди данной серии экспериментов я решил повторно снять видео горения смеси 1 г алюминия с 4.42 г оксида меди (II), установив смартфон значительно дальше. Несмотря на расстояние, вспышка опять ослепила камеру. Зато разброса крупных частиц в этот раз не произошло, поскольку я более тщательно измельчил оксид меди. __________________________________________________ 1 Bucket list - список вещей, которые человек планирует сделать перед смертью. |

Combustion of Thermite: Copper(II) Oxide/Aluminum |

|

|

|

|

1 g of Al (Al + the paper = 1.69 g) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Combustion of Thermite: Iron(II, III) Oxide/Aluminum (Fe3O4/Al) - Part 2
For the control experiment, I used a mixture of fine aluminum powder and iron(II, III) oxide, Fe3O4 (black iron oxide pigment). What should the ratio of these substances be? I could have calculated the thermite composition based on the combustion reaction equation or consulted reference books:
Горение термита: оксид железа (II, III)/алюминий (Al/Fe3O4) - часть 2 3Fe3O4 + 8Al = 4Al2O3 + 9Fe Instead, I looked up the composition on one of my favorite chemistry websites [2], which recommends an 8:3 weight ratio of Fe2O3 to Al. I decided to apply a similar approach for Fe3O4 and calculated that I needed 1 g of Al and 2.67 g of Fe3O4. After weighing the substances, I mixed them thoroughly on a sheet of paper. I then placed the mixture into a tube made by twisting aluminum foil and set it on iron sheets. To protect the camera, I positioned a plexiglass sheet in front of the smartphone. While this distorted the video, I prioritized safety: I had never observed the combustion of this particular thermite composition before and expected hot particles to scatter, despite the small amount of mixture. It was also uncertain how easily the thermite would ignite. I directed the flame of a gas burner at the thermite. To my surprise, the mixture ignited immediately upon contact with the flame. A yellow flash occurred, accompanied by yellow sparks that did not travel far. The aluminum foil disappeared, and after combustion, solidified droplets of elemental iron remained. For the second experiment, I doubled the amount of reactants. This time, I mixed the components grounding them in an iron mortar. A colleague suggested placing the thermite mixture in a glazed porcelain crucible. Again, I directed the flame of a gas burner at the thermite. A yellow flash appeared with sparks. Almost immediately, the upper part of the crucible shattered into large fragments that flew in all directions. The lower part survived the combustion... but not for long. Molten iron accumulated at the bottom of the crucible, and once the reaction was complete, the bottom shattered as well, scattering large droplets of iron. A burnt plastic odor filled the room - hot particles had landed on the linoleum. I was fortunate that none of the large iron drops hit me; such drops can cause severe burns. My colleague was even luckier - he wasn't in the lab at the time. The video clearly shows that large iron drops flew precisely where he usually stands... Afterward, I gathered crucible fragments, porous iron balls, and iron powder from around the lab. Although the experiments didn't go entirely smoothly, the initial results can be considered a success. __________________________________________________ 2 https://www.sciencemadness.org/smwiki/index.php/Thermite |
|
Горение термита: оксид железа (II, III)/алюминий (Al/Fe3O4) - часть 2
Для контрольного эксперимента я использовал смесь мелкого порошка алюминия с оксидом железа(II, III), Fe3O4 (черный пигмент). Какое должно быть соотношение веществ? Можно было провести расчет состава термита, исходя из уравнения реакции его горения, или обратиться к справочникам.
3Fe3O4 + 8Al = 4Al2O3 + 9Fe Вместо этого я посмотрел один из любимых химических сайтов [2], там рекомендуют использовать: "8:3 ratio Fe2O3 to Al by weight". Решил использовать аналогичное соотношение и в случае оксида Fe3O4. Таким образом, необходимо: 1 г Al и 2.67 г Fe3O4. Взвесил вещества, тщательно смешал их на листе бумаги. Поместил смесь в трубку, скрученную из алюминиевой фольги. Трубку поместил на листы железа. Камеру защитил, установив перед смарфоном лист оргстекла. Защитный экран искажает видео, но решил перестраховаться: я никогда раньше не видел горение такого состава термита и ожидал разброса горячих частиц, несмотря на минимальное количество смеси. Было также неизвестно, насколько легко термит загорится. Направил на термит пламя газовой горелки. К моему удивлению, от контакта с пламенем смесь загорелась сразу. Произошла желтая вспышка с желтыми искрами, которые разлетелись недалеко. Алюминиевая фольга исчезла, после сгорания смеси образовались застывшие капли элементарного железа. Для второго эксперимента увеличил вдвое количества веществ. В этот раз смешал компоненты, растирая их в железной ступке. Коллега порекомендовал поместить термитную смесь в глазурованный фарфоровый тигель. Направил пламя газовой горелки на термит. Произошла желтая вспышка с искрами. Верхняя часть тигля почти сразу разлетелась на крупные осколки, которые полетели во все стороны. Нижняя часть уцелела и пережила горение термита... но ненадолго. На дне тигля собралось расплавленное железо. Уже после сгорания термита низ тигля разлетелся, разбрасывая крупные капли железа во все стороны. Запахло горелым пластиком - раскаленные частицы попали на линолеум. Повезло, что ни одна из крупных капель железа не попала в меня - такие капли вызывают серьезные ожоги. Моему коллеге повезло еще больше: его не было в лаборатории во время эксперимента. Зато на видео четко видно, что крупные капли железа полетели точно в то место, где он обычно стоит... Осколки тигля, шарики пористого железа и порошок железа я собирал по всей лаборатории. Эксперименты не прошли гладко, но начало можно считать успешным. |

Combustion of Thermite: Iron(II, III) Oxide/Aluminum (Fe3O4/Al) |

|

|

|

|

|

|

|

|

|

|
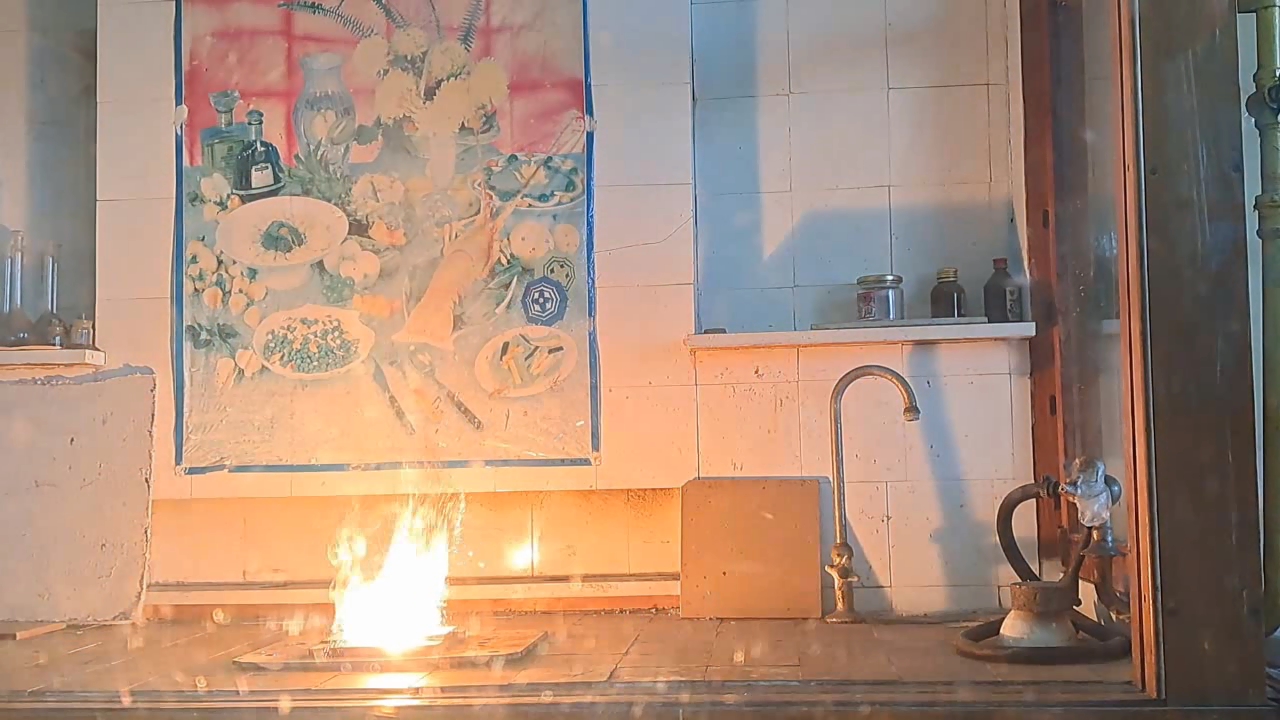
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|

|
|
|
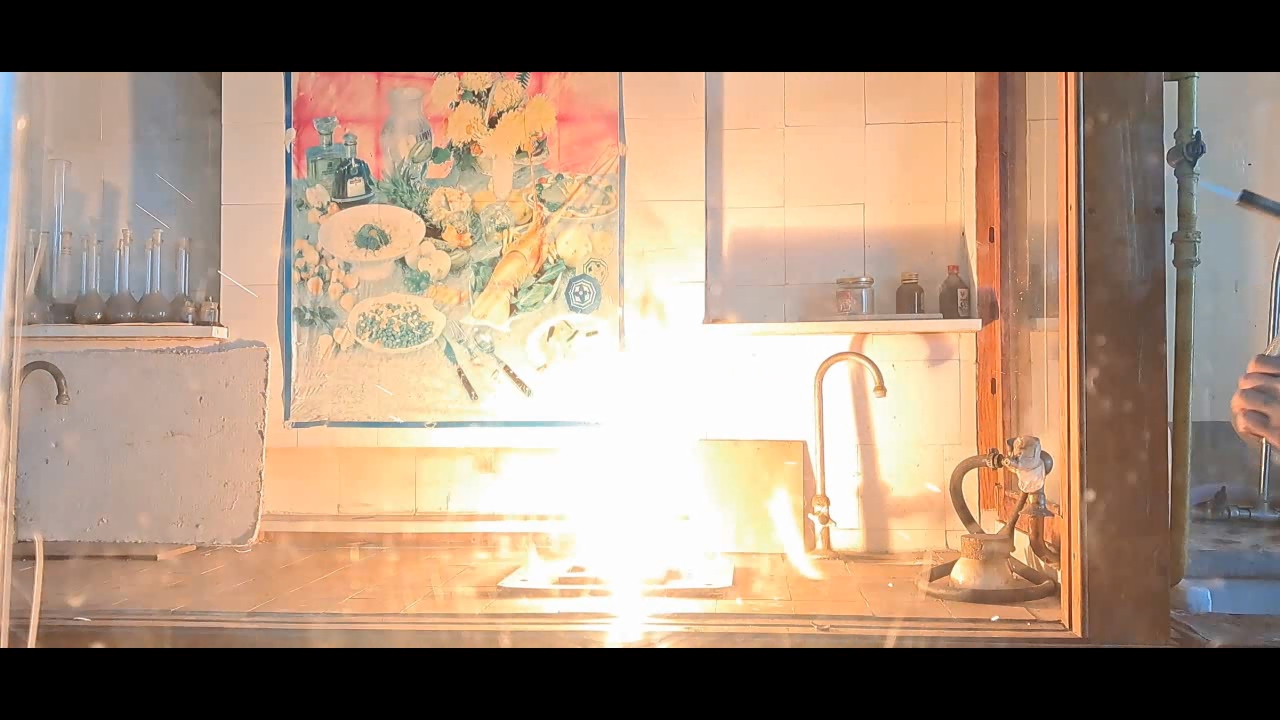
|

|

|

|
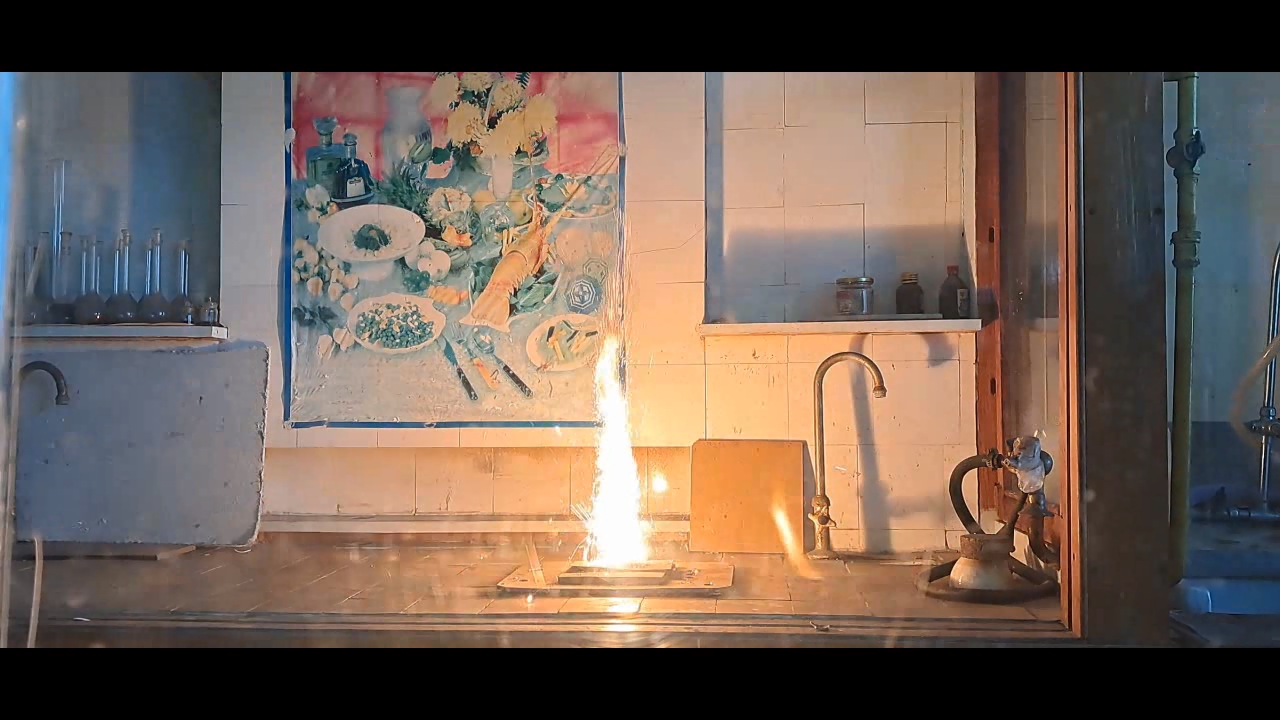
|
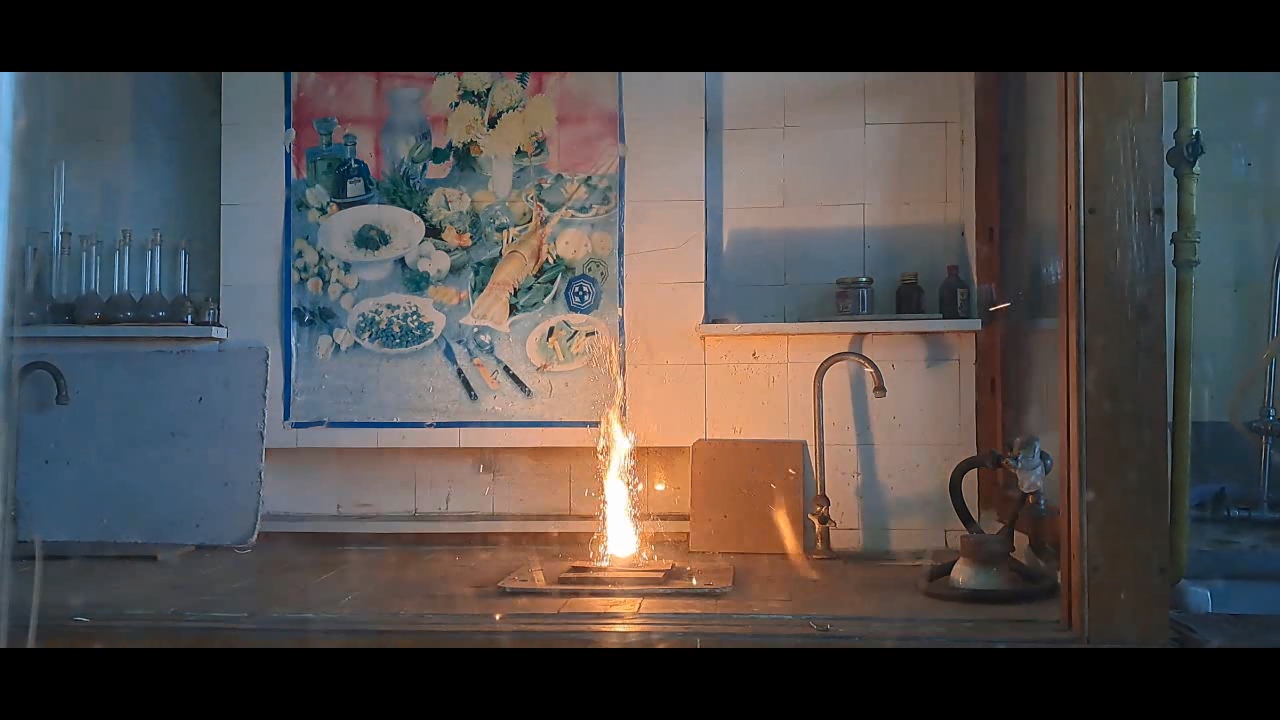
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|