Chemistry and Chemists № 2 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 2 2025 Journal of Chemists-Enthusiasts |
Experiments with Thermite - pt.26, 27 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
''Molded Thermite'': Iron (II, III) Oxide, Calcium Sulfate, Aluminum, and Water (Fe3O4/CaSO4/Al/H2O) - Part 26
Parts 22 and 23 of this article describe the combustion of a thermite mixture consisting of aluminum and anhydrous calcium sulfate. The anhydrous salt was obtained by heating the hemihydrate CaSO4·0.5H2O, which is sold in our country under the name "alabaster." Commenting on the experiment, one forum member noted:
''Литой термит'': оксид железа (II, III), сульфат кальция, алюминий и вода (Fe3O4/CaSO4/Al/Н2О) - часть 26 "Calcinating alabaster (CaSO4·0.5H2O) is unnecessary here. I once made a similar thermite using magnesium and a small amount of sodium nitrate. In the book where I found the recipe, it was described as a German ersatz (incendiary or illuminating composition), which was poured into ammunition after being mixed with water. Calcium sulfate served not only as an oxidizer but also as a binder." I disagreed, as magnesium is much more reactive than aluminum. Specifically, magnesium burns in water vapor, while aluminum does not. Moreover, a mixture of magnesium powder and liquid water can detonate in a closed container. Magnesium can also react violently with crystalline hydrates of certain inorganic salts when heated. I recall that, in my childhood, I prepared a mixture of copper sulfate pentahydrate (CuSO4·5H2O) and magnesium powder—it flared up brightly when ignited with a flame. I never attempted a similar experiment with aluminum, as I was certain the mixture would not ignite. The forum member then cited a recipe from A.V. Chuvurin's book 'Entertaining Pyrotechnics' (2003) [1]. I will quote it in full: "It is easy to press a casting of any shape from this thermite composition—you just need to add a little water. It is called ''mold thermite''. It differs from regular "ferro-thermite" by the addition of dehydrated gypsum. To prepare it, mix 3 parts by weight of iron oxide, 1 part of aluminum powder, 1 part of aluminum pigment powder, and 2 parts of gypsum. The composition is moistened with water, the plastic mass is loaded into a mold, and dried for at least a week in a warm place." Thus, in the classic Fe3O4/Al thermite composition, part of the iron oxide is replaced by anhydrous calcium sulfate. Aluminum is used in two forms: coarse aluminum powder and aluminum pigment powder (also known as "silver paint"—fine, flaky aluminum particles used in paints). The water added to the solid mixture for plasticization is partially removed during drying. However, some of it is absorbed by the calcium sulfate, converting it into the dihydrate form (CaSO4·2H2O), and remains in the hardened mass. Because of this, I was uncertain whether the mixture would ignite. I had aluminum pigment powder left over from my school days—almost 40 years ago. Back then, I actively used it for chemical experiments, as it was one of the few accessible chemical reagents. I used exactly this aluminum pigment powder in the experiment. The photos on the right also show aluminum pigment powder purchased much later, but I did not use that in this experiment. Also, there was a jar with a mixture of aluminum and magnesium powders available. I decided not to use it at the last moment, since the composition of the mixture was unknown. Instead of anhydrous calcium sulfate, I used the hemihydrate form (alabaster). I weighed out 15 g of iron (II, III) oxide, 5 g of aluminum powder (100-140 microns), 5 g of aluminum pigment powder, and 10 g of calcium sulfate. I mixed the substances thoroughly. During mixing, it became clear that the aluminum pigment consisted of much finer particles than the aluminum powder. The pigment dusted easily, adhered to surfaces, and coated the other components, giving the entire mixture a silvery appearance. I poured the mixture into a plastic cup and gradually added water, stirring vigorously. A plastic mass formed, from which I molded an irregularly shaped sphere. I made a deep cavity at the top to hold the ignition composition. It was possible to shape the thermite more aesthetically, but I wasn't inspired to make sculptures. I left the thermite to dry for four days, simply placing the sphere on the table and attending to other tasks. After four days, the mass had dried and proved to be quite fragile. I conducted the thermite combustion outdoors. I placed the sphere in a tray filled with sand. I added an ignition composition of 1 g of fine aluminum and 2.75 g of iron oxide (Fe3O4) into the cavity. I then applied the flame from a gas burner to the ignition mixture. There was a bright flash. A vivid yellow flame appeared, scattering numerous sparks and releasing smoke. The combustion lasted about 7 seconds. A molten mass formed, glowing yellow and cooling quickly. Upon inspection, I found two large solidified drops and many smaller ones. After previous experiments with Al/CaSO4 thermite, the sand emitted hydrogen sulfide for a long time, polluting the air in the lab. This time, I replaced the sand in the tray completely with fresh sand to avoid the same issue. __________________________________________________ 1 Чувурин А.В. - Занимательная пиротехника (2003) [link]. |
|
''Литой термит'': оксид железа (II, III), сульфат кальция, алюминий и вода (Fe3O4/CaSO4/Al/Н2О) - часть 26
В 22-й и 23-й частях статьи описано горение термита, состоящего из алюминия и безводного сульфата кальция. Безводная соль была получена нагреванием полугидрата CaSO4·0.5H2O, который продается у нас под названием "алебастр". Комментируя эксперимент, один из участников форума отметил:
"Прокаливание алебастра (CaSO4·0.5H2O) здесь лишнее. Я когда-то делал подобный термит, но с магнием и небольшой добавкой нитрата натрия. В описании состава в книге, из которой я взял рецепт, было отмечено, что это немецкий эрзац (зажигательный или осветительный состав), который заливался в боеприпасы в замешанном с водой состоянии. Сульфат кальция играл роль не только окислителя, но и связывающего". Я не согласился, поскольку магний значительно активнее алюминия. В частности, магний горит в парах воды, алюминий - нет. Более того, смесь порошка магния и жидкой воды способна детонировать в закрытых сосудах. Магний также способен бурно взаимодействовать с кристаллогидратами некоторых неорганических солей при нагревании. Помню, как в детстве приготовил смесь пентагидрата сульфата меди (CuSO4·5Н2О) и порошка магния - смесь ярко вспыхнула при действии пламени. С алюминием я проводить такой эксперимент даже не пытался (поскольку был уверен, что смесь не загорится). Тогда участник форума выложил рецепт из книги Чувурин А.В. - Занимательная пиротехника (2003) [1]. Приведу полную цитату. "А этим термитным составом несложно запрессовать форму любой конфигурации, достаточно лишь прилить к нему немного воды. Его так и называют "литой термит". От обычных ферротермитных смесей он отличается добавкой обезвоженного гипса. Для его приготовления смешивают 3 весовые части оксида железа, 1 часть алюминиевого порошка, 1 часть алюминиевой пудры и 2 части гипса. Состав смачивают водой, пластичную массу загружают в форму и сушат не меньше недели в теплом месте." Таким образом, в классической рецептуре термита Fe3O4/Al часть оксида железа заменена безводным сульфатом кальция. Алюминий используется двух видов: алюминиевый порошок и алюминиевая пудра ("серебрянка" - алюминиевая краска, состоящая из мелких чешуек алюминия). Вода, добавляемая к твердой смеси для ее пластификации, частично удаляется при сушке. Однако, часть воды переходит в состав дигидрата сульфата кальция (CaSO4·2H2O), следовательно, она остается после застывания и высыхания смеси. Учитывая последний факт, я был неуверен, что смесь загорится. Алюминиевая пудра осталась у меня еще со школы (с тех пор прошло почти 40 лет). Тогда я активно использовал алюминиевую пудру для проведения химических экспериментов, поскольку она была одним из немногих доступных химических реагентов. Именно эту алюминиевую пудру я применил для данного эксперимента. На фотографиях справа также показана алюминиевая пудра, купленная намного позже, но в данном эксперименте я ее не использовал. Также была в наличии банка со смесью порошков алюминия и магния, я передумал ее использовать в последний момент, поскольку состав смеси был неизвестен. Вместо безводного сульфата кальция взял полугидрат (алебастр). Взвесил 15 г оксида железа (II, III), 5 г алюминиевого порошка (100-140 микрон), 5 г алюминиевой пудры и 10 г сульфата кальция. Тщательно смешал вещества. Во время перемешивания стало наглядно видно, что алюминиевая пудра состоит из гораздо более мелких частиц, чем алюминиевый порошок. Алюминиевая пудра пылила, прилипала к поверхностям и покрывала частицы других компонентов, окрашивая смесь в серебристый цвет. Пересыпал смесь в пластиковый стакан, добавлял небольшими порциями воду, активно перемешивая содержимое. В результате образовалась пластическая масса, из которой я слепил неправильной формы сферу. Сверху сферы проделал глубокую полость для зажигательной смеси. Можно было предать термиту более эстетичную форму, но у меня не было вдохновения заниматься изготовлением скульптур. Оставил термит сушиться на четыре дня. Просто положил сферу на стол и занялся другими делами. Через четыре дня масса была сухой, она оказалась достаточно хрупкой. Горение термита провел на открытом воздухе. Поместил термит в лоток с песком. В полость сферы насыпал зажигательный состав из 1 г мелкодисперсного алюминия и 2.75 г оксида железа Fe3O4. Направил пламя горелки на зажигательный состав. Произошла яркая вспышка. Образовалось яркое желтое пламя, которое разбрасывало многочисленные искры и выделяло дым. Горение продолжалось примерно 7 секунд. Образовалась расплавленная масса, которая светилась желтым цветом и быстро остывала. Подойдя ближе, я обнаружил две крупные застывшие капли и множество мелких. После прошлых экспериментов с термитом Al/CaSO4 песок длительное время выделял сероводород, отравляя воздух в лаборатории. Следовательно, в этот раз я полностью заменил песок в лотке на новый, чтобы избежать аналогичной проблемы. |

''Molded Thermite'': Iron (II, III) Oxide, Calcium Sulfate, Aluminum, and Water (Fe3O4/CaSO4/Al/H2O) |

|

On the left is aluminum pigment powder left over from my school days—almost 40 years ago |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
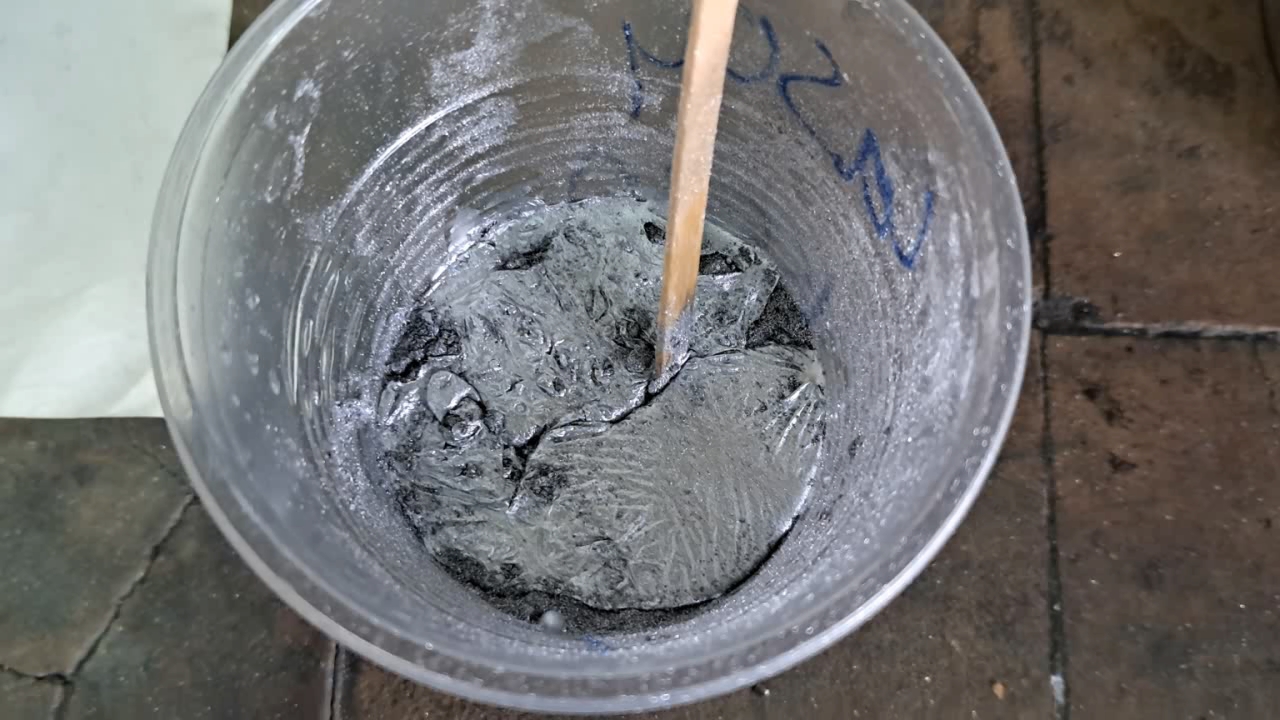
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Combustion of Thermite: Iron(II, III) Oxide/Aluminum/Magnesium (Fe3O4/Al/Mg) - Part 27
At work, I was loaded with… work. What a shame!
Горение термита: оксид железа (II, III)/алюминий/магний (Fe3O4/Al/Mg) - часть 27 The time I could allocate for thermite experiments was significantly reduced—just when I had many interesting plans in mind. In particular, I was preparing to experiment with mixtures using oxidizers other than iron oxide. A colleague brought me a jar of cobalt(II,III) oxide, Co3O4, which has a composition similar to the iron oxide Fe3O4 that I had used in many previous thermite tests. I ordered barium sulfate, and I was planning to obtain chromium(III) oxide by decomposing ammonium dichromate. I also intended to buy or synthesize nickel(II) oxide. But chance intervened. After watching one of my thermite experiment videos, a colleague told me about an interesting design of a German aerial bomb from World War II, which he had found described in an old book many years ago. His description inspired me to carry out another experiment using Fe3O4-based thermite. I decided to postpone my plans with alternative oxidizers until a better time. This aerial bomb was filled with thermite. The casing was likely made of magnesium or Elektron alloy (a magnesium-aluminum alloy, approximately 90% Mg and 10% Al)—though my colleague did not specify this. However, he emphasized that inside the bomb, a magnesium tube was placed coaxially within the body. Both the space inside the tube and the gap between the tube and the casing were filled with thermite. I asked: —And what was the purpose of the magnesium tube inside the thermite? —So that the burning thermite would effectively scatter in all directions, creating multiple sources of ignition. I had already planned to make thermite from magnesium and iron oxide (Fe3O4/Mg), but I wasn't in a rush to perform such an experiment because the expected result was poor. This type of thermite burns less vigorously than Fe3O4/Al thermite. First, less energy is released when magnesium oxidizes compared to aluminum. Second, magnesium oxide has a much higher melting point (2825°C) than aluminum oxide (2072°C). As a result, aluminum oxide melts during Fe3O4/Al thermite combustion, while magnesium oxide remains solid in the Fe3O4/Mg version. However, in the case of the aerial bomb design, it's not the melting points of the oxides that matter, but rather the boiling points of the metals. Aluminum boils at 2470°C, while magnesium boils at just 1091°C. This means that during the combustion of Fe3O4/Al thermite, the magnesium tube would boil and evaporate. The resulting magnesium vapor would not only scatter the burning thermite but also ignite in air. In other words, magnesium would burn using atmospheric oxygen rather than oxygen from the iron oxide. In this case, the high melting point of magnesium oxide is irrelevant. I didn't have a magnesium tube, but I did have fragments of a cruise missile made from a magnesium alloy. A colleague had picked them up years ago from an "aircraft graveyard" where military parts were discarded. At the time, no one saw cruise missiles as a threat—no one could have imagined that war would come and similar missiles would one day destroy apartment buildings full of women and children. Shelling now occurs daily, even in the city near where that ''graveyard'' was located. The missile fragments had to be broken down into small pieces—a difficult and laborious task. Then I remembered I had magnesium shavings, which made crushing the fragments unnecessary. I decided on the following composition: Al - 100 g, Fe3O4 - 275 g, Mg - 40 g. That is, I planned to add magnesium shavings to the standard Fe3O4/Al thermite in an amount equal to 40% of the aluminum mass. I weighed all the magnesium shavings and found that I had only 80 g in total. Despite their large volume, they were quite light. I didn't want to use half of my magnesium just for a single experiment that might fail. So I reduced the amount of magnesium by four times. Final composition: Al - 100 g, Fe3O4 - 275 g, Mg - 10 g. I weighed the aluminum powder (100-140 microns) and the iron oxide, then thoroughly mixed the components. I poured a small amount of the Fe3O4/Al mixture into a cut aluminum beer can so that it covered the bottom. On top of that, I placed some magnesium shavings, then added another layer of the Fe3O4/Al mixture and compacted everything with hammer blows. I repeated this procedure until all the thermite and magnesium shavings were mixed and thoroughly pressed into the can. On top of the thermite, I placed a few more magnesium shavings and an incendiary mixture prepared from 1 g of finely dispersed aluminum and 2.75 g of iron oxide. I placed the can in an iron tray filled with dry sand. At that moment, the same colleague who had told me about the German bomb happened to walk into the lab. He asked: —Are you planning to test this thermite here? —No. I'll conduct the experiment outside. Doing it here would burn the lab down. He hadn't realized that the aluminum can contained thermite, simulating the incendiary ammunition he'd described. Of course, setting the lab on fire wasn't part of my plan, so I carried the tray outside and set it up far from any flammable objects. This time, I positioned the camera farther away than in previous tests, anticipating the burning mixture would splash. I aimed a strong burner flame at the incendiary mixture, realizing the need to retreat quickly once combustion began, since I expected pieces of burning thermite to fly in all directions. The incendiary mix ignited, and after a slight delay, the main thermite charge began to burn. A furious, blinding, and intensely hot flame erupted. To the eye, the flame appeared mostly white, though in the video it looked yellow. A storm of sparks hissed and flew in all directions. At first, there was little smoke, but soon the amount of white smoke increased sharply. The flame volume, number of sparks, and the length of their flight were all significantly greater than in a similar experiment using the same amount of Fe3O4/Al thermite but without the 10 g of magnesium. The combustion lasted over 15 seconds, leaving behind a hot yellow pool of molten material on the sand. Surrounding it were white spots—presumably magnesium oxide. I picked up my smartphone and approached. The heat was nearly unbearable, and the phone casing became quite hot. I had to step back. I flipped the solidified but still red-hot melt with a stick. The stick caught fire. The solidified mass had the shape of a convex lens. As the products cooled, there came a point where the red glow was no longer visible to the eye—but remained noticeable in the video. The human eye and a video sensor have different sensitivities to various wavelengths of light. |
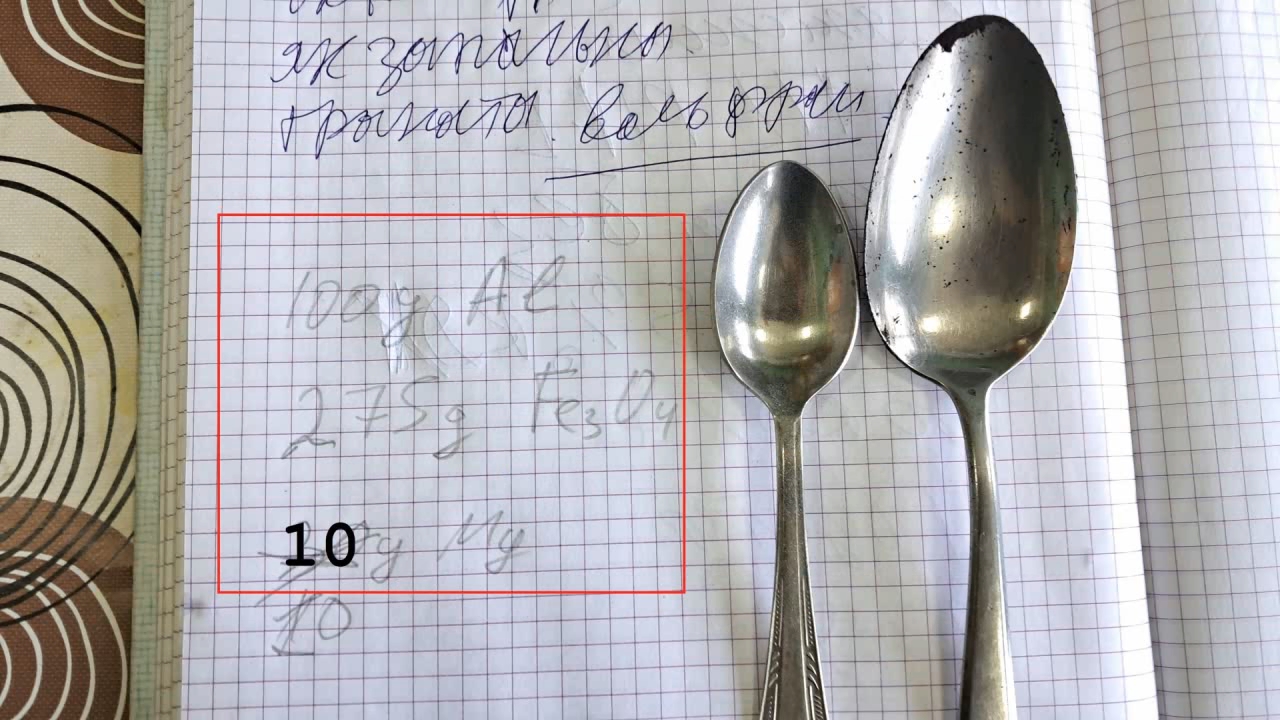
Combustion of Thermite: Iron(II, III) Oxide/Aluminum/Magnesium (Fe3O4/Al/Mg) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
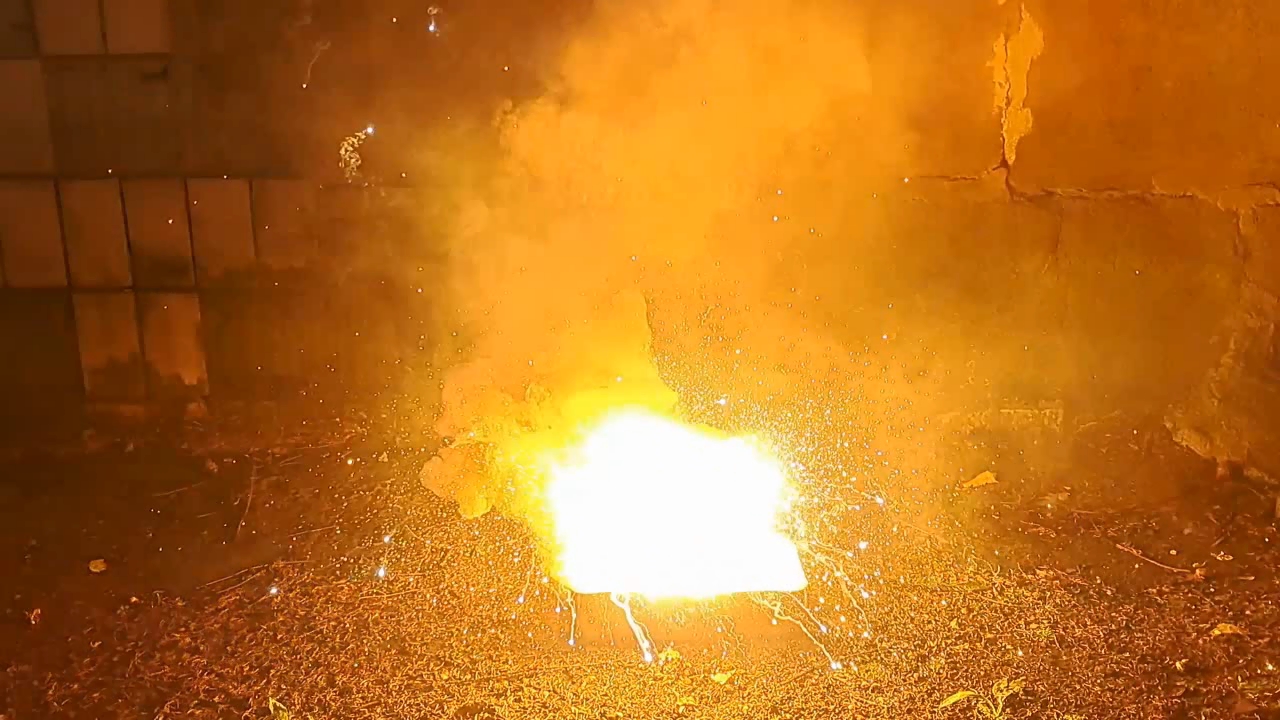
|
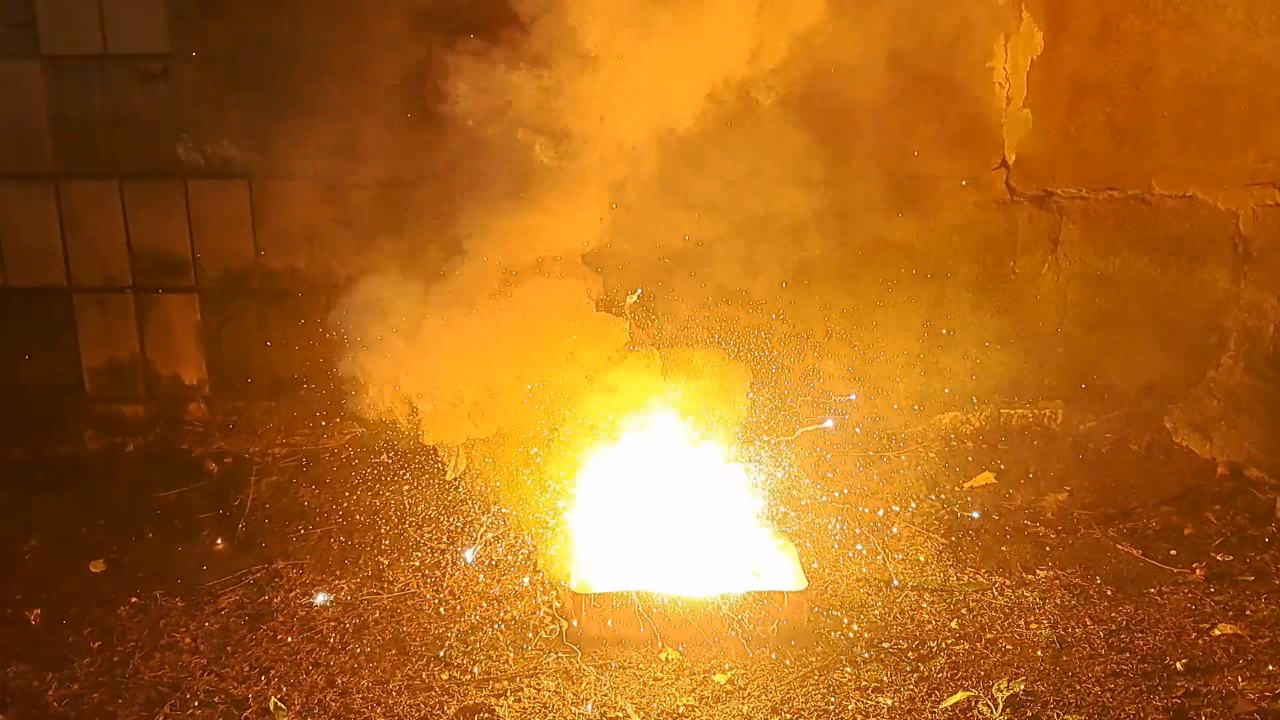
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|