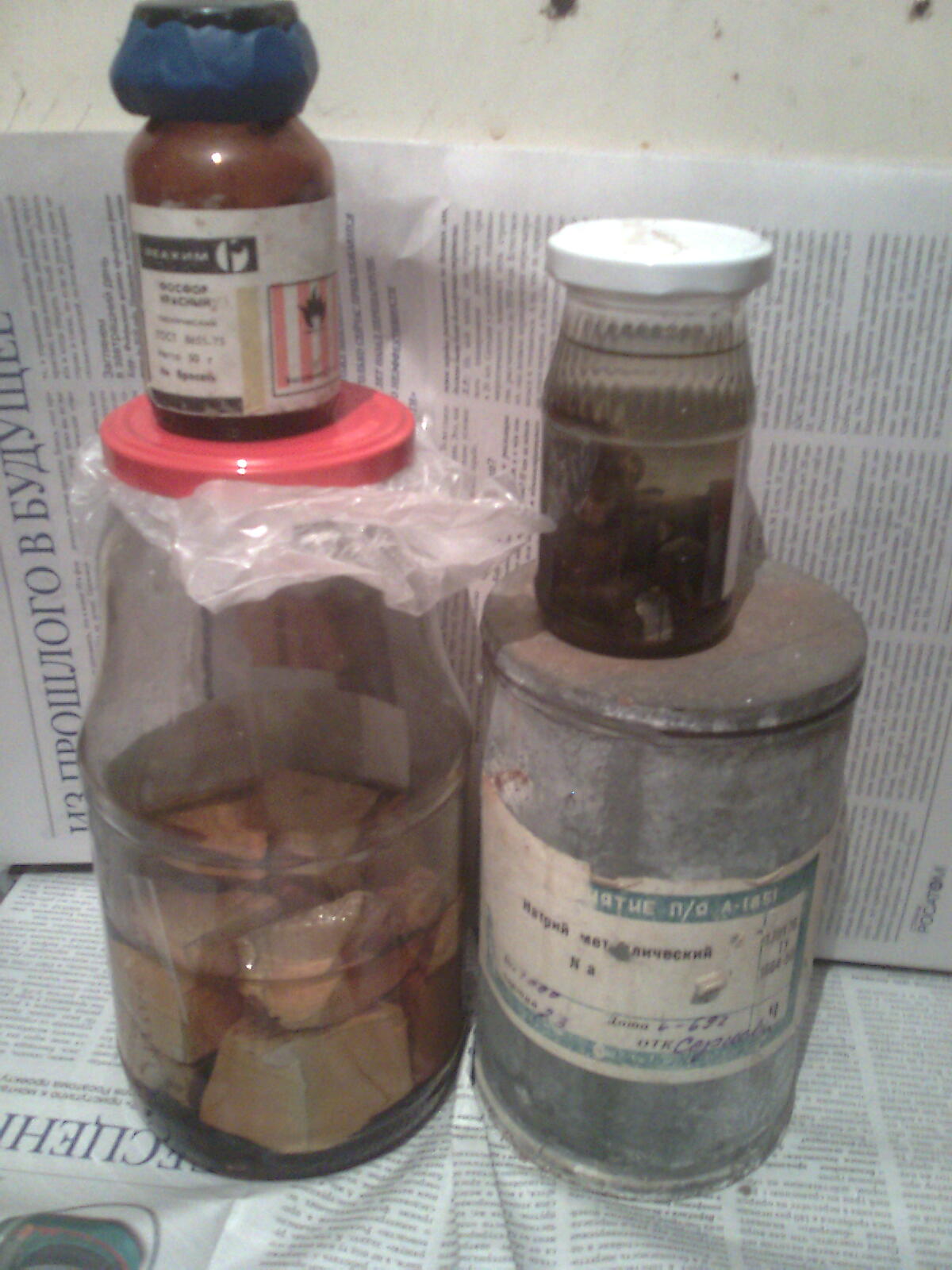
Натрий, калий и фосфор
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2011 |
|
Желанная троица И.Н. Григорьев |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Хотел поделиться воспоминаниями, надеюсь, что коллегам будет интересно прочитать и поучиться на чужих ошибках. Моей "манией" с 5 класса школы были фосфор и щелочные металлы (натрий и калий). Компьютера тогда у меня не было, и информацию я черпал из небогатой школьной библиотеки и расспросов учителей. Особенно вожделенным был калий, поскольку в школе его не было, в отличие от натрия (с которым учительница химии один раз показала опыт в 8 классе). Описание реакции калия с водой казалось чем-то удивительным, сродни чуду. Да и сейчас я считаю несправедливостью запрет калия в школах. Бюрократы-законодатели запретили в школах множество интереснейших веществ. Пусть они таят потенциальную опасность, требуют осторожности в обращении, но если учитель соблюдает технику безопасности, можно без особого риска показывать много интересных опытов. Ученики воспринимают такие опыты почти как фокусы, да и что это за урок химии без яркого эксперимента?! К сожалению, официально-разрешенные наборы школьных реактивов отличаются исключительной скудностью. Все больше нагнетается истерия с так называемыми "прекурсорами". Многие необходимые вещества без официальных бумажек с печатями не достать (и не только увлеченному химику-любителю). Красный фосфор запретили в надежде, что "винтоварение" [1] исчезнет! Наивные люди. Где замешаны большие деньги найдутся бумаги с печатями на покупку лабораторного оборудования и реактивов. А вот для школьника фосфор - мечта. Какая благодать и раздолье было химикам в конце 19 века - в обычной аптеке можно было купить бертолетку [2] и множество реактивов. Я предпринимал наивные попытки получить натрий дома, о которых не стоит даже упоминать. Получить его ничтожные количества удалось лишь на первом курсе. С фосфором дела обстояли несколько проще. Одним из моих первых химических опытов в детстве было получение светящейся массы (смесь продуктов перегонки дерева, оксидов фосфора и белого фосфора) из спичечных терок. Понятно, что фосфора там было немного, но смесь светилась и даже горела зеленым пламенем! Были, конечно, попытки очистить ее и даже получать фосфор другими методами, но они неизбежно были обречены на провал. Будь у нас в школе красный фосфор, возможно, все было бы по-другому. Впервые я стал обладателем кусочка натрия (2-3 г) в 8 классе, благодаря своей учительнице химии, которая не побоялась мне его дать. Натрий был разрезан на маленькие кусочки и хранился, как реликвия в пенициллиновом пузырьке с керосином. Во время учебы в университете мое увлечение химией перешло на новый уровень - расширялась домашняя лаборатория, появлялись реактивы. Правда и тогда не все обстояло гладко. Преподаватели (несмотря на мои просьбы) отказывались дать даже немного реактивов для опытов (сейчас я их понимаю, преподаватели не хотели рисковать: щелочные металлы - очень опасная для глаз, но притягательная игрушка, а от красного фосфора до белого один шаг). Пришлось встать на путь воровства реактивов, что еще оставалось делать?! Купить можно было лишь немногие реактивы. "Одолжить без спроса" удавалось ничтожнейшие крохи реактивов - это стыдно даже называть воровством. Зато в подвале института пылились с советских времен огромные запасы реактивов, которые в большинстве своем никто не использовал. Приведу пример. Один раз я попросил у заведующей лаборатории немного бертолетки для цветных пламенных составов и некоторых других экспериментов. На школьных мероприятиях всегда хотелось показать сногсшибательные опыты, хотелось привить детям любовь к химии, но все такие опыты, как правило, требуют опасных и вредных веществ! Заведующая ответила, что нужно специальное разрешение зам. декана и тогда она выдаст 3 г (!!!), потому что это взрывчатое и опасное вещество (я скромно попросил грамм 10 бертолетки, зная, что в институте ее полно, и она практически нигде не используется). Пришлось уйти ни с чем. В другой раз мне отказались дать нитрат стронция, сказав, что он (!!!) радиоактивен. Хорошо, что каждый раз выручал преподаватель физической и коллоидной химии, эрудит и энциклопедист, который был небезразличным человеком. Я неофициально брал у него фосфор, бертолетку, соли для цветных огней. На практике в школах тоже не обходилось без "комедий". В одной из школ лаборанткой работала библиотекарь. Отчасти это было хорошо, т.к. опыты к своим урокам я готовил сам. Была у них в лаборатории банка красного фосфора, который начал "отмокать". Фосфор выбросили - жуткое кощунство, к сожалению, я этого не застал и не смог спасти ценный реактив. Мероприятия всегда вызывали огромный интерес и удивление детей и даже учителей, тоже не видевших некоторых опытов. Я получал фосфин, сжигал на руке пироксилиновую вату, запускал "бутылку-ракету" (наполненную водородом с воздухом), проводил опыты с "бертафосом" [3] - адской, но прекрасной смесью, делал цветные бенгальские огни, зажигал смесь Кибальчича [4] - с помощью "волшебной" палочки, смоченной серной кислотой и проводил много других интересных опытов. На первом-втором курсах мне удалось отсыпать немножко красного фосфора (на четвертом курсе я "разжился" им в школе - целых 40-50 г), взять несколько больших кусочков натрия и случайно "прикарманить" литий. Для заинтересованных читателей опишу способ, как безопасно своровать щелочные металлы. Один преподаватель как-то рассказывал, что студент, присутствующий на лабе [5] при опытах с калием, на перемене улучил момент и взял кусок калия с собой (без тары)!!! Во время следующей лекции калий вспыхнул. Вот была комедия! Наиболее простой способ не попасть в аналогичную ситуацию - постоянно носить с собой несколько полиэтиленовых мешочков. Всегда может неожиданно представиться возможность что-нибудь взять. Кладете в мешочек кусок металла, выдавливаете воздух и завязываете. Теперь можете смело брать металл с собой и даже положить его в карман! [6] Красный фосфор я тогда перегонял в толстой изогнутой трубке (спасибо стеклодуву ВГУ, который не раз меня выручал), переводя его в белый фосфор. Последний затем очищал "хромпиком" и с помощью инсулинового шприца делал палочки, белоснежные, как медицинский парафин. Делал с ним разные опыты - получал самовоспламеняющийся фосфин - тоже удивительное зрелище. Каждый пузырек газа, выходя на поверхность воды, вспыхивает с легким хлопком яркой желтой вспышкой, выбрасывая вверх великолепное кольцо из "дыма". Делал светящиеся парафиновые "карандаши". Они давали таинственно-волшебное свечение рисунков, особенно на стекле. "Чудо самовозгорания" делал с бензольным раствором фосфора, поскольку сероуглерода не было. Ну и конечно смесь Армстронга [7] , куда же без нее, имея фосфор и бертолетку. Сколько юных химиков от нее пострадало. ПРИ ПРИГОТОВЛЕНИИ СМЕСИ И ОБРАЩЕНИИ С НЕЙ НУЖНА ОСОБАЯ ОСТОРОЖНОСТЬ И НЕКОТОРЫЕ ТОНКОСТИ, НЕ ЗНАЯ КОТОРЫХ МОЖНО ПОПЛАТИТЬСЯ ПАЛЬЦАМИ И ГЛАЗАМИ! Меня пронесло, хотя я тоже вначале ее недооценивал. Эта смесь намного опаснее гремучей ртути и нитроглицерина. Одно время делал из нее взрывающиеся от удара пластилиновые шарики. Никогда так не поступайте! Более безопасно делать из нее "пистоны" на растворе желатина. Засохшие на полиэтилене капельки легко отделяются, похожи по консистенции и виду на спичечную массу, негигроскопичны. Обладают удивительно высокой чувствительностью к трению, удару, огню - сразу взрывают! Кинул такую невзрачную крупинку на пол - и наступивший на нее подскакивает от неожиданного взрыва. Неизменным успехом у школьников пользовался эффектный опыт взрыва смеси щелчком пальцев. Калий так и оставался бы мечтой, если бы не преподаватель физической химии, отчасти понявший мои интересы и помогающий советами в различных вопросах, который дал на третьем курсе "огромное" для меня количество этого металла - около 40 г! Сразу я принялся за разные опыты с калием, причем приготовляя сплав с натрием, слегка опалил волосы, слава богу, глаза остались целы. До сих пор с каким-то восторгом наблюдаю, как калий горит на воде своим насыщенным фиолетовым пламенем. Однажды (на пятом курсе) мне "сказочно повезло": отчасти все мои детские мечты сбылись! Я стал обладателем 2 кг!!! чистого натрия! Как-то для диплома сокурсницы потребовались реактивы. Нужно было идти на склад, и чтобы ей помочь пошли я и ее дипломный руководитель. Подвал казался для меня сокровищницей из "тысячи и одной ночи" - огромные многоярусные стеллажи заставленные банками, посудой, бутылями и разными стеклянными изделиями. Ища реактивы на верхнем ярусе, я увидел большой ящик полный запаянных килограммовых жестянок натрия! Я не смог отвести взгляда от них! Преподавателю нужно было идти на пару, и он доверил нам ключи от "сокровищницы". Мысли мои метались, судорожно ища способ унести незаметно банку натрия. И тут я придумал план - была зима, рядом со складом намело снега, и, дрожа от страха быть пойманным на месте преступления, я крался в полутемном подвале с заветной жестянкой. Выйдя и воровато оглянувшись вблизи склада, я присыпал снегом банку, но тут жадность разыгралась с новой силой, и я вернулся за второй банкой, к счастью удалось спрятать и ее! Так же в тот день я "взял" маленькую баночку калия, случайно завалявшуюся среди всякой рухляди в проржавевшем сейфе. Ее мне вынесла сокурсница в своей сумке. Закрыв склад, мы вернулись в университет. Мысли неотступно вертелись вокруг натрия, но нести его было не в чем! Очень медленно текло время. Вернувшись за сумкой, на снимаемую мной квартиру я почти бежал обратно, боясь за натрий. Однако все обошлось, я нашел банки и, спрятав их в сумку, скрылся с радостно бьющимся сердцем. Сбылась моя детская мечта - попробовать кинуть большие куски натрия в воду. Невозможно описать состояние, когда дома я вскрыл банку и увидел 2 полукилограммовых куска натрия, разрезав их на более мелкие куски, я поместил натрий в большую стеклянную банку, слегка залив керосином. Хотя в герметичной банке натрий отлично хранится и не окисляется и без керосина. Сам факт обладания щелочными металлами приносит какое-то непонятное удовлетворение. С братом мы проводили "опыты", кидая в речку куски натрия (на безопасное расстояние) или устраивали "натриевые фейерверки" и взрывы у себя на огороде! Можно бросив маленький кусочек натрия в воду быстро поджечь водород, тогда над бегающим шариком металла трепещет желто-оранжевое пламя. Крупные куски загораются самопроизвольно, но не "бегают", а "взрывают", разлетаясь красивым фонтаном огненных искр, образуя клубы ядовитого аэрозоля. Красивое зрелище, но очень опасное, малейшая капля горящего натрия и щелочи, попавшая в глаза, может привести к слепоте! Чтобы вызвать взрыв натрия лучше поступить следующим образом. На поверхность воды положить фильтровальную бумагу, на бумагу осторожно положить кусок натрия и быстро отбежать. Через некоторое время раздастся довольно громкий взрыв. Что интересно на опыты я израсходовал около 600 грамм металла, одна банка так и осталась нераспечатанной, вот ведь жадность! Калия было не очень много. Пробовал бросать довольно большие кусочки в воду. Оказалось, что он обычно "разлетается" фонтаном искр со слабым хлопком, в отличие от "взрывов" натрия. Литий реагирует спокойно. Интересно поджечь выделяющийся водород - выглядит красиво. _____________________________________________________________ 1 Винтоварение - сленговое название процесса незаконного изготовления некоторых наркотических средств (препаратов эфедрина, псевдоэфедрина, а также метамфетамина) с целью их продажи или употребления. 2 Имеется ввиду бертолетова соль (хлорат калия). 3 Бертафос - разговорное название смеси бертолетовой соли и красного фосфора. Данная смесь сильно взрывается при поджигании, трении, ударе. 4 Смесь Кибальчича - смесь бертолетовой соли с сахаром (или некоторыми другими горючими веществами). При контакте с концентрированной серной кислотой данная смесь вспыхивает. 5 Лаба - разговорное название лаборатории или лабораторной работы (у студентов). 6 Учитывайте также, что можно запачкать одежду маслом, в котором хранятся щелочные металлы. 7 Смесь Армстронга - одно из названий смеси бертолетовой соли и красного фосфора (см. примечание 3). |

Натрий, калий и фосфор |
|
|