Химия и Химики № 3 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 3 2022 Журнал Химиков-Энтузиастов |
Хлорид кальция и сульфат меди Calcium chloride and copper sulfate В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Решил провести реакцию, - нет не между теми веществами, что в заголовке, а между азотной и сульфаминовой кислотами. Такое взаимодействие приходилось проводить много раз, но не в лабораторном стакане или в колбе, а на предприятии. Добавлением сульфаминовой кислоты разлагали избыток азотной кислоты перед тем, как осаждать из раствора золото. Реакция шла с бурным выделением газа - примерно, как в случае соды с уксусом. Тогда я думал, что выделяется азот. Посмотрел литературу - оказалось, что выделяется не азот, а закись азота. Интересный газ (учитывая его физиологическое действие), но не для меня - здоровье уже не то, чтобы изображать из себя подопытного кролика.
Решил просто заснять реакцию на видео, думая, что это будет просто. Добавил в продажную "концентрированную" азотную кислоту твердую сульфаминовую кислоту и... ничего. Вместо бурной реакции - никаких признаков реакции. Попробовал поменять условия (добавка меди, серной кислоты, воды...) - ничего. Видимо, концентрация азотной кислоты оказалась недостаточной. Вместо того, чтобы разбираться, в чем дело, пытаясь провести давно известную реакцию, решил заняться чем-нибудь другим. Увидел в соц. сети ролик реакции двойного обмена между растворами сульфата меди и хлорида кальция. В результате сразу же выпадал белый осадок малорастворимого сульфата кальция. Оба исходных вещества доступны и не обладают высокой токсичностью. Почему бы не попробовать? Для начала решил взять эквимолярные количества веществ и разбавленные растворы: хлорид кальция (безводный), М =111.08 г/моль - 2.2 г, 50 мл воды; сульфат меди (пятиводный),М = 249.68 г/моль- 5.0 г, 60 мл воды. Раствор хлорида кальция получился мутным (препарат технический - осушитель для эксикаторов), поэтому профильтровал. В стакан с раствором хлорида кальция стал добавлять по каплям раствор сульфата меди. Ничего. Добавил весь (оставшийся) раствор сульфата меди сразу - ничего. Перемешал - осадка сульфата кальция не заметил. Это уже не смешно. В чем дело? Ай-ай! Как так можно было так ошибиться: вместо сульфата меди я явно взял ацетат... Он осадка с катионом кальция не дает. Положился на память (размер бутылочки), даже не глянув на этикетку! Ничего - видео будет для сравнения. Нужно будет и саму бутылочку заснять. Заснял, смотрю, а на ней написано: "сульфат меди" (кроме того, ацетат меди в твердом виде - зеленый, а не голубой, как сульфат меди пятиводный) [K1]. Смотрю на стакан с реакционной смесью: сверху раствор прозрачный и не мутный, но, пока я возился с бутылочкой (2-3 минуты), на дне стакана уже начал образовываться осадок гипса (сульфат кальция). Дальше - осадка больше. Раствор постепенно начал мутнеть, в нем появились белые хлопья (точнее - чешуйки). На определенном этапе они напоминали падающий снег. Дальше в стакане образовался объемный осадок сульфата кальция, а над ним - голубой раствор хлорида меди. Позже (во время просмотра видео) обнаружил, что образование отдельных хлопьев осадка и мути было четко видно еще ДО того, как я отвлекся. Бывает и такое - некоторые процессы, которые экспериментатор не заметил в живую, становятся очевидными при просмотре видео эксперимента. Хотя в данном случае нет нечего удивительного: дело в предубеждении - я ожидал увидеть быстрое выпадение объемного осадка, поэтому не заметил медленное образование мути и отельных хлопьев. Т.е., сульфат кальция из раствора, естественно, выпадает в осадок, но происходит это со значительной задержкой. Для сульфата кальция такой индукционный период является характерным. Во-первых, хотя сульфат кальция и малорастворим, но растворимость его довольно заметна (0.2-0.3 г/100 мл воды), во-вторых, он склонен к образованию пересыщенных растворов. Есть даже такой термин в аналитической химии - "гипсовая вода" - насыщенный раствор сульфата кальция, который дает осадки с катионами стронция и бария, но не дает осадок с катионом кальция. Для сравнения растворимость сульфата бария намного ниже - 0.0002 г/100 мл (20°C), его осадок выпадает практически моментально. |

Сульфат меди (медный купорос) |

Хлорид кальция и сульфат меди |

|

|

|

|

|

|

|

|

|

|

|

|
|
Может, попробовать более концентрированные растворы?
Взял: хлорид кальция (безводный) - 8 г в 20 мл воды; сульфат меди (пятиводный) - 8 г в 70 мл. Раствор хлорида кальция также профильтровал. Без всяких расчетов видно, что хлорид кальция в избытке (массы веществ равны, а молярная масса хлорида кальция (безводного) меньше, чем сульфата меди пятиводного), но у нас демонстрационный эксперимент, а не препаративный синтез сульфата кальция. К раствору хлорида кальция добавил сразу весь объем сульфата меди. Первые секунды - прозрачный раствор без мути, но появилось немного хлопьев. Перемешиваю стеклянной палочкой - раствор мутнеет на глазах (перемешивание стеклянной палочкой в стеклянных сосудах, а особенно - потирание палочкой о стенки - известный прием инициации образования осадков, поскольку частички стекла становятся центрами кристаллизации). Еще через несколько секунд образовались белые хлопья - раствор стал полностью непрозрачным и напоминал "голубое молоко". Оставил стакан в покое. На дне собрался белый объемный осадок гипса, над ним - голубой раствор хлорида меди (с остатками хлорида кальция). Ничего выдающегося, но эксперимент простой и не требует использования труднодоступных и токсичных веществ. |

Хлорид кальция и сульфат меди |

|

|

|

|

|
Борная кислота, цинк, магний и глицерин Boric acid, zinc, magnesium and glycerol В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Идея эксперимента такая. Борная кислота, H3BO3 - очень слабая, плюс к этому - она не очень хорошо растворима в воде. Константа диссоциации борной кислоты по первой ступени pK1 - 9.24, растворимость в воде при комнатной температуре - около 5 г на 100 мл. Учитывая два эти фактора, вряд ли стоит ожидать заметной реакции между водным раствором бороной кислоты и цинком. Борную кислоту даже оттитровать щелочью нормально не удается - переход (скачек рН в конечной точке титрования) слишком размытый из-за того, что кислота слабая.
Более того, борная кислота, H3BO3 даже солей соответствующих не дает (вроде "Na3BO3"). При реакциях со щелочами, металлами и оксидами металлов (в растворе и расплаве) образуются тетрабораты (например, бура Na4B4O7) или метабораты, например, Ca(BO2)2. Однако, есть интересная особенность. Борная кислота образует с многоатомными спиртами (в частности, с глицерином и сахарами) комплексы, которые являются более сильными кислотами, чем сама борная кислота. В присутствии глицерина борную кислоту уже можно оттитровать едким натром. Раз так, то будет ли реагировать борная кислота с цинком, если в раствор добавить глицерин? Скорее всего - нет, но я все равно надеялся. Взял 2.5 г борной кислоты, залил 50 мл дистиллированной воды, оставил растворяться (периодически перемешивая). Температура - около 20°С. Небольшая часть кислоты не растворилась - слил раствор с осадка. Налил раствор в пробирку, поместил туда гранулы цинка. Выделение пузырьков водорода незаметно. Хорошо. Добавил 3 мл глицерина - перемешал. Тоже - ничего. Прикоснулся к гранулам цинка зачищенной медной проволокой (гальваническая пара медь-цинк) - выделения водорода все равно водорода нет. Добавил еще 3-4 г борной кислоты. Перенес содержимое пробирки в стакан, нагрел до кипения, покипятил, прекратил нагрев. Борная кислота растворилась (при нагревании ее растворимость значительно увеличивается). Как только выделение пузырьков пара прекратилось, стало видно, что выделения водорода на поверхности гранул цинка отсутствует. Таким образом, признаков реакции между цинком и насыщенным раствором борной кислоты не наблюдалось: ни при комнатной температуре, ни при нагревании, ни при контакте цинка с медью, ни в присутствии глицерина. Значит, комплексная кислота, которую образуют борная кислота и глицерин, - не такая и сильная. Есть одна утешительная пословица: "Отрицательный результат - тоже результат". Иногда - так и есть, бывает даже, что отрицательный результат многого стоит, но гораздо чаще - нет. В наше время научных исследований проводится столько, что и положительные результаты уже мало кого интересуют, а тут - отрицательный результат (да еще и в "кухонном" опыте). |

Борная кислота, цинк и глицерин (нет реакции) |

|

|
|
Ладно - настроимся на позитив. А как борная кислота реагирует с магнием? Для начала взял тот же раствор (вода и глицерин, насыщенные борной кислотой), что остался после опыта с цинком. Раствор уже остыл до комнатной температуры. Слил с осадка. Добавил в раствор маленький кусок магниевой стружки.
И... ничего - в первые секунды. Чуть позже - стало заметно выделение пузырьков водорода. Стружка плавала возле поверхности, выделение пузырьков было слабым, но постепенно усиливалось. Добавил еще магниевой стружки, результат - выделение водорода средней интенсивности. Верхняя часть раствора стала бело-мутной, но позже я убедился, что это был не осадок бората магния, а мелкие пузырьки водорода (в отсутствии магния раствор становился прозрачным и бесцветным - лишь слегка мутным). Выделение пузырьков водорода значительно затянулось: ведь один эквивалент (или один грамм) магния выделяет одинаковое количество водорода и при реакции с соляной кислотой, и с борной. Но в первом случае скорость выделения водорода (скорость реакции) значительно выше, чем во втором: поэтому в случае магния и борной кислоты процесс растягивается во времени. Через несколько часов выделение водорода ослабло, но было все еще значительным. Ждать окончания реакции не стал - все равно ее придется переделывать: для чистоты эксперимента начинать нужно с насыщенного раствора борной кислоты и магния, а уже потом, возможно, добавить в него глицерин (чтобы проверить, ускорится реакция, или нет). В 50 мл дистиллированной воды добавлял борную кислоту - до тех пор, пока она не перестала растворяться. Подержал раствор над осадком, перелил в стакан. Добавил магниевую стружку. Сначала - маленький кусочек. Магний взял тот, который остался после предыдущего опыта (нечего разбрасываться реактивами: в детстве для меня магний был такой же мечтой, как супер-новый смартфон для нынешнего поколения). На поверхности стружки началось выделение газа. Стружка плавала на поверхности, от прикосновения палочкой тонула, потом - опять всплывала. Выделение газа - средней интенсивности (примерно, как и для раствора с добавкой глицерина). Добавил еще магниевой стружки. Верхняя часть раствора стала бело-мутной от водорода - как и в предыдущем опыте. Добавил 3 мл глицерина, перемешал, - видимо, это ускорило реакцию, то разница не была насколько значительной, чтобы утверждать. Позже добавил еще 1.5 мл глицерина. Через несколько часов реакция стала замедляться, раствор - частично светлеть. В этот раз дождался полного окончания реакции: оставил раствор еще на несколько часов. Результат: прозрачный и бесцветный раствор без мути. Выделение визуально водорода прекратилось, но при просмотре отснятого видео таки заметно слабое выделение пузырьков. Большая часть стружки растворилась, часть осталась, причем на поверхности магния образовались "зазубрины". |

Борная кислота, магний и глицерин |

|

|

|

|

|

|
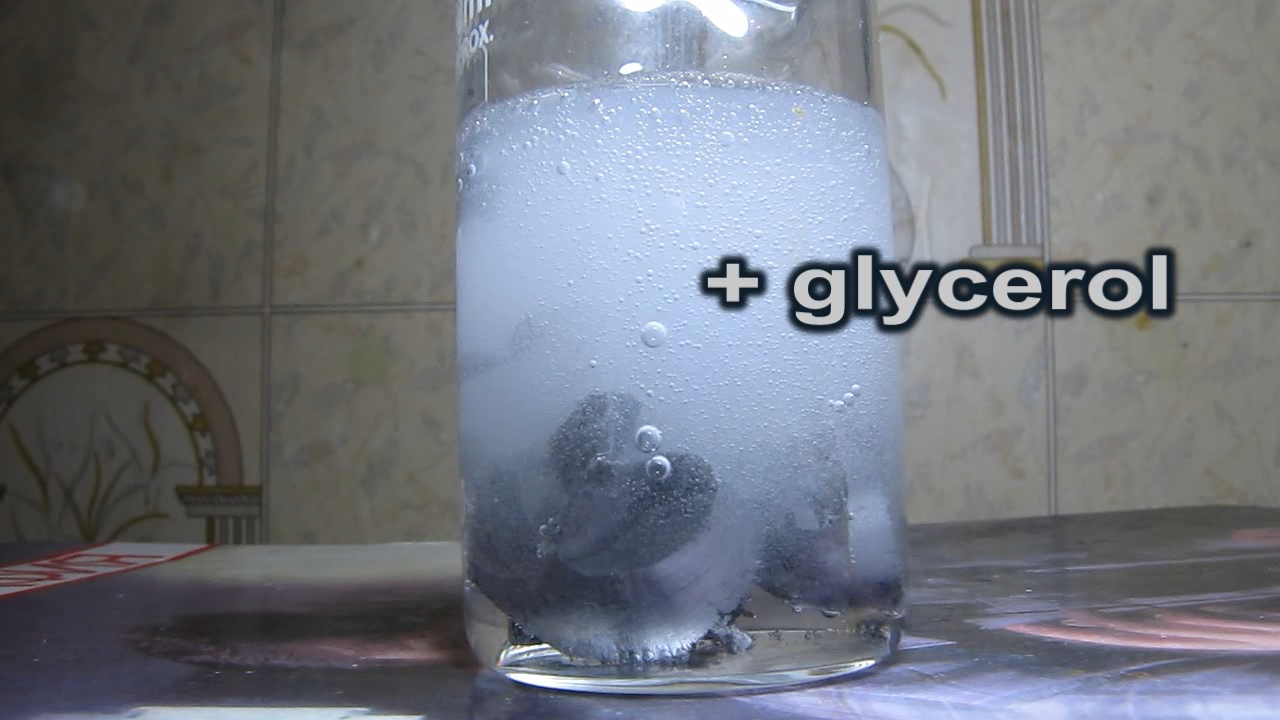
|

|

|

|

|

|

|

|
|
Комментарии
К1
Точнее, твёрдый ацетат меди сине-зелёный в случае мелких кристаллов и тёмно-синий - в случае крупных.
|