Chemistry and Chemists № 3 2023
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2023 Journal of Chemists-Enthusiasts |
Experiments with aluminium and iron (III) hydroxides - pt.1, 2, 3 В.М. Вітер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Aluminium hydroxide (after ageing of precipitate) and acetic acid - pt.1
Aluminium hydroxide precipitate was stayed under water for a month. The ageing process took place. Then an excess of glacial acetic was added to a small amount of the precipitate. The precipitate was not dissolved. After a while the reaction mixture was filtered to separate an insoluble solid phase. An ammonia solution was added to the filtrate (to determine aluminium in the solution). There was no precipitate (aluminum was not found). Therefore, aluminium hydroxide had not dissolved in glacial acetic acid (even partly).
После экспериментов с алюминатом калия у меня осталась целая поллитровая банка с осадком гидроксида алюминия. Он образовался при реакции растворов сульфата алюминия и алюмината калия. Основную часть объема банки занимал именно осадок. Раствора над ним было всего пару сантиметров. Причем при стоянии дальнейшего уплотнения (оседания) осадка почти не наблюдалось. Промыл осадок дистиллированной водой методом декантации. Для этого осторожно декантировал щелочной маточный раствор (слил жидкость с осадка, пытаясь не взмутить осадок), добавил на место слитого раствора дистиллят. Перемешал, дал осесть осадку, потом снова декантировал жидкость и добавил новую порцию дистиллированной воды. После второй декантации, добавления воды и перемешивания рН раствора был 9. Декантировал жидкость третий раз, снова залил дистиллят и оставил примерно на месяц. Почему так долго? Это было не умышленно: я занялся другими экспериментами в надежде сделать что-то полезное с этим гидроксидом алюминия в будущем. Сначала осадок сохранял объем и оседал очень медленно, но со временем его объем уменьшился в несколько раз: вместо осадка основной объем банки теперь занимал маточный раствор. Уменьшение кажущегося объема осадка было результатом не просто механического уплотнения, но процесса старения гидроксида алюминия (который находился под слоем маточного раствора). Старение осадков (в частности, гидроксидов, но не только) - химический процесс, который приводит не только к изменению внешнего вида осадка, но и его химической структуры, а это, в свою очередь, вызывает изменение химических свойств. Свежеосажденные малорастворимые гидроксиды обычно легко вступают в различные химические превращения, но при стоянии под слоем раствора они стареют: частицы укрупняются, структура теряет воду, аморфные (рентгеноаморфные) осадки становятся кристаллическими - в результате уменьшается способность осадков реагировать с кислотами и щелочами. В некоторых случаях постаревшие осадки и вовсе такую способность теряют (например, гидроксиды титана (IV) и олова (IV) ). Т.е. осадок становится более химически инертным. Рассмотрим это на примере гидроксида алюминия - схожим образом ведут себя и другие осадки гидроксидов металлов. А глобально, явление старения наблюдается не только у гидроксидов. Общеизвестно, что формула "Al(OH)3" - условность, реальный состав осадка описывается формулой Al2O3·хH2O. Т.е. количество воды на формульную единицу "Al2O3" может меняться. Почему? Свежеосажденный гидроксид алюминия представляет собой аморфный гель. А для аморфных фаз "закон не писан" - в том смысле, что их состав подчиняется правилам формальной валентности, но не обязан быть постоянным. Это может быть Al2O3·1.75H2O, а может Al2O3·2.11H2O. Дело в том, что аморфные вещества не имеют ближнего порядка - в отличие от кристаллов. Для аморфных фаз строгое положение атомов в их структуре не задано (обязательными являются только сохранение валентности и величины валентных углов). Образно говоря, в структуре аморфного гидроксида на пять групп Al-OH может быть 2 мостиковые группы Al-O-Al, а может быть 3 или 1.55. Аморфные твердые тела - по сути, переохлажденные жидкости. В стакане воды может быть растворен 1 г сахара, а может быть 2 или больше - и вода, и сахар будет в одной фазе (в одной структуре) - главное не превысить предел растворимости. Что-то аналогичное мы наблюдаем и с Al2O3·хH2O (аналогия, разумеется, не строгая). Вода в структуре гидроксида алюминия может быть нескольких видов. Во-первых, это гигроскопическая вода, которая находится в виде молекул H2O, слабо связанных со структурой, во-вторых - гидратная вода (которая связывается с катионами, в меньшей мере - с анионами, выступая в роли лиганда), есть еще т.н. конституционная вода. С основным законом государства (конституцией) конституционная вода имеет мало общего (разве что происхождение названия). Это вода, которая, строго говоря и водой-то не является. В смысле - это не молекулы H2O. Конституционная вода содержится в структуре вещества в виде групп -H и -OH. Водой ее называют потому, что при нагреве (обычно), реже - при других химических превращениях, вещество отщепляет молекулы воды. Химическая суть процессов старения в том, что две группы Al-OH могут отщеплять воду с образованием мостиков Al-O-Al: 2Al-OH => Al-O-Al + H2O Т.е., при старении гидроксида алюминия отщепляется конституционная вода. Подобный процесс происходит и при сушке осадка гидроксида алюминия. Только при сушке с прокаливанием описанное превращение происходит с каждой группой Al-OH, а при старении осадка - только с некоторыми. Учитывая, что с каждым алюминием связано сразу 3 атома кислорода:(-O-Al(-O-)-O-, нетрудно представить, как изменяется пространственная структура гидроксида алюминия во времени. Вместе с конституционной водой осадок при старении теряет и другие виды воды. В результате старения происходят такие изменения структуры, что аморфный осадок гидроксида алюминия становится кристаллическим. Причем этот процесс происходит не скачкообразно (как при замерзании воды с образованием льда), а постепенно, через промежуточные стадии [1]. Поэтому кроме кристаллической и аморфной фаз есть и другие термины, например, "слабо кристаллическая фаза" (poorly crystallized). Еще один важный результат эффекта старения - сокращение удельной поверхности осадка и резкое ослабление его сорбционных свойств. Поэтому свежеосажденный гидроксид алюминия или, например, свежеосажденный гидроксиапатит нужны не только тогда, когда мы собираемся растворить осадок, но и тогда, когда осадок служит сорбентом. Если осадок был изначально кристаллическим (не аморфным), то при стоянии под слоем маточного раствора более мелкие кристаллы могут растворяться, а за счет их растут более крупные кристаллы - происходит укрупнение кристаллов осадка. Иногда это хорошо (более крупные кристаллы легче фильтровать и промывать, например), иногда - нет, т.к. крупные кристаллы могут захватывать маточный раствор во внутренних полостях. Именно по этой причине крупные кристаллы кухонной (каменной) соли "стреляют", попадая на горячую сковородку. Вода во внутренних полостях вскипает, превращается в пар и разрывает кристалл. Итак, у меня осталось сравнительно большое количество гидроксида алюминия, который явно постарел. Хотел проверить, как он реагирует с кислотами. С азотной и серной кислотой - эксперименты уже были, с соляной кислотой - будет аналогично. А как гидроксид алюминия реагирует с уксусной и лимонной кислотами? Не знаю, но есть на что ориентироваться. Алюминий - аналог трехвалентного железа (не во всем, разумеется). При добавлении к солям трехвалентного железа ацетата натрия и нагревании раствора выпадает осадок основного ацетата трехвалентного железа. Алюминий также должен давать основный ацетат. Средний ацетат (триацетат алюминия), Al(CH3COO)3 наверняка получен, но скорее всего - "обходными путями": вряд ли триацетат алюминия образуется из водного раствора (уксусная кислота - слабая, ее алюминиевая соль должна сильно подвергаться гидролизу, особенно - при попытке выпарить раствор). Почитал - так и есть: триацетат алюминия образуется при нагревании. Для этого на хлорид алюминия или металлический алюминий действуют уксусным ангидридом. В присутствии даже следов воды триацетат алюминия гидролизуется с образованием основных ацетатов. Если к раствору соли алюминия (например, хлорида алюминия) добавить ацетат натрия и нагреть - выпадет осадок основного ацетата алюминия - аналогично такой же реакции с солями железа (III). При действии на гидроксид алюминия растворов уксусной кислоты образуются основные соли алюминия. В идеале это должны были быть: моно- Al(HO)2(CH3COO) и диацетат алюминия Al(HO)(CH3COO)2, но в реальности состав основных ацетатов алюминия может быть и более сложный (формулы, - например, см. [2]). Причем, твердые основные ацетаты алюминия получаются при упаривании водного раствора (который образовался в результате реакции уксусной кислоты и гидроксида алюминия). Из этого следует, что гидроксид алюминия должен хотя бы частично растворяться при действии уксусной кислоты (а частично - переходить в осадок основных ацетатов). В "Аналитической химии алюминия" [2] напрямую сказано, что основный ацетат алюминия Al(HO)(CH3COO)2 незначительно растворим в воде (2-3%). Плохо то, что наш осадок гидроксида алюминия долго стоял под слоем раствора - он мог потерять способность реагировать с уксусной кислотой. Может использовать другую - более сильную кислоту, например, лимонную? Для начала - посмотрел Википедию - там утверждается, что цитрат алюминия нерастворим во воде. 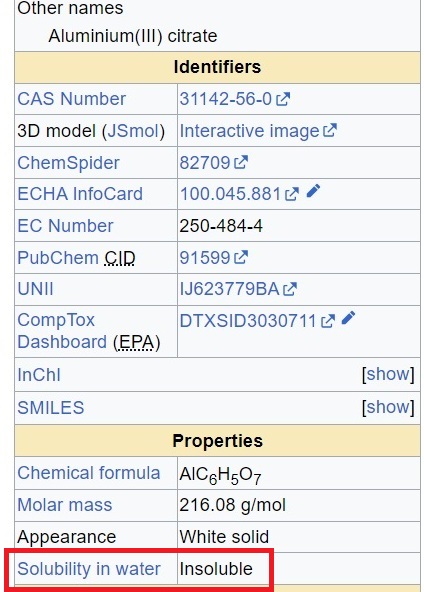 Aluminium citrate properties Если это - правда, растворение осадка гидроксида алюминия в лимонной кислоте ожидать не следует (один белый осадок гидроксида перейдет в другой осадок - цитрата, неотличимый по виду). Посмотрел базы поставщиков цитрата алюминия - там утверждается противоположное (цитрат алюминия медленно растворим в холодной воде, хорошо - в горячей). Учитывая, что Википедия пишется волонтерами, а производители и продавцы несут юридическую ответственность за соответствие характеристик продукта, я более склонен верить последней информации. Цитрат алюминия получают не из гидроксида, а из хлорида алюминия. Для этого смешивают растворы хлорида алюминия и лимонной кислоты, а потом добавляют гидроксид натрия (или аммиак) для увеличения рН до заданного значения. В результате добавления щелочи образуется белый осадок цитрата алюминия. В любом случае, если с цитратом есть сомнения, лучше начать с ацетата. Точнее - с гидроксида алюминия и уксусной кислоты. Первоначально я планировал взять немного осадка гидроксида алюминия (того, который месяц простоял под слоем воды) и добавить к нему избыток ледяной уксусной кислоты. Перемешать, оставить стоять. Осадок гидроксида алюминия, разумеется, не растворится (продукт реакции - основный ацетат алюминия тоже будет выглядеть как белый осадок). Потом в этот же стакан добавить соляную кислоту (можно серную или азотную), перемешать и констатировать, что осадок растворился. Но потом я подумал, что если гидроксид алюминия дает с уксусной кислотой основные ацетаты, которые хоть слабо, но растворимы, то после взаимодействия уксусной кислоты и гидроксида алюминия логичнее было не проводить банальное растворение осадка в соляной кислоте. А вместо этого просто отфильтровать осадок основных ацетатов, потом - к фильтрату добавить избыток аммиака. Наш фильтрат - уксусная кислота, которая, возможно, содержит алюминий, а, возможно, нет. Почему "нет"? Исходный гидроксид алюминия у нас не свежеосажденный, а наоборот (он долго стоял под слоем раствора - постарел и, вероятно, может не прореагировать со слабой уксусной кислотой). Если фильтрат содержит алюминий, с избытком аммиака он даст осадок гидроксида алюминия. Если алюминия в растворе нет - осадок не образуется, будет прозрачный и бесцветный раствор без опалесценции. Последний вариант означает, что гидроксид алюминия не прореагировал с уксусной кислотой (или частично прореагировал, но не дал растворимых продуктов). Философско-теоретическая часть объявляется закрытой (много теории - скучно). Проведем эксперимент. В стаканчик поместил небольшое количество гидроксида алюминия (отобрал из банки с осадком). Добавил примерно 15 мл ледяной уксусной кислоты, перемешал. Образовалась белая суспензия. Признаков растворения осадка не наблюдалось. При стоянии (с периодическим перемешиванием) белый осадок не исчез. Такой результат можно объяснить двумя альтернативными путями: 1. гидроксид алюминия перешел в осадок основного ацетата алюминия (часть алюминия - в растворе); 2. гидроксид алюминия постарел, поэтому он не прореагировал с уксусной кислотой (в растворе нет алюминия). Принципиально возможен и третий вариант: гидроксид алюминия частично прореагировал, но без образования растворимых продуктов. Полностью этот вариант исключить нельзя, но мы его рассматривать не будем, поскольку согласно литературе, основные ацетаты алюминия слабо растворимы даже в воде. Как установить, какой из вариантов взаимодействия уксусной кислоты и постаревшего гидроксида алюминия имел место? К счастью, сделать это просто даже в условиях Профильтровал реакционную смесь через бумажный фильтр, чтобы отделить осадок от раствора. Раствор перелил в стакан и стал добавлять к нему концентрированный аммиак. Осторожно лил струйку аммиака, результат - шипение и густой белый дым/туман над раствором. Уксусная кислота дает с аммиаком меньшее количества белого дыма по сравнению с соляной кислотой, но белый дым также образуется. В растворе - пузырьки газа и локальное кипение. Жидкость временно стала "мутной", но не из-за образования твердой фазы, а из-за смешивания двух растворов с разными показателями преломления (подобное мы наблюдаем, если вылить глицерин в воду или воду - в спирт). Перемешал - образовался прозрачный, бесцветный раствор. Аккуратно понюхал раствор - запах аммиака не появился (значит, уксусная кислота еще в избытке). Продолжил добавлять аммиак, перемешивал. Шипение и локальное вскипание были уже менее интенсивные. Белый дым больше не выделялся. Наконец, реакционная смесь стала пахнуть аммиаком. Уксусная кислота полностью нейтрализована, аммиак - в избытке. Раствор - без признаков формирования осадка: не наблюдалось образование суспензии или появление опалесценции. Если бы в растворе был алюминий - выпал бы осадок гидроксида алюминия (нерастворимый в избытке аммиака), но осадок не образовался. Вывод: гидроксид алюминия не прореагировал с уксусной кислотой (от слова "совсем"). С другой стороны, из литературы известно, что эти два вещества реагируют, образуя основный ацетат алюминия. Необходимо провести новый эксперимент, в котором использовать свежеосажденный гидроксид алюминия. __________________________________________________ 1 См., например, J. M. Rousseaux, P. Weisbecker, H. Muhr, and E. Plasari - Aging of Precipitated Amorphous Alumina Gel //Ind. Eng. Chem. Res. 2002, 41, 24, 6059-6069 [link] 2 См. Тихонов В.Н. - Аналитическая химия алюминия (1971) [link] |

The precipitate of aluminum hydroxide was kept under water for a month |

|

An excess of glacial acetic was added to a small amount of the aluminium hydroxide |

|

|

|

|

Then the mixture was filtered |

|

|

|

|

|

An excess of concentrated ammonia was added to the filtered solution |

|

|

|

|

|

|

|

|

|

|

|

|

|

There is no precipitate. Therefore, aluminium hydroxide has not dissolved in glacial acetic acid (even partly) |

Phenolphthalein was added (to demonstrate that the solution is alkaline) |

|

Preparation and filtration of freshly precipitated aluminium hydroxide (reaction of ammonium alum with ammonia) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Freshly precipitated aluminium hydroxide and glacial acetic acid |

|

|

|

|

|

|

|

|

|

|

|

|

|

An aqueous solution of ammonia was added to the filtrate |

|

|

|

|

|

|

|

|

|

The white gelatinous precipitate of aluminium hydroxide was formed |
|
Кстати, в процессе поиска информации по ацетатам алюминия наткнулся на любопытную историю. Поскольку сайт, на котором она была размещена, у нас заблокирован, пришлось смотреть через прокси. Экзамен - школьные тесты по химии.
Вопрос: гидроксид алюминия и уксусная кислота: какие признаки реакции? Далее перечислялись варианты, из которых нужно было выбрать правильный. Те, кто выбрал, что осадок НЕ раствориться - получили минус, поскольку по мнению авторов задания должно было произойти растворение осадка гидроксида алюминия в уксусной кислоте. Химик, который обратил на все это внимание, возмущался: - Ведь гидроксид алюминия в уксусной кислоте не растворится! Один белый осадок превратиться в другой - неотличимый внешне! А по факту осадок гидроксида алюминия может почти раствориться в уксусной кислоте или вовсе не раствориться - в зависимости от условий. Т.е. вопрос не имеет однозначного (простого) ответа. Видимо, авторы теста об этом и не подозревали (азотная кислота, соляная... или уксусная - какая разница!?) - Апелляция? - Не предусмотрена. - Основные ацетаты алюминия ведь малорастворимы! - Ваши проблемы... Описанная ситуация имела место в другом государстве, которое прямо сейчас ведет против нас захватническую войну. Было бы смешно, только и в нашей стране умные люди... как бы это вежливо сказать... не в почете. |