Chemistry and Chemists № 3 2023
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2023 Journal of Chemists-Enthusiasts |
Natural water and chemical reagents (demonstration model of water treatment process) - p.1, 2 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Lake water, iron (III) chloride and calcium hydroxide - p.1
Recently in our journal, there was an article [1] regarding the interaction of iron (III) chloride with water: distilled and tap water, at room temperature and at boiling. This chemical is used to purify natural water so that it can be used for drinking purposes. Also, iron (III) chloride is used for the treatment of domestic/industrial wastewater.Tap water is good but has already been chemically treated. I decided to do similar experiments with the original (natural) water. The goal is to demonstrate a model of the water purification process - water treatment (namely, the physical and chemical process, and not its instrumentation in the industry). How did the idea come about? At first, for many days I looked at the coloured - yellow-brown water in the river Dnieper, which acquired such a colour in the spring - after passing through the Belarusian swamps. While I was looking, time passed and most of the coloured substances precipitated. The brown precipitate was visible at the bottom. I remember several women walking by: - Wow, how much iron is in the water! - Not at all: the iron precipitated. I said nothing but thought that it was not iron, these were organic substances that were dissolved/suspended in water, mainly humic and fulvic acids. Humic substances/humus [2] are the organic components of the soil, they are similar (in structure) to humic and fulvic acids in river water: all these substances forms as products of the partial decomposition of plants. In the past, when the Dnieper flooded the meadows in the spring, the organic matter settled from the water. As a result, the water was purified, and then receded, enriching the soil with organic matter necessary for forming fertile soil. Later a system of artificial reservoirs was built. The Dnipro no longer overflows in the spring. An organic matter sedimented to the bottom of the reservoirs, forming a layer of silt (which leads to shallowing and waterlogging). Nevertheless, it was nice that someone other than you was thinking about chemistry (even if the version with iron was wrong). Oh yes, iron ... We have a little of this reagent! What water should I use for the experiment? Well, I can wait until the water in the river Dnieper "blooms". An algal bloom is a rapid, massive growth of cyanobacteria, during this period the river water becomes green and nasty. Such water is a perfect object for experiments on water purification. But I can take some water from a nearby lake right now. This water is consistently rich in organic matter. Moreover, one does not interfere with the other. For the first experiment, I filled a 5-litre bottle with water from the local lake. I looked at the map - the lake was named Vira. I poured green-yellow water into a 5-litre glass jar, in which I experimented. 3 ml of a saturated solution of iron (III) chloride were added to the water. How much solution was needed? I did not know. You can search for this information in the textbooks and monographs on industrial chemistry, which provide examples of the design of water treatment processes, in particular, the consumption rates of coagulants (i.e., chloride or sulphate of iron (III) and/or aluminium) per unit volume of water. The fact is that this value depends both on the composition of a particular water (from a particular reservoir) and on the characteristics of the technological installation. The consumption of reagents can vary greatly even within the same water treatment plant, which takes water from the same reservoir. For example, when the water in the river "blooms", the consumption of reagents increases. Even now I remember how the teacher at lectures described to us the superphosphate production unit, the ammonia synthesis column, the sulfuric acid plant and so long. She gave us many figures: the exact values of temperature, concentration, consumption of reagents, holding time, column height, etc. Well, the fact is that with similar equipment in a neighbouring production workshop, the parameters can be completely different. Even the type of equipment can be different, and the plant itself may be far away... But these are details. She did not remember all these figures herself - the teacher read them from a piece of paper... Her main (real) goal was to fill the time of the lecture with something. And we have had many similar lections during studying in university. But let's return to the experiment. In other words, it made sense to conduct a "trial coagulation" [3]. I should have added iron (III) chloride to the lake water in small portions, mixed, and seen what had happened. Depending on the result, I should have reacted (to add more coagulant solution or not add). The purpose of this precaution was to prevent an excess of ferric chloride. The reality turned out to be different: I added all the prepared solution of ferric chloride at once. Perhaps because the goal was to conduct a demonstration experiment, and not develop a technology. Moreover, for another lake or the same lake, but at another time, the required amount of the reagent will be different. So, 3 ml of a saturated solution of iron (III) chloride were added to 5 litres of water from the lake. The bottom layer turned brown and lost its transparency; the top layer did not change (green-yellow). The liquid was stirred. The reaction mixture became brown and opaque at once: it was seen that a dispersed precipitate had formed in the mass. This is iron (III) hydroxide, together with organic matter, "heavy metals" and other contaminants that were sorbed on its particles. It remains to wait until the precipitate gathers in flakes. After a few minutes, flakes became visible in the solution, which floated, gradually settling. The flakes slowly precipitated, leaving behind an intensely coloured, albeit transparent brown solution. The essence of what is happening: the added iron (III) chloride reacted with carbonates and bicarbonates of natural water (in the general case, - alkaline reagents), and as a result, a flocculent precipitate of iron (III) hydroxide formed, which sedimented together with the adsorbed impurities (organic matter, "heavy metals" and most microorganisms - including those that are dangerous to humans). The fact is that ferric chloride remained in excess - natural basic compounds were NOT enough to neutralize it. To do this, water treatment plants should have laboratories: to analyse the source water and, based on its results, calculate the consumption rates of reagents. On the other hand, our goal is NOT to neutralize carbonates in natural water, but to purify it - to discolour/clarify the water from the lake. For this purpose, the formation of a sufficient mass of flakes of ferric (or aluminium) hydroxide is necessary. The flakes will gradually precipitate in the water, carrying pollution to the bottom. To form a precipitate of Fe(OH)3, you need a soluble iron salt and an alkaline reagent. At water treatment plants, no one relies on natural water carbonates - they add calcium hydroxide (lime) or sodium hydroxide. To begin with, I decided to use sodium bicarbonate (baking soda) as an alkaline reagent. I took a small portion of the brown solution from the jar and added a saturated soda solution to it, waited. There was no noticeable result. This portion of the solution I poured (down the sink), and took another portion of the brown solution. This time I added a saturated solution of sodium carbonate (washing soda). Flakes in the liquid or sediment at the bottom did not form, but turbidity appeared. I decided to use washing soda. I added 4 ml of saturated sodium carbonate solution to the jar with brown water and mixed the liquid. A slight turbidity appeared, but the solution remained dark brown. The sediment, which was previously at the bottom, first dispersed in the liquid (due to the stirring), and then the precipitate slowly settled. But later the precipitate gradually floated to the surface (due to the slow release of carbon dioxide bubbles). Thus, the addition of washing soda did not give a significant effect. If so, I will use lime, Ca(OH)2. I didn't even have technical lime at hand, but there was calcium carbide, which got damp in a leaky jar and completely turned into calcium hydroxide (lime). I weighed 3.8 g of calcium hydroxide, added water, and stirred vigorously to form a suspension, which was poured into the jar with brown water. Then I mixed the content. A brown suspension formed, from which large brown flakes began to settle rather quickly, and after their sedimentation, the water was not cloudy. The problem was that the colour of the water was yellow-brown. Lime was definitely in excess. The fact is that the solubility of lime in water is low: all the calcium hydroxide in the solution has reacted, and it takes time to transfer new portions of lime to the solution (from the solid particles in suspension). We need some time and intense mixing [4]. The suspension was stirred. Then again. This time, the flakes settled much more slowly, but now there was colourless water above the sediment (without any visible opalescence - it is not cloudy). The compaction of the sediment at the bottom (the decrease in its visual volume) was slow. I waited a day - the volume of sediment was still significant. In industry, to accelerate the settling of flakes of iron (III) or aluminium hydroxide, they use the so-called flocculants. The flocculants are long-chain soluble polymers that can adsorb simultaneously on two (several) solid particles, facilitating their sticking together. Examples of flocculants: polyacrylamide, silicic acid. Finally, a warning. We obtained clarified water that is NOT potable. Pathogenic microorganisms may remain in the water after coagulation treatment. Water for drinking purposes is disinfected by chlorine, ozone, hydrogen peroxide (on a small scale - by boiling, filtering through activated carbon), etc. And, of course, drinking water MUST be analytically controlled before use. Firstly, it should not contain an excess of any reagents that were used in water treatment (iron and aluminium salts, sodium hydroxide for example). Secondly, some impurities that may be in natural water cannot be removed by the coagulation method. For example, if the water in the lake were salty, it would remain so - after all described procedures. In this case, water desalination is needed. This process is also not complicated: there are several different methods, but this is a topic for a new article. |
|
Недавно в журнале была статья [1], посвященная взаимодействию хлорида железа (III) с водой: дистиллированной и водопроводной, при комнатной температуре и при кипячении. Данный реагент применяется для очистки природной воды, чтобы ее можно было использовать для питьевых целей, равно как и для очистки бытовых/промышленных стоков.
Вода из-под крана - это хорошо, но она уже прошла реагентную обработку. Решил провести аналогичные эксперименты с исходной - природной водой. Цель - продемонстрировать модель процесса очистки воды - водоподготовки (именно физико-химического процесса, а не его аппаратурного оформления в промышленности). Как появилась идея? Сначала много дней смотрел на окрашенную - желто-коричневую воду в р. Днепр, которая приобрела такой цвет весной - после белорусских болот. Пока смотрел - время шло и большинство окрашенных веществ выпало в осадок. Коричневый осадок было четко видно на дне. Помню рядом проходили несколько женщин: - Надо же, в воде сколько железа! - Ничего: оно осело. Промолчал, но подумал, что это не железо, а органические вещества, которые были растворены/взвешены в воде, преимущественно - гуминовые и фульвокислоты. Гумус [2] - органическая составляющая грунта тоже из этой оперы: продукты частичного разложения растений. Раньше, когда Днепр разливался и заливал луга, органические вещества из воды оседали, вода очищалась, а потом - отступала, обогащая грунт органикой, необходимой для формирования плодородной почвы. Теперь все это оседает на дне водохранилищ, формируя слой ила (что ведет к обмелению и заболачиванию). Тем не менее, было приятно, что кто-то кроме тебя думает про химию (пусть версия с железом и была неправильной). Ах да, железо... Этого реагента у нас немного есть! Вода для эксперимента? Можно подождать, пока вода в Днепре "зацветет" - станет зеленой и противной (массовый рост цианобактерий) - для опытов по очистке воды самое то. А можно - набрать воду в близлежащем озере - там она стабильно богатая органикой. И одно другому - не мешает. Для начала - набрал 5-л бутылку воды из озера. Посмотрел по карте - озеро Віра. Зелено-желтую воду перелил в 5-л банку, в которой и провел эксперимент. К воде добавил 3 мл насыщенного раствора хлорида железа (III). А сколько нужно? Неизвестно. Можно посмотреть учебники и монографии по химической технологии, в которых приводятся примеры оформления процессов водоподготовки, в частности, - нормы расхода коагулянтов (т.е., хлорида или сульфата железа (III) и/или алюминия) на единицу объема воды. Дело в том, что эта величина зависит, как от состава конкретной воды (из конкретного водоема), так и от особенностей технологической установки. Расход реагентов может сильно меняться даже в пределах одной станции водоподготовки, которая берет воду из одного и того же водоема. Например, когда вода в реке "зацветет", расход реагентов определенно придется увеличивать. Даже сейчас вспоминаю, как преподаватель на лекциях описывала нам установку получения суперфосфата, колонну синтеза аммиака, завод серной кислоты - с точным указанием температуры, концентрации, расхода реагентов, времени выдержки, высоты колонны и т.д. Ну а то, что на аналогичной установке в соседнем цеху параметры могут быть совсем другими - даже тип установки другим, а сам завод расположен в условном Ашхабаде - это уже детали. Она и сама их не помнила - с бумажки читала... Главное было чем-то заполнить время лекции. Другими словами, имело смысл провести "пробную коагуляцию" [3] - добавлять хлорид железа (III) в озерную воду небольшими порциями, перемешивать, смотреть, что будет. В зависимости от результата - реагировать (добавлять еще раствор коагулянта или не добавлять). Цель такой предосторожности - не допустить избытка хлорида трехвалентного железа. Не знаю, "какая муха меня укусила", но все приготовленное количество хлорида железа я добавил сразу. Возможно, потому что цель была провести демонстрационный эксперимент, а не разрабатывать технологию. Тем более, для другого озера или этого же озера, но в другое время, необходимое количество реагента будет другим. Итак, к 5 л воды из озера добавил 3 мл насыщенного раствора хлорид железа (III). Нижний слой окрасился в коричневый цвет и потерял прозрачность верхний слой - без изменений (зелено-желтый). Перемешал. Реакционная смесь стразу стала бурой и непрозрачной - было четко заметно, что в массе образовался дисперсный осадок. Это - гидроксид железа (III) вместе с органикой, "тяжелыми металлами" и другими загрязнениями, которые сорбировались на его частицах. Осталось ждать, пока осадок соберется в хлопья. Через несколько минут в растворе стали заметны хлопья, которые плавали, постепенно оседая. Хлопья медленно осели, после них остался интенсивно-окрашенный, хоть и прозрачный коричневый раствор. Суть происходящего: добавленный хлорид железа (III) прореагировал с карбонатами и гидрокарбонатами природной воды (в общем случае - щелочными реагентами), при этом образовался хлопьеобразный осадок гидроксида железа (III), который осел, увлекая за собой сорбированную органику, "тяжелые металлы", большинство микроорганизмов (в т.ч., и опасные для человека). Дело в том, что хлорид трехвалентного железа остался в избытке - природных основных реагентов НЕ хватило, чтобы его нейтрализовать. Для этого на станциях водоподготовки и должны быть лаборатории: чтобы проводить анализ исходной воды и по его результатам рассчитывать нормы расхода реагентов. С другой стороны, наша цель - НЕ нейтрализовать карбонаты в природной воде, а провести ее очистку - обесцветить / осветлить воду из озера. А для этого необходимо, чтобы в воде образовалось достаточное количество хлопьев гидроксида трехвалентного железа (или алюминия), которые, оседая, увлекут за собой загрязнения на дно. Чтобы образовался осадок Fe(OH)3, нужна растворимая соль железа и щелочной реагент. На станциях водоподготовки на природные карбонаты воды никто не полагается - добавляют гидроксид кальция (известь) или гидроксид натрия. Для начала решил использовать в качестве щелочного реагента гидрокарбонат натрия - питьевую соду. Отобрал небольшую порцию коричневого раствора из банки - добавил насыщенный раствор соды, подождал. Заметного результат не было. Вылил (в раковину), отобрал другую порцию коричневого раствора - добавил насыщенный раствор карбоната натрия (стиральная сода). Хлопьев в жидкости или осадка на дне не сформировалось, но появилась муть. Решился использовать стиральную соду. Добавил 4 мл насыщенного раствора карбоната натрия в банку с нашей водой, перемешал. Появилась легкая муть, но раствор так и остался коричневым. Осадок, который (до этого) был на дне, сначала диспергировался в жидкости, потом - медленно осел. Затем при стоянии - постепенно всплыл. Всплытие осадка можно объяснить медленным выделением пузырьков углекислого газа. Таким образом, добавление соды не дало значительного эффекта. Раз так - известь, Ca(OH)2. Даже технической извести у меня под рукой не было, зато был карбид кальция, который отсырел в негерметичной банке и полностью перешел в гидроксид кальция - известь. Взвесил 3.8 г гидроксида кальция, добавил воды, интенсивно перемешал, чтобы образовалась суспензия - вылил в банку с бурой водой. Перемешал содержимое. Образовалась бурая суспензия, из которой довольно быстро стали оседать крупные бурые холопья, причем после их седиментации вода была не мутной. Проблема в том, что цвет воды был желто-коричневым. Известь - определенно в избытке. Дело в том, что растворимость извести в воде низкая: весь гидроксид кальция в растворе прореагировал, а для перехода в раствор новых порций извести (из твердых частиц - суспензия) нужно время. Время и интенсивное перемешивание [4]. Хорошо перемешал. Потом еще. В этот раз хлопья оседали гораздо медленнее, зато над осадком теперь была бесцветная вода без видимой опалесценции (не мутная). Уплотнение осадка на дне (уменьшение его визуального объема) происходило медленно. Подождал сутки - объем осадка был все еще значительный. В промышленности для ускорения оседания хлопьев гидроксида железа (III) или алюминия используют т.н. флокулянты: растворимые полимеры с длинной цепью, которые способны сорбироваться одновременно на двух (нескольких) твердых частицах, облегчая их слипание. Примеры флокулянтов: полиакриламид, кремниевая кислота. В заключение - предупреждение. Мы получили т.е. осветленную воду, которая НЕ ЯВЛЯЕТСЯ питьевой. В воде после очисткой коагуляцией еще могут оставаться болезнетворные микроорганизмы. Воду для питьевых целей обеззараживают действием хлора, озона, перекиси водорода (в небольших масштабах - кипячением, пропусканием сквозь активированный уголь) и т.д. И, разумеется, питьевая вода ДОЛЖНА проходить аналитический контроль перед ее употреблением. Во-первых, в ней не должно остаться избытка некоторых реагентов, которые использовались при водоподготовке (соли железа и алюминия, например). Во-вторых, далеко не все примеси, которые могут быть в природной воде, можно удалить описанным методом коагуляции. Например, если бы вода в озере была соленная, таковой она и останется - после всех описанных процедур. В данном случае нужно обессоливание (опреснение) воды - тоже ничего сложного, но это уже тема для другой статьи. |

Vira Lake |
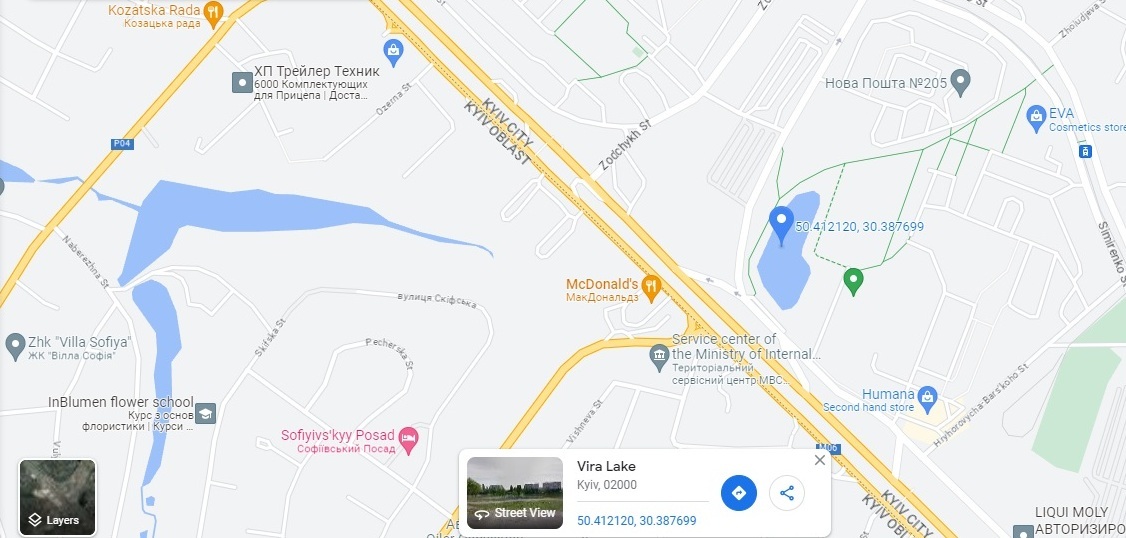
Vira Lake (on map) |

Lake water, iron (III) chloride and calcium hydroxide - a demonstration model of the water treatment process |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
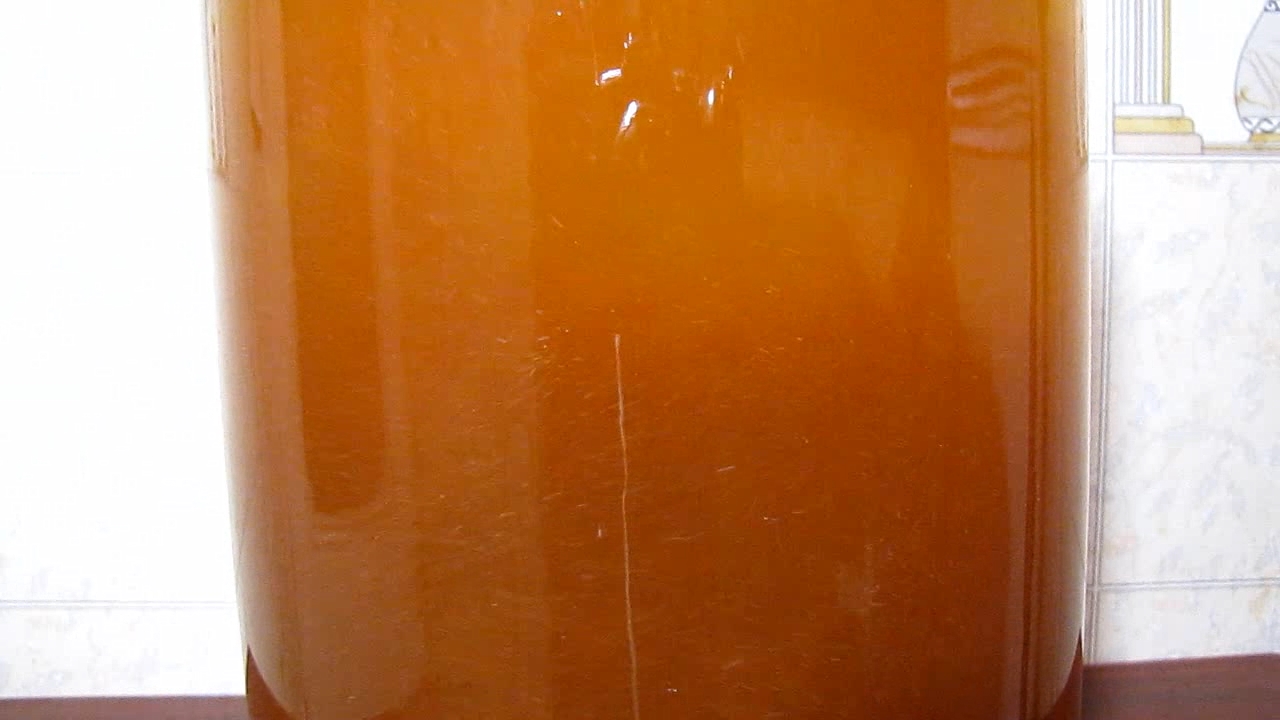
|

|

|

|

|

|

|

|

|

|

|

|
|
__________________________________________________
1 See the article: Iron chloride (III) and water / Хлорид железа (III) и вода [link] 2 Please, do not confuse it with an "office humus" / Не путайте с "гумусом кабинетным". 3 After writing the article, I learned that "trial coagulation" at water treatment plants is called "jar test". It turns out that I am not the only one who uses ordinary glass jars for chemical experiments... Wow! ***** Уже после написания статьи узнал, что "пробную коагуляцию" на станциях водоподготовки называют "Jar test" - "Баночный тест". Оказывается, не один я использую для химических экспериментов банки - надо же... 
Jar test for coagulation 4 Pay attention, baking soda was earlier added (I did this, not knowing, it wouldn't discolour the liquid). Sodium carbonate can react with calcium hydroxide, forming a calcium carbonate precipitate and a sodium hydroxide solution: Na2CO3 + Ca(OH)2 <=> CaCO3 + 2NaOH But caustic soda (sodium hydroxide) also precipitates iron(III) from the solution - let's not complicate things. **** Кроме того, ранее я добавил соду (не зная, что она не осветлит жидкость). Kарбонат натрия может дать с гидроксидом кальция осадок карбоната кальция и раствор гидроксида натрия: Na2CO3 + Ca(OH)2 <=> CaCO3 + 2NaOH Но едкий натр также осаждает трехвалентное железо из раствора - не будем все усложнять. |
|
Lake water and iron (III) chloride - pt.2
Let's continue experiments with polluted lake water, our goal is to purify it.Last time we treated the water from the lake with ferric chloride, and then its excess was precipitated with lime. The experiment was successful, but I carried it out too roughly: the entire amount of iron (III) chloride solution was added at once. An excess of the coagulant immediately formed in the reaction mixture: we could only observe the effect of iron (III) chloride excess on lake water. But it is interesting to observe the intermediate stages of interaction (when the minimum amount of the coagulant was added, more coagulant was added, the optimal amount was added, etc.) Ferric chloride should be added gradually. This procedure will allow us to observe the changes that occur during a gradual increase in the concentration of the coagulant. And most importantly, the addition of excess FeCl3 can be prevented in this way. Although the lake is not so close, going for a new water sample is not like climbing Everest: it can be done. However, I had about 500 ml of the previous sample left, so I decided Last time I took about 5 litres of water, this time I plan to use 200 ml, which is 25 times less. Last time I added 3 ml of saturated ferric chloride solution, now I need: 3/25 = 0.12 ml, even less, because 3 ml was already an excess of the coagulant. I have micropipettes, but you can do it easier: dilute the initial solution - then there will be a multiple less substance per unit volume of the solution. I refused to accurately measure the volume: I took a drop of the initial saturated solution of iron (III) chloride and added 1 ml of distilled water, mixed. 1 drop is approximately 0.04 ml; or 25 drops = 1 ml. Therefore, we diluted the original solution of iron (III) chloride by approximately 25 times. 200 ml of green-yellow lake water were poured into a glass [5], and diluted FeCl3 solution was added drop by drop. When the first drop was added and the liquid was mixed, there was no visible effect. Then the next two drops were added and the liquid was mixed, as a result, the colour of the solution intensified. After the sixth drop, turbidity appeared, and flakes became noticeable in the liquid. After the seventh and eighth drops of iron (III) chloride, the solution turned brown and cloudy, and the formation of flakes became intensive. All the prepared amount of iron (III) chloride was gradually added. There were 15 drops (not 25 + 1), i.e. in our case, the average droplet size was more than 0.04 ml. Large greenish-brown flakes formed, which quickly settled to the bottom, the water above the sediment was clear and colourless. The formal result has been achieved: we have obtained clarified water - even without the addition of lime. Nevertheless, I decided to experiment further. 1 drop of a saturated (undiluted) solution of iron (III) chloride was added to the water, and the liquid was mixed. After settling of flakes, the solution became green-yellow. Then another 2 drops of iron (III) chloride were added and the mixture was stirred - the result became worse: the solution acquired an intense colour the liquid remained cloudy (a finer suspension was formed, which settles much more slowly). Then a suspension of calcium hydroxide was added, and as a result, the liquid turned into an intense brown suspension ("rusty water"), which did not settle for a long time. As you can see, an excess of a "purifying" reagent is not always good. Sometimes it cannot be eliminated by simple methods. A "jar test" is used at water treatment plants (and wastewater treatment plants) for a reason. __________________________________________________ 5 When I poured the initial lake water into a glass, a few solid particles settled to the bottom. At the time of water sampling (from the lake), there were no visually visible solid particles in the liquid. But after a day, a small amount of sediment appeared. Then I did not attach importance to solid particles, later it turned out that this is important. But I won't get ahead of myself. |
|
Продолжим эксперименты с загрязненной озерной водой, точнее - с попытками ее очистить.
В прошлый раз мы подействовали на воду из озера хлоридом трехвалентного железа, затем его избыток осадили известью. Эксперимент получился, но провел его я слишком грубо: все количество раствора хлорида железа (III) было добавлено сразу. В реакционной смеси моментально образовался избыток коагулянта: мы могли наблюдать только результат действия избытка хлорида железа (III) на озерную воду, но не промежуточные стадии взаимодействия (добавлено минимальное количество коагулянта, добавлено больше коагулянта, добавлено оптимальное количество и т.д.) Хлорид трехвалентного железа следует добавлять постепенно, что позволит наблюдать за изменениями, которые происходят при плавном нарастании концентрации коагулянта. А главное - таким способом можно не допустить добавления избытка FeCl3. Хотя озеро расположено не так и близко, поехать за новой пробой воды - не на Эверест подняться: это сделать можно. Однако у меня осталось примерно 500 мл предыдущей пробы - решил В прошлый раз я взял примерно 5 л воды, в этот раз - планирую 200 мл, т.е. в 25 раз меньше. В прошлый раз я добавил 3 мл насыщенного раствора хлорида трехвалентного железа, в этот раз нужно: 3/25 = 0.12 мл, точнее - еще меньше, т.к. 3 мл - уже избыток коагулянта. Микропипетки у меня есть, но можно поступить проще: развести исходный раствор - тогда в единице объема раствора будет кратно меньше вещества. От точного измерения объема отказался: взял каплю исходного насыщенного раствора хлорида железа (III) - добавил 1 мл дистиллированной воды, перемешал. 1 капля - примерно 0.04 мл или 25 капель = 1 мл. Т.е. мы развели исходный раствор хлорида железа (III) приблизительно в 25 раз. 200 мл зелено-желтой озерной воды налил в стакан [5], стал по капле прибавлять разведенный раствор FeCl3. Добавил первую каплю, перемешал - внешнего эффекта не было. Потом - еще две капли, перемешал, цвет раствора усилился. После шестой капли появилась муть, в жидкости стали заметны хлопья. После седьмой и восьмой капли хлорида железа (III) раствор стал коричневым и мутным, образование хлопьев стало активным. Постепенно добавил все приготовленное количество хлорида железа (III). Капель оказалось 15 (а не 25 + 1), т.е. в нашем случае средний размер капли был больше, чем 0.04 мл. Образовались крупные зеленовато-бурые хлопья, которые быстро осели на дно, вода над осадком - прозрачная и бесцветная. Формальный результат достигнут: мы получили осветленную воды - даже без добавления извести. Тем не менее, решил поэкспериментировать дальше - добавил в воду 1 каплю насыщенного (неразведенного) раствора хлорида железа (III), перемешал. После оседания хлопьев раствор стал зелено-желтый. Еще 2 капли хлорида железа (III) и перемешивание - стало хуже: раствор не только приобрел интенсивный цвет, но после оседания хлопьев жидкость осталась мутной (т.е., образовалась более тонкая суспензия, которая гораздо медленнее оседает). Добавил известковое молоко (суспензию гидроксида кальция) - получил интенсивно-коричневую суспензию ("ржавая вода"), которая долго не оседала. Как видите, избыток "очищающего" реагента - не всегда хорошо и не всегда его можно простыми методами устранить. "Баночный тест" ("jar test") делают на станциях водоподготовки (и на очистных станциях стоков) не просто так. __________________________________________________ 5 Когда налил воду в стакан, на дно осело несколько твердых частиц. На момент отбора пробы воды из озера взвешенных твердых частиц в жидкости не было (частиц, визуально заметных глазом). Но через сутки небольшое количество осадка появилось. Тогда я не придал твердым частицам значения, позже оказалось, что это важно. Но не буду забегать наперед. |

Vira Lake |

Vira Lake (on map) |

Lake water and iron (III) chloride |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|