Chemistry and Chemists № 3 2023
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2023 Journal of Chemists-Enthusiasts |
Natural water and chemical reagents (demonstration model of water treatment process) - p.8, 9, 10 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Lake water and copper sulfate - p.8
The main goal of this series of experiments was to model the industrial water purification process. So, iron (III) chloride and aluminium sulfate were applied for this purpose (in a kitchen  ). Iron (III) and aluminium salts (as well as their mixtures) are common reagents for the industrial treatment of natural water and wastewater by coagulation. These experiments succeeded. ). Iron (III) and aluminium salts (as well as their mixtures) are common reagents for the industrial treatment of natural water and wastewater by coagulation. These experiments succeeded. Also, in the experiments with the lake water, I used some chemical compounds that usually are not applied for water treatment (at least directly). These reagents were water glass (the solution of sodium and potassium silicates), sodium chloride, potassium hydroxide and nitric acid. Alas, the result of such experiments was not satisfactory. Therefore, I should try to use other salts of polyvalent metals as coagulants for natural water (except iron (III) chloride and aluminium sulfate). I had copper (II) sulfate, also known as blue vitriol, on hand. Copper salts are not used for the purification of drinking water. Firstly, they are expensive, and secondly, solutions of copper salts cause corrosion of steel equipment. However, the main reason is different. In small quantities, copper is an important chemical element which is necessary for all living organisms: humans, animals and plants. But in significant amounts, this metal is toxic to humans and other organisms. Copper belongs to a group of chemical elements that doctors call "heavy metals." The definition of "heavy metals" is not completely correct, which is why it has taken root. In any case, it makes sense to experiment with the act of copper sulfate on contaminated natural water exclusively out of curiosity. It is unlikely that its results can have practical application. A saturated solution of copper (II) sulfate was prepared. I took a new sample of water from the lake. It was greenish-yellow water, initially cloudy. When the sample stood in the jar, a precipitate formed, and the turbidity disappeared. For the experiment, I used water decanted from the sediment. 250 ml of lake water were poured into a glass. Two drops of the saturated copper sulfate solution were added, and the solution was stirred. No visible changes were observed. Then, other four drops of copper sulfate were added, and the liquid was stirred. After a few seconds, the solution turned greenish and very cloudy. After a few minutes, green flakes appeared. The flakes floated in the solution, grew and gradually settled. A green precipitate formed, and the liquid above the precipitate became colourless, but was cloudy: the smallest particles formed a suspension. After a few hours, the turbidity completely disappeared: all solid particles settled to the bottom. Clear and colourless water remained. When iron (III) or aluminium salts react with alkaline compounds contained in natural water, flakes of iron (III) or aluminium hydroxides form. What chemical compound was formed in the case of copper (II) sulfate? I suggested that the precipitate was basic copper (II) carbonate xCu(OH)2·yCuCO3. This compound is formed by the interaction of copper (II) salts with sodium carbonate or bicarbonate. The substance is a green powder and is an analogue of the natural mineral malachite. How do you identify the presence of carbonates? When strong acids are added to carbonates, carbon dioxide bubbles are released. I drained most of the water from the green sediment, added nitric acid, and stirred. The precipitate quickly dissolved, and a yellow solution formed. However, no gas bubbles were observed. Therefore, no carbonate anion was detected in the sediment. What kind of sediment is this? I don't know. Possibly, it is basic copper sulfate. Pay attention to the interesting fact. When the acid was added, the precipitate dissolved. As a result, not only copper passed into the solution, but coloured impurities adsorbed by the precipitate were also dissolved. Unfortunately, I did not film this part of the experiment. It makes sense to repeat. How? I will obtain the new precipitate by adding a coagulant to the lake water. Then, I will add nitric acid to this sediment. But this time, the coagulant should not contain coloured cations such as Cu(II) or Fe(III). A logical option is Al(III). |
|
Основной целью данной серии экспериментов было моделирование процесса очистки воды в промышленности (в условиях кухни
 ). Таким образом, для обработки воды я использовал хлорид железа (III) и сульфат алюминия. Технические соли железа (III) и алюминия (а также - их смеси) являются распространенными реагентами для очистки природной и сточной воды методом коагуляции. В результате эксперименты получились. ). Таким образом, для обработки воды я использовал хлорид железа (III) и сульфат алюминия. Технические соли железа (III) и алюминия (а также - их смеси) являются распространенными реагентами для очистки природной и сточной воды методом коагуляции. В результате эксперименты получились. Также для экспериментов использовал несколько веществ, которые обычно не применяются для очистки воды (по крайней мере - непосредственно), а именно: жидкое стекло (раствор силикатов натрия и калия), хлорид натрия, гидроксид калия и азотную кислоту. Перечисленные реактивы я добавлял к воде из озера. К сожалению, результат таких экспериментов был неудовлетворительным. Значит, кроме хлорида железа (III) и сульфата алюминия следует попробовать другие соли поливалентных металлов в качестве коагулянтов для природной воды. Под рукой был сульфат меди (II), он же - медный купорос. Соли меди для очистки питьевой воды не применяются. Во-первых, они дорогие, во-вторых, растворы солей меди вызывают коррозию стального оборудования. Но главная причина другая. В небольших количествах медь - важный микроэлемент, необходимый для всего живого: человека, животных и растений. Но в значительных количествах медь токсична для людей, равно, как и для других живых организмов. Медь относится к группе химических элементов, которую медики называют "тяжелые металлы". Определение "тяжелые металлы" не совсем корректно, именно поэтому оно и прижилось. В любом случае, эксперимент по действию сульфата меди на загрязненную природную воду имеет смысл проводить только ради любопытства. Вряд ли его результаты могут иметь практическое применение. Приготовил насыщенный раствор сульфата меди (II). Отобрал новый образец воды из озера. Зеленовато-желтая вода, первоначально - мутная. При стоянии в банке выпал осадок, муть исчезла. Для эксперимента использовал воду, декантированную с осадка. Налил в стакан 250 мл воды из озера. Добавил две капли насыщенного раствора сульфата меди, перемешал. Видимых изменений не наблюдалось. Добавил еще 4 капли сульфата меди, перемешал. Через несколько секунд раствор стал зеленоватым и сильно мутным. Через несколько минут появились зеленые хлопья. Хлопья плавали в растворе, росли и постепенно оседали. Выпал зеленый осадок, жидкость над осадком обесцветилась, но была мутной: мельчайшие частички образовали суспензию. Через несколько часов муть полностью исчезла: все твердые частицы осели на дно. Осталась прозрачная и бесцветная вода. В случае солей железа (III) и алюминия при взаимодействии со щелочными реагентами, которые содержатся в природной воде, образовывались хлопья гидроксида железа (III) и алюминия. Какое соединение образовалось в случае сульфата меди (II)? Я предположил, что осадок - основный карбонат меди (II) xCu(OH)2·yCuCO3. Именно это соединение образуется при взаимодействии солей меди (II) с карбонатом или гидрокарбонатом натрия. Вещество представляет собой зеленый порошок и является аналогом природного минерала малахита. Как обнаружить карбонаты? При добавлении к карбонатам сильных кислот выделяются пузырьки углекислого газа. Слил большую часть воды с зеленого осадка, добавил азотную кислоту, перемешал. Осадок быстро растворился, образовался желтый раствор. Однако, выделение пузырьков газа не наблюдалось. Анион карбоната в осадке не обнаружен. Что это за осадок - я не знаю. Возможно, - основный сульфат меди. Обратите внимание на факт: когда мы подействовали кислотой на осадок, - в раствор перешла не только медь, но и адсорбированные осадком окрашенные примеси. К сожалению, эту часть эксперимента я не заснял на видео. Имеет смысл еще раз повторить эксперимент. Сначала получить осадок действием коагулянта на природную воду, затем добавить к осадку кислоту. Причем в этот раз осаждение провести без использования окрашенных катионов - таких, как Cu(II) или Fe(III). Логичный вариант - Al(III). |

Lake water and copper sulfate |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Что ж, продолжим эксперименты.
Текущая цель - исследовать осадок, который образуется при действии коагулянтов на природную воду. Сначала необходимо получить новый осадок путем добавления раствора коагулянта к образцу воды из озера. В качестве коагулянта целесообразно использовать соли алюминия (поскольку катион Al(III) бесцветен). После этого следует подействовать на осадок азотной кислотой (или другой сильной кислотой). Приготовил раствор коагулянта: 2 г сульфата алюминия растворил в 20 мл воды. Раствор оставлял на несколько часов, в результате нерастворимые твердые частицы выпадали в осадок, после чего прозрачную жидкость отбирал пипеткой. Налил в стакан 250 мл воды из озера. Добавил 2 мл раствора сульфата алюминия. Жидкость перемешивал. В результате раствор помутнел, а через несколько минут появились хлопья гидроксида алюминия. Хлопья плавали, постепенно оседая. Выпал светло-коричневый осадок. Через несколько часов жидкость над осадком стала полностью прозрачной. Большую часть жидкости осторожно декантировал с осадка. Затем осадок и оставшийся раствор перемешивал. Суспензию перелил в другой стакан и оставлял отстаиваться. В результате выпал коричневый осадок, а раствор стал прозрачным и бесцветным. Общий объем составлял примерно 30 мл (жидкость и осадок). К осадку по каплям добавил концентрированную азотную кислоту. Смесь перемешивал. В результате осадок растворился, раствор стал желтым и слегка мутным. Желтый цвет раствора был значительно интенсивнее, чем цвет исходной пробы воды. Таким образом, имело место концентрирование растворенных в природной воде веществ. |

Lake water, aluminium sulfate and nitric acid |

Aluminium sulfate was added |

|

|

|

|

|

|

|

|

|

|

|

|

|

Nitric acid was added |

|

|

|

|
|
Method of coprecipitation - p.10
What was the essence of the last experiment? What processes that are significant for science and practice have we modelled?To answer the question, we will have to move away from the topic of water purification into a completely different area. But it's worth it - the topic is very interesting. What woman at the beginning of the 20th century did not dream of cosmetics with radium? Many people dreamed of powdering their faces with radium phosphor to glow with joy in the dark. Let's tell everything in order. Compounds dissolved in natural water (as well as colloids) were precipitated together with aluminium hydroxide. As a result, we received purified water. Similar processes are used in industrial water treatment and wastewater treatment plants (as has been repeatedly said above). However, in addition to clarified water, we also obtained the sediment (this precipitate is called "sludge" in the industry). In industry, the sludge that remains after water treatment is waste. But we should pay attention to this precipitate. The precipitate was separated from the solution and dissolved in a small volume of nitric acid. As a result, we concentrated the organic substances dissolved in water without evaporating the liquid when heated. Heating leads to the decomposition of many organic substances (and not only organic ones), so it is not always acceptable. Of course, you can evaporate the solution without heating (or with moderate heating). For example, a rotary evaporator (rotavap) is designed for such purposes. Unfortunately, this method is applicable if the solute concentration is not too low. Otherwise, you will have to evaporate tons of solvent to get milligrams of the substance. We also should mention that other substances may be in the solution in much larger quantities. Thus, they will precipitate during evaporation. When it is necessary to isolate a small amount of a substance from a large volume of a solution. Which method should be used? There are several options for solving this problem [1]. One of them is the coprecipitation method (co-precipitation, CPT). Coprecipitation is based on the simultaneous precipitation of two (several) substances from a solution at once: the target substance and the "carrier substance" (the "collector"). Why do you need a carrier? Why to complicate things? The coprecipitation method should be used in cases where the substance is soluble and does not precipitate (under these conditions). In other words, if the target compound is difficult (or impractical) to precipitate in the pure form, it is coprecipitated with another substance. This substance precipitates (without problems) and, at the same time, carries down the target compound with it. In our case, coprecipitation of organic substances with aluminium hydroxide took place. And in the previous parts of the article, we also did coprecipitation using iron hydroxide. That is, the target product (or, in our case, impurities) is precipitated from the solution together with a solid carrier (a collector). The substance-carrier is formed as a result of a reaction in solution. Then, the carrier precipitated, carrying down the target substance with the precipitate. Coprecipitation mechanisms can be different: adsorption on the surface, isomorphic substitution, and mechanical occlusion (we will not dwell on them). Coprecipitation is used not only for industrial water purification but also in many other areas, in particular, in analytical chemistry, in biochemistry, in the synthesis of ferromagnetic materials, and in hydrometallurgy. But in some cases, coprecipitation creates problems, for example, in analytical chemistry, especially in gravimetric analysis. In gravimetric analysis, it is necessary to obtain as pure precipitate as possible for the analysis results to be reliable. It is necessary to obtain as pure precipitate as possible to gain reliable results of gravimetric analysis. As a result of coprecipitation, foreign ions (and molecules) are introduced to the precipitate, and this factor distorts (overestimates) the data of analysis. One practical application of coprecipitation is the separation of valuable components from a very dilute solution. Let's see an example from history. This is how the spouses Marie and Pierre Curie discovered and isolated radium for the first time. It all started with uranium ore. Uranium compounds found practical applications long before the discovery of radioactivity. Alas, this application was limited: dishes with uranium glaze and art items made of uranium glass (by the way, collectors still value them). Uranium was a by-product of silver mines in what is now the Czech Republic. The Curies began studying a sample of uranium ore from this deposit. They found that after separating the uranium using a sulfuric acid solution, the remaining minerals were still radioactive. As a result, the new radioactive element polonium was discovered, and then radium. The isolation of polonium did not work out, so scientists focused on radium. Extraction of uranium from ore in industry is carried out mainly by hydrometallurgy. Natural uranium is "not just uranium" - it contains a whole series of decay products (the radioactive series of uranium-238 and uranium-235), and some of these decay products are much more radioactive than pure uranium. Radium is one of these excellent products (no irony). Even trace amounts of radium in uranium ores have higher activity than uranium. Radium is a chemical analogue of barium. In addition to a tiny amount of radium, the ore contains a much higher amount of barium (and, if it does not, barium is added during the radium production process). To isolate radium, the Curies used waste from the industrial processing of uranium ore. Uranium is contained in the ore as the mineral uranite (pitchblende). The formula of this mineral is UO2 (or U3O8). During uranium ore processing, uranium is extracted by sulfuric acid treatment. As a result, barium forms the very poorly soluble sulfate BaSO4, carrying radium with it. In other words, trace amounts of radium coprecipitate with large numbers of barium atoms, forming barium-radium sulfate (Ba,Ra)SO4. Radium atoms isomorphically substitute barium in the crystal lattice. (Do you remember barium is an analogue of radium?) So, barium sulfate acts as a collector for radium. Without barium, such trace amounts of radium could remain in solution. Although the solubility of radium sulfate is extremely low, absolutely insoluble substances do not exist. Moreover, even if a precipitate of pure RaSO4 occurs, its volume will be negligible. Such precipitate is spread over the walls of the equipment (without the possibility of separation). A minute amount of radium precipitates out of the solution along with a large amount of barium. To remove impurities, the precipitate was boiled with sodium hydroxide, and then treated with hydrochloric acid. This allowed barium and radium to be separated from some other components. Then, the precipitate of barium-radium sulfate (Ba,Ra)SO4 was converted to carbonate by boiling with a soda solution: (Ba,Ra)SO4 + Na2CO3 = (Ba,Ra)CO3 + Na2SO4 The chloride was obtained from the carbonate by treatment with hydrochloric acid. Then, some impurities were removed by precipitation with hydrogen sulfide. The purified chloride was again converted to sulfate - i.e., the reprecipitated of barium and radium sulfate (Ba,Ra)SO4 was conducted. The mixed sulfate was again converted into the carbonate, and the carbonate into the mixed chloride. As a result of the hard work, barium chloride with a small amount of radium (Ba,Ra)Cl2 was obtained. After this, a long and very labour-intensive separation of radium and barium was carried out using the method of fractional crystallization. The method is based on repeated dissolution and precipitation of the mixture of chlorides (or better yet, bromides) of radium and barium. In this case, radium is concentrated in the solid phase (due to the lower solubility of the salts), and barium is concentrated in the solution. This is how Marie and Pierre Curie first isolated radium. To obtain 90 mg of pure radium chloride RaCl2, it was necessary to use 1 ton of uranium ore processing waste. In total, about 10,000 recrystallizations were carried out. Let's return to natural water. A close friend used to study the migration of metals in natural waters. In particular, their scientific group studied the distribution of metals between different fractions of organic substances in natural water. They used the freezing method to concentrate water: a flask with water rotated in a container with a cooling mixture (ice - sodium chloride). As a result, part of the water froze (up to 9/10), while the other part remained liquid. The dissolved substances remained in the liquid phase and concentrated; at the same time, pure water transformed into the solid phase. The unfrozen water was taken for scientific study, and Ice was thrown away. At that time, rotary evaporators were rare in our country. Fortunately, the described method completely replaced them in this investigation. Freezing technology can be utilised to purify drinking water at home [2]. This is how "already purified" drinking water is purified if doubts arise about its purity. Place a bottle of water in the freezer so that the water is only partially frozen. Then, the water that remains liquid (not frozen) is removed it contains concentrated impurities; the ice is washed and melted and used as drinking water and for cooking. Of course, if there are any pathogenic microorganisms in the water, freezing will not remove them. By the way, this method (of drinking water purification) is the opposite of the laboratory procedure described above (where the ice is removed and unfrozen water is used). A similar technology can be also used in wastewater treatment. When wastewater partially freezes, it forms a cleaner ice that can be removed. The remaining wastewater becomes more concentrated. __________________________________________________ 1 There are other methods for isolating substances from a large volume of dilute solutions, for example, adsorption, ion exchange (a special case of sorption), and liquid extraction. 2 Unfortunately, there is a lot of pseudoscientific speculation and falsification around this method. The method does work, but you should not expect miraculous results from freezing technology. |
|
Метод соосаждения - ч.10
В чем была суть прошлого эксперимента? Какие значимые для науки и практики процессы мы смоделировали?Для ответа на вопрос нам придется уйти от темы очистки воды совсем в другую область. Но оно того стоит - тема очень интересная. Какая женщина в начале 20 века не мечтала о косметике с радием? Или намазать себя краской радиевым люминофором и светиться в темноте от счастья? Теперь все по порядку. Растворенные в природной воде вещества (а также - коллоиды) были осаждены вместе с гидроксидом алюминия. В результате мы получили осветленную воду. Именно так поступают на промышленных станциях водоподготовки и очистки сточной воды (как было неоднократно сказано выше). Однако, кроме осветленной воды мы получили также осадок (который в промышленности называют "шлам"). В промышленности шлам, который остался после водоочистки - отход. Но нам стоит обратить на этот осадок внимание. Осадок был отделен от раствора и растворен в небольшом объеме азотной кислоты. В результате мы сконцентрировали растворенные в воде органические вещества без упаривания жидкости при нагревании. Нагревание ведет к разложению многих органических веществ (и не только органических), поэтому не всегда допустимо. Разумеется, можно упарить раствор и без нагревания (или с умеренным нагреванием), например, для таких целей предназначен ротационный испаритель. К сожалению, данный метод применим только если концентрация растворенного вещества не является слишком низкой. Иначе придется испарить тонны растворителя, чтобы получить миллиграммы вещества (не говоря уже о том, что в растворе наверняка есть и другие вещества, причем в гораздо большем количестве, и при упаривании они будут осаждаться). Необходимо выделить небольшое количество вещества из большого объема раствора. Какой метод использовать? Вариантов решения данной проблемы несколько [1]. Один из них - метод соосаждения (совместного осаждения). Соосаждение основано на одновременном осаждении сразу двух (нескольких) веществ из раствора: целевого вещества и "вещества-носителя" (другое название - коллектор). А зачем нужен носитель? Зачем все усложнять? Метод соосаждения приходится использовать в случаях, когда вещество в данных условиях растворимо и само по себе не осаждается. Другими словами, если целевое вещество трудно (или нецелесообразно) осаждать в индивидуальном виде, его осаждают вместе с другим веществом, которое осаждается без проблем само и при этом увлекает за собой целевое вещество. В нашем случае имело место соосаждение органических веществ с гидроксидом алюминия. А в прошлых частях статьи мы также делали соосаждение с использованием гидроксидом железа. Т.е., целевой продукт (или в нашем случае - примесей) осаждают из раствора вместе с твердым носителем (коллектором). Вещество-носитель образуется в результате реакции в растворе. Потом носитель осаждается, увлекая за собой целевое вещество. Механизмы соосаждения могут быть разными: сорбция на поверхности, изоморфное замещение, механическая окклюзия (не будем на них останавливаться). Соосаждение используется не только для промышленной очистки воды, но и в целом ряде других областей. В частности: в аналитической химии, в биохимии, в синтезе ферромагнитных материалов, в гидрометаллургии. В некоторых случаях соосаждение, наоборот, создает проблемы. Например, в аналитической химии, особенно - в гравиметрическом анализе. При гравиметрическом анализе необходимо получить максимально чистый осадок, чтобы результаты анализа были достоверными. В результате соосаждения в осадок попадают посторонние ионы (и молекулы), а этот фактор искажает (завышает) результаты. Одно из практических применений соосаждения - выделение ценных компонентов из очень разбавленного раствора. Приведу пример из истории. Именно так супруги Мария и Пьер Кюри открыли и впервые выделили радий. Все началось с урановой руды. Соединения урана нашли практическое применение задолго до открытия явления радиоактивности. Увы, применение это было ограниченным: посуда с урановой глазурью и художественные изделия из уранового стекла (кстати, коллекционеры их ценят до сих пор). Уран был побочным продуктом серебряных рудников на территории современной Чехии. Исследованием образца урановой руды именно из этого месторождения и занялись супруги Кюри. Они обнаружили, что после отделения урана с помощью раствора серной кислоты остатки минерала все еще были радиоактивны. Так был открыт новый радиоактивный элемент полоний, а затем и радий. С выделением полония не сложилось, поэтому ученые сосредоточились на радии. Экстракция урана из руды в промышленности производится преимущественно методом гидрометаллургии. Природный уран - не только уран, он содержит целую серию продуктов распада (радиоактивные ряды урана-238 и урана-235), причем некоторые из этих продуктов распада гораздо более радиоактивны, чем чистый уран. Один из таких замечательных продуктов - радий (без иронии). Уже следовые количества радия в урановых рудах имеют большую активность, чем сам уран. Радий - химический аналог бария. Кроме мизерного количества радия руда содержит гораздо более высокое количество бария (а, если не содержит, барий добавляют в процессе получения радия). Для выделения радия супруги Кюри использовали отходы после промышленной переработки урановой руды. Уран содержится в руде в форме минерала уранит (настуран, уранинит, урановая смоляная руда), которому приписывают формулу UO2 (или U3O8). При переработке урановой руды уран экстрагируют действием серной кислоты. В результате барий переходит в очень малорастворимый сульфат BaSO4, увлекая за собой радий. Другими словами, следовые количества радия соосаждаются с большими количествами бария, образуя сульфат бария-радия (Ba,Ra)SO4. Атомы радия изоморфно замещают барий в кристаллической решетке. (Вы не забыли, что барий - химический аналог радия?) Сульфат бария выступает в роли коллектора (носителя). Без бария такие мизерные количеств радия могли бы остаться в растворе, поскольку растворимость сульфата радия, хотя и крайне низкая, но абсолютно нерастворимых веществ не существует. Более того, даже, если бы осадок чистого RaSO4 и выпал, его объем был бы мизерным. Такой осадок размазывается по стенкам оборудования (без возможности отделения). Мизерное количество радия осаждается из раствора вместе с большим количеством бария. Для удаления примесей осадок кипятили с гидроксидом натрия, затем обрабатывали соляной кислотой. Это позволяет отделить барий и радий от некоторых других компонентов. Потом осадок сульфата бария-радия (Ba,Ra)SO4 переводят в карбонат кипячением с раствором соды: (Ba,Ra)SO4 + Na2CO3 = (Ba,Ra)CO3 + Na2SO4 Из карбоната получают хлорид действием соляной кислоты, дальше некоторые примеси удаляют осаждением их сероводородом. Очищенный хлорид опять переводят в сульфат - т.е., повторяют повторное соосаждение бария и радия в форме сульфата (Ba,Ra)SO4. Сульфат опять переводят в карбонат, карбонат - в хлорид. В результате трудоемкой работы образуется хлорид бария с небольшим количеством радия (Ba,Ra)Cl2. После этого производят длительное и очень трудоемкое разделение радия и бария методом дробной кристаллизации. Метод основан на многократном растворении и осаждении смеси хлоридов (а лучше бромидов) радия и бария. При этом радий концентрируется в твердой фазе (за счет меньшей растворимости солей), а барий - в растворе. Именно так Мария и Пьер Кюри впервые выделили радий. Для получения 90 мг чистого хлорида радия RaCl2 понадобилось использовать 1 т отходов переработки урановой руды. Всего было проведено около 10000 перекристаллизаций. Вернемся к природной воде. Близкий друг раньше занимался исследованием миграции металлов в природных водах. В частности, их научная группа исследовала распределение металлов между разными фракциями органических веществ в природной воде. Для концентрирования воды они применяли метод вымораживания: колба с водой вращалась в емкости с охлаждающей смесью (лед - хлорид натрия). В результате часть воды замерзала (до 9/10), а часть оставалась жидкой. Растворенные вещества оставались в жидкой фазе и концентрировались, а в твердую фазу переходила чистая вода. Незамерзшую воду брали для исследований, лед отбрасывали. Ротационные испарители в то время в нашей стране были редкостью, и описанный метод вполне их заменял (в данном исследовании). Частичное замораживание также используют для очистки питьевой воды в бытовых условиях. Метод называется очистка воды вымораживанием [2]. Так очищают "уже очищенную" питьевую воду, если возникают сомнения в ее чистоте. Бутылку с водой ставят в морозилку, чтобы вода замерзла лишь частично. Потом воду, которая осталась жидкой (незамерзшей), отбрасывают - в ней сконцентрированы примеси, а лед промывают, растапливают и используют в качестве питьевой воды и для приготовления пищи. Разумеется, если в воде были какие-то патогенные микроорганизмы, вымораживание их не удалит. К слову, данный метод очистки питьевой воды является противоположностью по сравнению с описанной выше лабораторной процедурой вымораживания воды (там лед отбрасывают, а незамерзшую воду используют). Аналогичную технологию можно использовать и при очистке сточных вод. Когда сточные воды частично замерзают, они образуют более чистый лед, который можно удалить. Оставшиеся сточные воды становятся более концентрированными. __________________________________________________ 1 Другие методы выделения веществ из большого объема разбавленных растворов: сорбция, ионный обмен (частный случай сорбции), жидкостная экстракция. 2 К сожалению, вокруг данного метода есть много псевдонаучных спекуляций и фальсификаций. Метод действительно работает, но каких-либо чудодейственных результатов ожидать от вымораживания воды не следует. |

Marie and Pierre Curie experimenting with radium, a drawing by Andre Castaigne |
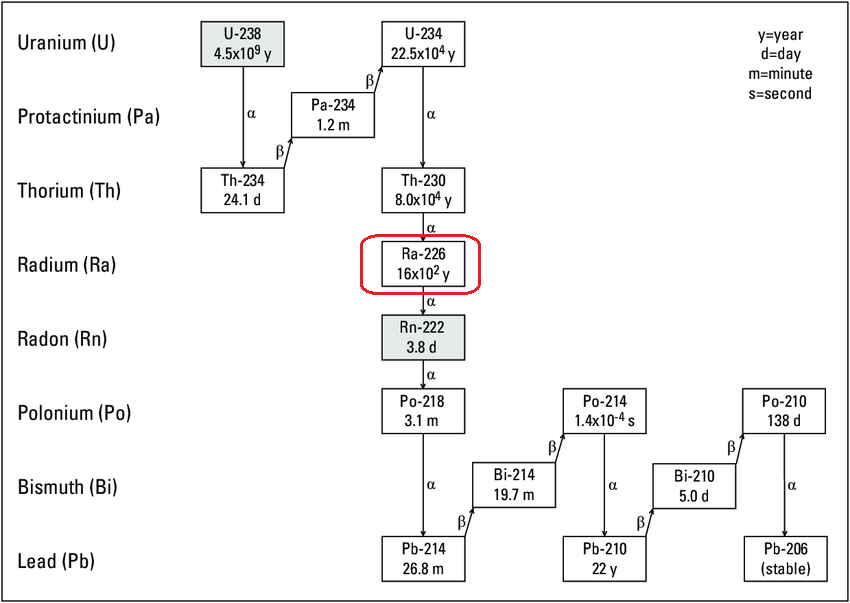
Diagram of the uranium-238 decay series with the half-life for individual isotopes |