Chemistry and Chemists № 3 2023
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2023 Journal of Chemists-Enthusiasts |
Natural water and chemical reagents (demonstration model of water treatment process) - p.11 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Black tea, tap water and aluminium sulfate (demonstration model of water treatment process) - p.11
The idea for this experiment came to mind by accident. This happens often in science: when you look for one thing, you find something completely different. This happens even in applied research. In fundamental science, predicting the applications of the investigation is often impossible. They developed string theory and, as a result, invented the design of a virtual frying pan (this is a joke). But seriously, the history of science knows many similar discoveries. For example, French physicist Antoine Henri Becquerel discovered that uranium salts emit invisible rays that can penetrate through opaque black paper and blacken a photographic plate. Moreover, the scientist accidentally made this discovery while studying uranium compounds' luminescence. Initially, it looked like a curiosity. But from this discovery, nuclear physics began: atomic model, nuclear fission and nuclear fusion, nuclear and thermonuclear weapons, nuclear power, radiation sickness and radiation therapy, mountains of radioactive waste, tritium key fobs and nuclear blackmail, radium (luminous) dials and radium girls, and much, much more. 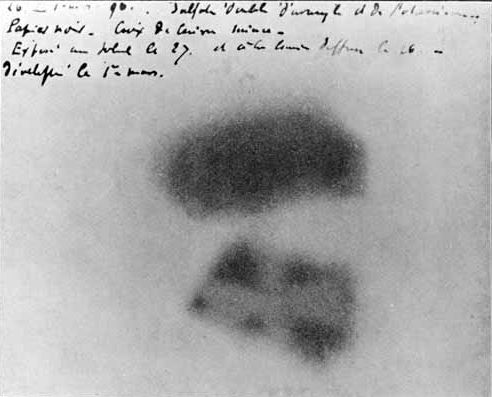
Becquerel's photographic plate which has been fogged by exposure to radiation from a uranium salt. The shadow of a metal Maltese Cross placed between the plate and the uranium salt is clearly visible


Radium dials 
Radium girls (these women worked with radioactive paint; many of them died young) Studying "uninteresting" mold fungi gave humanity penicillin and later other antibiotics. Charles J. Pedersen, a chemist at the American company DuPont, accidentally discovered crown ethers. The scientist was studying analogous non-cyclic compounds to use them as ligands. The famous macrocycles were formed due to the presence of impurities in the initial reagents. The discovery of crown ethers marked the beginning of a new direction in chemistry. In particular, crown ethers form strong complexes with alkali metal cations. This was previously considered incredible. For example, no one could have thought potassium permanganate could dissolve in benzene! 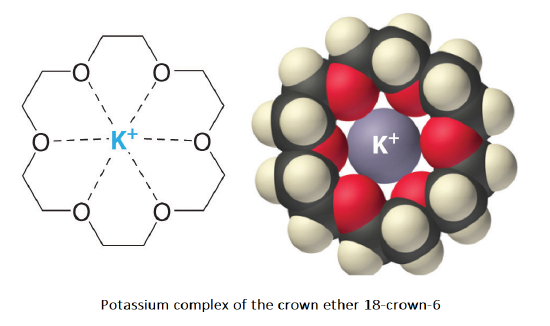
Potassium complex of the crown ether 
Using white phosphorus weapon In the beginning, I was thinking about the reaction of tannins with ferric salts. Phenols form coloured complexes with Fe(III) salts. Tannins are naturally occurring polyphenols that are found in many plants and plant products, such as black and green tea. If you add a solution of trivalent (or divalent) iron salts to brewed tea, the solution will turn dark violet or black [1]. The trivalent aluminium cation Al3+ is an analogue of the iron (III) cation Fe3+. Not in all reactions, of course, but quite often. What happens if you add a solution of aluminium salt to black tea? The aluminium cation Al3+ is colourless, so I did not expect a change in the colour of the tea, but perhaps a precipitate will form (or other changes will occur). For the experiment, I brewed black tea using distilled water. Tap water contains bicarbonates, which can form the precipitate with aluminium salts. I added the solution of aluminium sulfate (transparent, without turbidity) to the tea. At first, nothing happened, but then a white turbidity occurred. Later, a small amount of precipitate formed. I immediately realized that tannins had nothing to do with the precipitate formation. The fact is that I washed the glass (into which the tea was poured) with tap water just before the experiment. I was in a hurry, so I didn't wait until all the water had drained from the walls: a little tap water remained on the glass in the form of drops and film. Tap water contains bicarbonates. They probably caused the formation of aluminium hydroxide turbidity. In any case, the aluminium cation did not form a precipitate with tannins. As a result, I came up with a completely different experiment. Black tea is a model of natural water with a high content of coloured organic matter. The tea is similar to yellowish lake water - in both cases, the colour is due to the presence of natural organic compounds in the water. The colour of the tea is much more intense than the colour of previously used lake water (see previous parts of the article). So, I can experiment with water discolouration using the coagulation method (it is necessary to obtain aluminium hydroxide flakes, which adsorb impurities and then settle to the bottom). I should precipitate aluminium hydroxide. An aluminium salt and an alkali were required for this purpose. I already added aluminium sulfate to black tea made using distilled water (in the experiment mentioned above). Then, I should add an alkaline reagent to this tea, for example, a solution of sodium bicarbonate. But I did it more straightforward: I added double the volume of tap water to the solution (tap water contains bicarbonates). A suspension formed. When the solid phase settled to the bottom (it was aluminium hydroxide), it became clear that the colour of the precipitate was brown. The solution was initially brown (tea). After the experiment, its colour became yellow - the intensity of colour decreased significantly. Therefore, aluminium hydroxide partially discoloured the tea (by adsorbing and precipitating coloured substances). I decided to repeat the experiment and take a complete video this time. Of course, I modified the experiment based on the new goal. I poured about 5 litres of tap water into a large jar and added black tea until the water turned yellow-brown. Then, the water looked like lake water (only the colour was more intense). I dissolved 3 g of aluminium sulfate in 30 ml of distilled water. I waited until the turbidity precipitated and drained the clear, colourless solution from the sediment. I added the aluminium sulfate solution to the yellow-brown water and stirred the liquid in the jar. The solution gradually became cloudy and lost transparency. After a couple of minutes, brown flakes formed in the liquid. They began slowly to precipitate. The flakes appeared very similar to iron (III) hydroxide! Of course, it was the precipitate of aluminium hydroxide. The colourless compound adsorbed the brown dye from the tea. The flakes settled to the bottom of the jar quickly (within a few minutes), but after its precipitation, the liquid remained cloudy. The fine solids took many hours to settle. As a result, a voluminous brown precipitate was formed. The light yellow solution (without turbidity) was above the precipitate. Thus, aluminium sulfate partially discoloured the black tea (added to tap water), but the solution remained yellow. It is necessary to carry out one more experiment to achieve complete discolouration of the water. I should repeat the procedure described above (to be honest, I don't think it will work). __________________________________________________ 1 See the digest of articles: Experiments with Plants and Insects. Natural Products [Link] |
|
Черный чай, водопроводная вода и сульфат алюминия (демонстрационная модель процесса очистки воды) - ч.11
Идея данного эксперимента пришла в голову случайно. В науке такое случается часто: ищешь одно - находишь совсем другое. Так бывает даже в прикладных исследованиях. В фундаментальной науке часто невозможно предвидеть, какие применения найдет исследование. Разрабатывали теорию струн - изобрели конструкцию виртуальной сковородки (шутка). Если быть серьезным, подобных открытий история науки знает очень много. Например, французский физик Анри Беккерель (Antoine Henri Becquerel) обнаружил, что соли урана излучают невидимые лучи, которые могут проникать сквозь непрозрачную черную бумагу и засвечивать фотопластинку. Причем данное открытие ученый сделал случайно, когда исследовал люминесценцию соединений урана. Первоначально это выглядело курьезом. Но именно с открытия "невидимых проникающих лучей" началась ядерная физика: модель атома, расщепление ядра и ядерный синтез, ядерное и термоядерное оружие, атомная энергетика, лучевая болезнь и лучевая терапия, горы радиоактивных отходов, тритиевые брелки и ядерный шантаж, светящиеся циферблаты и радиевые девушки, а также - многое-многое другое. 
Becquerel's photographic plate which has been fogged by exposure to radiation from a uranium salt. The shadow of a metal Maltese Cross placed between the plate and the uranium salt is clearly visible


Radium dials 
Radium girls (these women worked with radioactive paint; many of them died young) Исследование "никому не интересных" плесенных грибов подарило человечеству пенициллин, а потом и другие антибиотики. Краун-эфиры были открыты случайно Чарльзом Педерсеном (Charles J. Pedersen), химиком американской компании DuPont, который исследовал аналогичные нециклические соединения (с точки зрения применения их в качестве лигандов). Знаменитые макроциклы образовались в результате того, что в исходных реагентах были примеси. Открытие краун-эфиров стало началом нового направления в химии. В частности, краун-эфиры образуют прочные комплексы с катионами щелочных металлов, что до этого казалось невероятным. Например, никто не мог подумать, что перманганат калия можно растворить в бензоле! 
Potassium complex of the crown ether 
Using white phosphorus weapon Первоначально я думал о реакции танинов с солями трехвалентного железа. Фенолы, в частности - танины, образуют с солями Fe(III) окрашенные комплексы. Танины являются природными полифенолами и содержатся в ряде растений и растительных продуктов, например, в черном и зеленом чае. Если к заваренному чаю добавить раствор солей трехвалентного (или двухвалентного) железа раствор станет темно-фиолетовым или черным [1]. Катион трехвалентного алюминия Al3+ является аналогом катиона трехвалентного железа Fe3+. Не во всех реакциях, разумеется, но довольно часто. Что произойдет, если к черному чаю добавить раствор соли алюминия? Катион алюминия Al3+ бесцветный, поэтому изменения окраски чая я не ожидал, но, возможно, выпадет осадок? Или произойдут другие изменения? Для эксперимента заварил черный чай на дистиллированной воде. Водопроводная вода содержит гидрокарбонаты, которые могут дать осадок с солями алюминия. Добавил к чаю раствор сульфата алюминия (прозрачный, без мути). Сначала - ничего не произошло, потом - образовалась белая муть. Со временем выпало небольшое количество осадка. Но я сразу понял, что танины к образования осадка отношения не имели. Дело в том, что стакан, в который был налит чай, я помыл водопроводной водой перед самым экспериментом. Спешил, потому не дождался, пока вся вода стечет со стенок: немого водопроводной воды осталось на стекле в виде капель и пленки. В водопроводной воде есть гидрокарбонаты. Вероятно, они и вызывали образование мути гидроксида алюминия. В любом случае, алюминий не дал осадка с танинами. В результате у меня возникла идея совсем другого эксперимента. Черный чай - модель природной воды с высоким содержанием окрашенных органических веществ. Чай похож на желтоватую озерную воду - в обоих случаях цвет обусловлен наличием в воде природных органических соединений. Цвет чая значительно интенсивнее, чем цвет воды из озера, которую мы использовали в экспериментах ранее (см. предыдущие части статьи). Раз так, то можно провести эксперимент по обесцвечиванию воды методом коагуляции (необходимо получить хлопья гидроксида алюминия, которые адсорбируют примеси и осядут на дно). Итак, мне нужно осадить гидроксид алюминия. Для этого необходимы соль алюминия и щелочь. В упомянутом выше эксперименте я уже добавил сульфат алюминия к черному чаю, заваренному на дистиллированной воде. Остается добавить щелочной реагент, например, раствор гидрокарбоната натрия. Но я поступил проще: добавил в раствор двойной объем водопроводной воды (она содержит гидрокарбонаты). Образовалась суспензия. Когда твердая фаза осела на дно (это был гидроксид алюминия), стало видно, что цвет осадка - коричневый. Раствор, который был изначально коричневым (чай), стал желтым - интенсивность окраски значительно уменьшилась. Таким образом, гидроксид алюминия частично обесцветил чай (адсорбировав и осадив окрашенные вещества). Решил повторить опыт и на этот раз заснять полное видео. Разумеется, я модифицировал эксперимент, исходя из новой цели. В большую банку налил около 5 л водопроводной воды. К воде добавил черный чай до интенсивной желто-коричневой окраски. Теперь вода стала похожа на воду из озера (только цвет был более интенсивный). 3 г сульфата алюминия растворил в 30 мл дистиллированной воды. Подождал, пока муть осядет и слил прозрачный и бесцветный раствор с осадка. К желто-коричневой воде в банке добавил раствор сульфата алюминия, перемешал. Раствор постепенно стал мутным и потерял прозрачность. Через пару минут в нем сформировались коричневые хлопья, которые стали медленно оседать. Хлопья по внешнему виду очень напоминали гидроксид железа (III)! Разумеется, это был осадок гидроксида алюминия. Бесцветное вещество адсорбировало коричневый краситель из чая. Хлопья осели на дно банки быстро - за несколько минут, но после их осаждения жидкость оставалась мутной. Мелкие твердые частицы оседали много часов. В результате образовался объемный бурый осадок, над которым был светло-желтый раствор (без мути). Таким образом, сульфат алюминия частично обесцветил черный чай (добавленный в водопроводную воду), но раствор остался желтым. Необходимо провести еще один эксперимент, чтобы добиться полного обесцвечивания воды, а именно: повторить описанную выше процедуру (если честно, я думаю, что это сработает). __________________________________________________ 1 See the digest of articles: Experiments with Plants and Insects. Natural Products [Link] |

Black tea, tap water and aluminium sulfate (demonstration model of water treatment process) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Черный чай, водопроводная вода, сульфат алюминия и бикарбонат натрия (демонстрационная модель процесса очистки воды) - ч.12
После описанного в прошлой части статьи эксперимента прошло 3 дня. На дне банки был бурый осадок (в форме "лепешки"), над осадком - желтый раствор. Желтый цвет раствора обусловлен тем, что не весь краситель чая был адсорбирован и осажден гидроксидом алюминия. Цель данного эксперимента - добиться полного обесцвечивания воды. Для этого необходимо повторить осаждение гидроксида алюминия. В свою очередь, для образования гидроксида алюминия нужно провести реакцию между солью алюминия и щелочным реагентом. В исходной водопроводной воде содержались гидрокарбонаты, к которым я добавил 3 г сульфата алюминия. Какой из реагентов остался в избытке? Давайте проведем расчет (хотя бы приблизительно). Согласно определению, пресная вода содержит не больше 0.5 г/л растворенных солей. По другим источникам, максимальная концентрация солей в пресной воде выше (например, 1 г/л или 3 г/л). В действительности, концентрация растворенных солей в питьевой воде должна быть существенно ниже (чем приведенные величины), иначе портится ее вкус. В питьевой воде содержатся разные катионы (Na+, K+, Ca2+, Mg2+) и анионы (Cl-, SO42-, HCO3-), которые соответствуют растворенным солям. Примем условно, что в воде содержится только гидрокарбонат натрия NaHCO3 и его концентрация равна 0.5 г/л. Для прошлого эксперимента мы использовали 5 л воды, которая содержит: m(NaHCO3) = 5 * 0.5 = 2.5 г NaHCO3; M(NaHCO3) = 84.01 г/моль, n(NaHCO3) = 2.5/84.01 = 0.0298 моль. m(Al2(SO4)3·18H2O) = 3 г; M(Al2(SO4)3·18H2O) = 666.44 г/моль, n(Al2(SO4)3·18H2O) = 3 / 666.44 = 0.00450 моль. 1Al2(SO4)3 + 6NaHCO3 = 2Al(OH)3 + 3Na2SO4 + 6CO2 1n (Al2(SO4)3·18H2O) реагирует с 6n (NaHCO3); Рассчитаем, какое из веществ в избытке: 0.0298 - (0.00450*6) = 0.0028 моль (избыток NaHCO3). Расчет показал, что вещества (сульфат алюминия и гидрокарбонат натрия) были почти в эквивалентах количествах, причем гидрокарбонат натрия был в небольшом избытке. К сожалению, приведенный расчет ненадежен. Во-первых, точная концентрация гидрокарбоната натрия в питьевой воде неизвестна. Во-вторых, состав сульфата алюминия (технической чистоты) может не соответствовать формуле Al2(SO4)3·18H2O. Поэтому необходимо провести качественную реакцию на ион алюминия в растворе. Отобрал небольшое количество желтого раствора в стакан и добавил к нему избыток раствора аммиака (до появления сильного запаха). Осадок и даже муть не образовались - ни сразу, ни при стоянии раствора. Гидроксид алюминия не выпал в осадок. Ион алюминия не обнаружен. Таким образом, в банку с желтой водой необходимо добавить сульфат алюминия. Я приготовил новый раствор сульфата алюминия (3 г в 30 мл воды), подождал, пока не растворившиеся частицы осядут, слил прозрачную жидкость с осадка. В банку с желтой водой и осадком добавил раствор сульфата алюминия (пока что не перемешивал). Осадок со дна неожиданно поднялся и разделился на крупные фрагменты, которые плавали в жидкости. Однако, мути в растворе видно не было. Другими словами, новая твердая фаза не образовалась (в заметных количествах). Перемешал. Осадок диспергировался и превратился в коричневую суспензию. Прекратил перемешивание. Частицы суспензии снова собрались (слиплись) в хлопья. Хлопья вскоре осели на дно, но мелкие твердые частички осадка остались взвешенными в жидкости (жидкость была коричневой и мутной). Таким образом, новый осадок гидроксида алюминия не образовался. Это означает, что (перед добавлением сульфата алюминия) в воде практически не осталось гидрокарбонатов. Для того, чтобы осадить гидроксид алюминия, необходимо добавить гидрокарбонат натрия. Я не стал ожидать полного осаждения суспензии и добавил в банку 20 мл насыщенного раствора гидрокарбоната натрия. Сразу же образовалась белая суспензия (гидроксид алюминия). Перемешал жидкость. Постепенно образовались белые хлопья, которые выпали на дно. Сформировался осадок: снизу он был коричневый, сверху - белый. Муть (мелкие твердые частицы) в этот раз также оседала долго. Интенсивность окраски раствора уменьшилась, но жидкость осталась желтоватой. Полного обесцвечивания воды достичь не удалось. |

Black tea, tap water, aluminium sulfate and sodium bicarbonate (demonstration model of water treatment process). Part #2 |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|