Chemistry and Chemists № 3 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2025 Journal of Chemists-Enthusiasts |
Experiments with Phenol - pt.1, 2, 3 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Phenol-Iron Complexes (Introduction) - Part 1
Phenols are a group of organic compounds in which the hydroxyl group is directly bonded to a benzene ring. The number and position of hydroxyl groups and benzene rings in the molecule may vary. Various other functional groups may also be present. The simplest representative of this class is phenol (C6H5-OH), which forms white, low-melting crystals. Phenol oxidizes when stored in air and is toxic to almost all living organisms. Upon contact with skin, it causes severe burns. Many other phenols are also toxic and easily oxidized. However, some phenolic compounds - such as flavonoids and tannins - are important biological molecules.
Эксперименты с фенолом Комплексы фенолов с железом (вступление) - часть 1 Фенолы - группа органических веществ, в структуре которых гидроксильная группа непосредственно связана с бензольным ядром. Количество и пространственное положение гидроксильных групп и бензольных колец в молекуле может варьроваться. Возможно одновременное наличие разнличых других функциональных групп. Простейшим представителем данного класса веществ является фенол: C6H5-OH, который представляет собой белые легкоплавкие кристаллы. Фенол окисляется при хранении на воздухе и токсичен практически для всего живого. При попадании на кожу, фенол вызывает сильные ожоги. Многие другие фенолы также токсичны и легко окисляются. Однако, некоторые представители фенольных соединений, например, флавоноиды и танины, являются важнейшими биологическими молекулами.
A characteristic property of phenols is their ability to form intensely colored complexes with iron salts. The color of these complexes depends on the specific phenol used. For this experiment, one can use not only pure phenolic compounds but also plant extracts (tinctures) or extracts from specific plant parts — for example, black or green tea, oak leaves, or pomegranate peel. Характерным свойством фенолов является образование интенсивно окрашенных комплексов с солями железа. Цвет комплексов зависит от конкретного представителя фенолов. Для этого эксперимента можно использовать не только индивидуальные фенолы, но и экстракты (настойки) растений или их определенных частей. Например, подходят черный или зеленый чай, дубовые листья или кожура граната.
In the past, I obtained iron complexes with various phenols. Initially, I used tea tannins, oak gall tannins, and aqueous extracts from other plants. Later, I synthesized iron complexes with reactive tannin and gallic acid. The color of these complexes ranged from violet to nearly black. В прошлом я получал комплексы железа с разнообразными фенолами. Сначала использовал танины чая, танины чернильных (дубовых) орешков и водные экстракты некоторых других растений. Позже синтезировал комплексы железа с реактивным танином и галловой кислотой. Цвет этих комплексов варьировался от фиолетового до почти черного.
However, an attempt to obtain such a complex with humic acids (in the form of a sodium salt) was unsuccessful - the addition of iron(III) chloride did not produce the characteristic coloration. Similarly, attempts to synthesize complexes of iron(III) chloride with picric acid (trinitrophenol), fluorescein, and phenolphthalein were also unsuccessful. Зато попытка получить такой комплекс с гумусовыми кислотами (натриевая соль) оказалась неудачной - добавление хлорида железа (III) не вызвало появления характерной окраски. Попытки синтезировать комплексы хлорида железа (III) с пикриновой кислотой (тринитрофенол), флуоресцеином и фенолфталеином также дали отрицательный результат.
Sulfosalicylic acid, however, did form a cherry-colored complex with iron(III) chloride. The drug aspirin produced a violet-colored complex with iron(III) chloride. Aspirin is based on acetylsalicylic acid, which lacks hydroxyl groups and thus does not form complexes with iron salts. However, since acetylsalicylic acid is synthesized from salicylic acid, any impurity of salicylic acid in the sample can give a violet complex with FeCl3. Зато сульфосалициловая кислота давала с хлоридом железа (III) комплекс вишневого цвета. Медицинский препарат аспирин образовал с хлоридом железа (III) фиолетовый комплекс. Основой данного лекарства является ацетилсалициловая кислота, которая не содержит гидроксильных групп, следовательно, она не образует комплексов с солями железа. Однако, ацетилсалициловую кислоту получают из салициловой кислоты. Если примесь салициловой кислоты остается в аспирине, образец дает фиолетовый комплекс с FeCl3.
Tannins, flavonoids, picric acid, sulfosalicylic acid, fluorescein, gallic acid, oak bark, roots, leaves, berries of various plants... I carried out this experiment with many phenolic compounds and their natural mixtures. Many years have passed, and it turned out that I had never synthesized a complex of iron with the simplest phenol - C6H5OH. I hadn't even seen this reaction on video! There is a jar of phenol in the lab - and iron(III) chloride as well. I decided to obtain the Fe(III)–phenol complex and film the reaction as it formed. In practice, this task turned out to be not as straightforward as the textbooks suggest. I'll tell you everything in order. Танины, флавоноиды, пикриновая кислота, сульфосалициловая кислота, флуоресцеин, галловая кислота, дубовая кора, корни, листья и ягоды различных растений... Я проводил данный эксперимент с различными фенолами и их природными смесями. Прошло много лет, и оказалось, что я ни разу не получал комплекс железа с простейшим фенолом - C6H5OH. Я даже не смотрел эту реакцию на видео! Банка с фенолом есть в лаборатории, хлорид железа (III) - тоже. Решил получить комплекс Fe(III) с фенолом и заснять реакцию между данными веществами на видео. На практике эта задача оказалось не такой простой, как пишут в учебниках химии. Расскажу обо всем по порядку. |
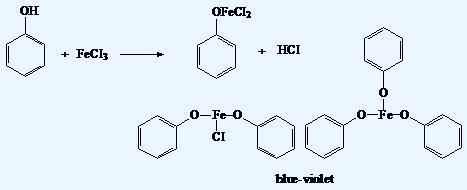
The reaction of iron(III) chloride with phenol |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Phenol, Iron(III) Chloride, and Tap Water - Part 2
The phenol crystals were caked, making it difficult to extract the substance from the jar. I had to use a steel spoon and apply considerable effort. I collected several grams of phenol but forgot to weigh it. For qualitative analysis, the exact weight (or volume) of substances rarely matters, but it's still better to control the quantities used.
Фенол, хлорид железа (III) и водопроводная вода - часть 2 Pure phenol is colorless, but the crystals in the jar were pink due to partial oxidation during long-term storage. For some purposes, phenol must be purified by distillation. However, distilling phenol in the laboratory is not a pleasant process. For the experiments described here, the pink phenol was acceptable. In the jar containing iron(III) chloride, instead of the expected brown crystals, a dark brown liquid was present. Iron(III) chloride is hygroscopic - it absorbs moisture from the air; as a result, the crystals had turned into a solution. This is not a problem for our experiment. It can be assumed that the iron(III) chloride solution was nearly saturated. I poured 900 ml of tap water into a one-liter glass. I added phenol crystals and stirred. Most of the phenol dissolved. Many chemical experiments require distilled water, but I decided that tap water would be acceptable in this case. Unfortunately, on some days, tap water contains so much iron that it turns tea violet. In our case, when the phenol dissolved, the violet color did not appear, so the experiment could proceed. I added the iron(III) chloride solution drop by drop to the glass containing the phenol solution. The first drops caused a violet color to appear. I stirred the contents of the glass - and the liquid turned brown! The violet color disappeared. The solution soon lost its transparency; it became clear that a suspension had formed, resembling a suspension of iron(III) hydroxide. I added more solid phenol and stirred - no violet color appeared. After the liquid stood for a while, a voluminous brown precipitate settled out. Thus, in the first moments of the interaction between phenol and iron(III) chloride, a violet complex formed, which then broke down, transforming into iron(III) hydroxide (or basic iron salts). Tap water contains carbonates and bicarbonates, which converted the iron(III) into hydroxide, destroying the phenol-iron complex. The formation of a violet complex with iron(III) chloride is a qualitative test for phenol. However, this reaction turned out to be capricious. For the next experiment, I will use distilled water. |
_Chloride_Tap-Water-1.jpg)
Phenol, Iron(III) Chloride, and Tap Water |
_Chloride_Tap-Water-2.jpg)
|
_Chloride_Tap-Water-3.jpg)
|
_Chloride_Tap-Water-4.jpg)
|
_Chloride_Tap-Water-6.jpg)
|
_Chloride_Tap-Water-7.jpg)
|
_Chloride_Tap-Water-8.jpg)
|
_Chloride_Tap-Water-9.jpg)
|
_Chloride_Tap-Water-10.jpg)
|
_Chloride_Tap-Water-11.jpg)
|
_Chloride_Tap-Water-12.jpg)
|
_Chloride_Tap-Water-13.jpg)
|
_Chloride_Tap-Water-14.jpg)
|
_Chloride_Tap-Water-15.jpg)
|
_Chloride_Tap-Water-16.jpg)
|
_Chloride_Tap-Water-17.jpg)
|
_Chloride_Tap-Water-18.jpg)
|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Phenol, Iron(III) Chloride, and Distilled Water - Part 3
I added 1 g of phenol to 200 ml of distilled water, stirred, and then added a solution of ferric chloride drop by drop. The solution turned violet, resembling school ink. A characteristic iron-phenol complex had formed.
Фенол, хлорид железа (III) и дистиллированная вода - часть 3 I left the solution over the weekend, intending to conduct experiments with the violet complex on Monday. However, on Monday I discovered that the solution in the beaker had turned brown, and a dark brown precipitate had formed. Phenol is oxidized when exposed to atmospheric oxygen during storage, and the complex was destroyed as a result of this oxidation. Di- and triatomic phenols (hydroquinone, pyrocatechol, pyrogallol, etc.) are oxidized much more readily than phenol. As I have already noted, the color of the complex reminded me of ink. The older generation remembers well what an ink pen is, while young people have been spared the "pleasure" of becoming acquainted with this antiquated "information recording technology." In those days, avoiding ink stains was nearly impossible - hands, cuffs, and even the most carefully written pages would often bear violet spots. Sometimes, when an ink blot appeared, it was not just an inconvenience but a small personal disaster.  |
_Chloride_Distilled-Water-1.jpg)
Phenol, Iron(III) Chloride, and Distilled Water |
_Chloride_Distilled-Water-2.jpg)
|
_Chloride_Distilled-Water-3.jpg)
|
_Chloride_Distilled-Water-4.jpg)
|
_Chloride_Distilled-Water-5.jpg)
|
_Chloride_Distilled-Water-6.jpg)
|
_Chloride_Distilled-Water-7.jpg)
|
_Chloride_Distilled-Water-8.jpg)
|
_Chloride_Distilled-Water-9.jpg)
|
_Chloride_Distilled-Water-10.jpg)
|
_Chloride_Distilled-Water-11.jpg)
|
_Chloride_Distilled-Water-12.jpg)
|
_Chloride_Distilled-Water-13.jpg)
|
_Chloride_Distilled-Water-14.jpg)
|
_Chloride_Distilled-Water-15.jpg)
|
_Chloride_Distilled-Water-16.jpg)
|
_Chloride_Distilled-Water-17.jpg)
|
_Chloride_Distilled-Water-18.jpg)
|
_Chloride_Distilled-Water-19.jpg)
|