Chemistry and Chemists № 3 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2025 Journal of Chemists-Enthusiasts |
Experiments with Sparingly Soluble Calcium, Strontium, and Barium Salts - pt.1, 2, 3 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Dissolving Calcium Sulfate in Water - Part 1
Let's consider the metals of Group II of the periodic table - or more precisely, their sulfates. Beryllium and magnesium form sulfates that are highly soluble in water. In contrast, the sulfates of calcium, strontium, barium, and radium are poorly soluble.
Эксперименты с малорастворимыми солями кальция, стронция и бария Растворение сульфата кальция в воде - часть 1 Excluding radium, barium forms the least soluble sulfate of all Group II elements (water solubility: 0.0002448 g/100 ml at 20°C). The extremely low solubility of barium sulfate can be clearly illustrated by the following example. On the one hand, soluble barium salts are highly toxic to humans; ingestion can easily lead to death. On the other hand, barium sulfate is taken orally before contrast radiography to visualize the gastrointestinal tract. Being a heavy element, barium absorbs X-rays effectively, producing clear images of soft tissues. The solubility of barium sulfate is so low that only a negligible amount of Ba2+ ions dissolves - an amount posing no danger to humans. However, if barium sulfate contains impurities of other barium compounds, such as barium sulfide, ingestion of such material can cause severe poisoning or even death. The solubility of calcium sulfate is also low, but significantly higher than that of barium sulfate. At 20°C, approximately 0.21 g of anhydrous calcium sulfate dissolves in 100 g of water. Strontium sulfate occupies an intermediate position. The formation of poorly soluble calcium, strontium, and barium sulfates is used in analytical chemistry for the qualitative determination of these metals. In the case of barium, the precipitation of BaSO4 is also used for quantitative analysis due to its extremely low solubility. When I tried to dissolve calcium sulfate in a solution of disodium EDTA, I suddenly recalled an interesting fact I had read in a Ukrainian analytical chemistry textbook [1] many years ago. Since all three metals - calcium, strontium, and barium - form poorly soluble sulfates, the presence of calcium and strontium interferes with the detection of barium by sulfate precipitation. To overcome this problem, the difference in the solubility of these sulfates is exploited.  Gypsum water (a saturated solution of calcium sulfate) forms a precipitate with barium ions at room temperature. The sulfate ions contained in the gypsum solution are sufficient to precipitate the poorly soluble barium sulfate. However, strontium ions under these conditions… I'll discuss strontium a little later. I had some anhydrous calcium sulfate, so I decided to prepare a saturated calcium sulfate solution and experiment with it. I weighed 1.03 g of calcium sulfate, placed it in a flask, added 500 ml of distilled water, and set it on a magnetic stirrer. I turned on vigorous stirring. A suspension formed, and after a few hours, most of the solid phase dissolved. I continued stirring until the power went out in our area. Without electricity, the magnetic stirrer stopped, so I simply left the flask for the weekend. When I returned to the lab two days later, I found that the solid phase had not completely dissolved - a small amount of sediment remained at the bottom of the flask. I filtered the solution through a cotton swab. I wanted to begin the gypsum water experiments immediately, but I was running out of time - according to the schedule, the power was supposed to go out again soon. In the remaining time, I prepared a barium salt solution. Barium chloride is typically used in analytical chemistry, but there was none among the reagents available in the lab. Instead, I found some barium nitrate. I opened the bag. The barium nitrate was in lumps that produced a lot of dust when I tried to grind them (remember, barium salts are poisonous). But the real surprise came when I tried to dissolve the barium nitrate in water. I weighed out 1 g of the salt and added about 10 ml of water. The salt dissolved extremely slowly, so I added more water and heated the solution on a hotplate. Most of the barium nitrate dissolved, but the solution remained cloudy, so I had to filter it. I began to doubt it: "Could it be that this isn't barium nitrate?" I had recently encountered a case where a jar labeled "Benzoic Acid" contained an unknown substance that wasn't an acid at all. There was no time to verify the authenticity of the barium nitrate - the power went out again, so I postponed the experiments until the next day. __________________________________________________ 1 F.G. Zharovsky, A.T. Pylypenko, I.V. Pyatnytsky Analytical Chemistry / Ф.Г. Жаровський, А.Т. Пилипенко, І.В. П'ятницький - Аналітична хімія [link]. |
|
Эксперименты с малорастворимыми солями кальция, стронция и бария
Рассмотрим металлы второй группы периодической системы элементов, точнее, их сульфаты. Бериллий и магний образуют сульфаты, которые хорошо растворимы в воде. В противоположность им, сульфаты кальция, стронция, бария и радия труднорастворимы в воде.
Растворение сульфата кальция в воде - часть 1 Не учитывая радий, барий образует наименее растворимый сульфат среди всех элементов 2-й группы (растворимость в воде - 0.0002448 г/100 мл, 20°C). Крайне низкую растворимость сульфата бария BaSO4 демонстрирует наглядный пример. С одной стороны, растворимые соли бария высокотоксичны для человека - их попадание внутрь легко может привести к летальным последствиям. С другой стороны, сульфат бария принимают внутрь перед проведением контрастной рентгенографии, чтобы визуализировать желудочно-кишечный тракт. Будучи тяжелым элементом, барий хорошо поглощает рентгеновские лучи, позволяя получить четкое изображение мягких тканей. Растворимость сульфата бария насколько низкая, что в раствор переходит лишь мизерное количество ионов Ba2+, которое не представляет опасности. Однако, если сульфат бария содержит примеси других соединений бария, например, сульфида бария, употребление внутрь такого препарата может привести к тяжелым отравлениям, вплоть до смертельных. Растворимость сульфата кальция также низкая, однако, она значительно выше растворимости сульфата бария. При 20°С в 100 г воды растворяется около 0.21 г безводного сульфата кальция. Сульфат стронция занимает промежуточное положение. Образование малорастворимых сульфатов кальция, стронция и бария используется в аналитической химии для качественного определения данных металлов. А в случае бария, осаждение BaSO4 также применяется для количественного анализа - благодаря крайне низкой его растворимости. Когда я пытался растворить сульфат кальция в растворе динатриевой соли EDTA, случайно вспомнил интересный факт, прочитанный в украинском учебнике аналитической химии [1] много лет назад. Поскольку все три металла - кальций, стронций и барий - образуют малорастворимые сульфаты, присутствие кальция и стронция мешает обнаружению бария путем осаждения сульфата. Чтобы решить эту проблему, используют разницу в растворимости приведенных сульфатов.  Гипсовая вода (насыщенный раствор сульфата кальция в воде) образует осадок с ионами бария при комнатной температуре. Сульфат-ионов, которые содержатся в растворе гипса, вполне достаточно, чтобы произошло осаждение труднорастворимого сульфата бария. Зато ионы стронция в этих условиях... Про стронций я расскажу чуть позже. Безводный сульфат кальция у меня был, поэтому я решил приготовить насыщенный раствор сульфата кальция и провести с ним эксперименты. Взвесил 1.03 г сульфата кальция, поместил его в колбу, добавил 500 мл дистиллированной воды и поставил на магнитную мешалку. Включил интенсивное перемешивание. Образовалась суспензия, а через несколько часов перемешивания большая часть твердой фазы растворилась. Продолжал перемешивание, пока в нашем районе не отключили электроэнергию. Без электричества магнитная мешалка не работала, поэтому просто оставил колбу на выходные. Пришел через два дня в лабораторию и обнаружил, что полного растворения твердой фазы не произошло - на дне колбы осталось немного осадка. Профильтровал раствор сквозь тампон из хлопковой ваты. Хотел сразу же начать эксперименты с гипсовой водой, однако, времени почти не осталось - согласно графику, скоро снова должны были отключить электричество. В оставшееся время приготовил раствор соли бария. Обычно в аналитической химии используют хлорид бария, однако, среди реактивов, которые были в лаборатории, хлорида бария не оказалось. Зато я нашел нитрат бария. Открыл пакет. Нитрат бария был в виде комков, которые сильно пылили при попытке их измельчить (напоминаю, соли бария ядовиты). Но главный сюрприз ждал меня при растворении нитрата бария в воде. Взвесил 1 г соли, добавил около 10 мл воды. Соль растворялась крайне медленно - добавил больше воды, подогрел раствор на плитке. Большая часть нитрата бария растворилась, но раствор остался мутным - его пришлось профильтровать. Я засомневался: "Возможно это НЕ нитрат бария?" Недавно у меня уже был случай, когда в банке с подписью "Бензойная кислота" оказалось неизвестное вещество, которое кислотой не является. Времени проверить подлинность нитрата бария не осталось - электричество отключили, и я отложил эксперименты до следующего дня. |

Dissolving Calcium Sulfate in Water |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Reaction of Saturated Solution of Calcium Sulfate with Barium Nitrate - Part 2
I faced a dilemma: should I immediately carry out the reaction between barium nitrate and the calcium sulfate solution I had prepared the day before, or should I first verify the authenticity of the barium nitrate? I had never observed this reaction before - neither directly nor in any video - so it was important to confirm that the reagent was genuine. For example, I could prepare a copper sulfate solution and add a drop of the barium nitrate solution to it. If the reagent was authentic, barium cations would instantly precipitate with sulfate anions.
Реакция насыщенного раствора сульфата кальция с нитратом бария - Часть 2 After some thought, I decided to keep the procedure simple and perform the reaction right away. If it failed, I could always prepare a fresh saturated calcium sulfate solution and then ask a colleague for barium chloride or a new sample of barium nitrate. I poured about 200 ml of the saturated calcium sulfate solution into a beaker and added 1 ml of the barium nitrate solution. The latter sank to the bottom, and the lower portion of the liquid immediately turned white and turbid. I stirred the mixture, and the entire solution in the beaker soon looked like milk - a suspension of barium sulfate had formed, and it proved to be relatively stable. When a laser beam (a pointer) passed through the suspension, a clear Tyndall cone was observed. Thus, upon the addition of barium nitrate, the saturated calcium sulfate solution instantly produced a barium sulfate suspension. |

Reaction of Saturated Solution of Calcium Sulfate with Barium Nitrate |

|

|

|

|
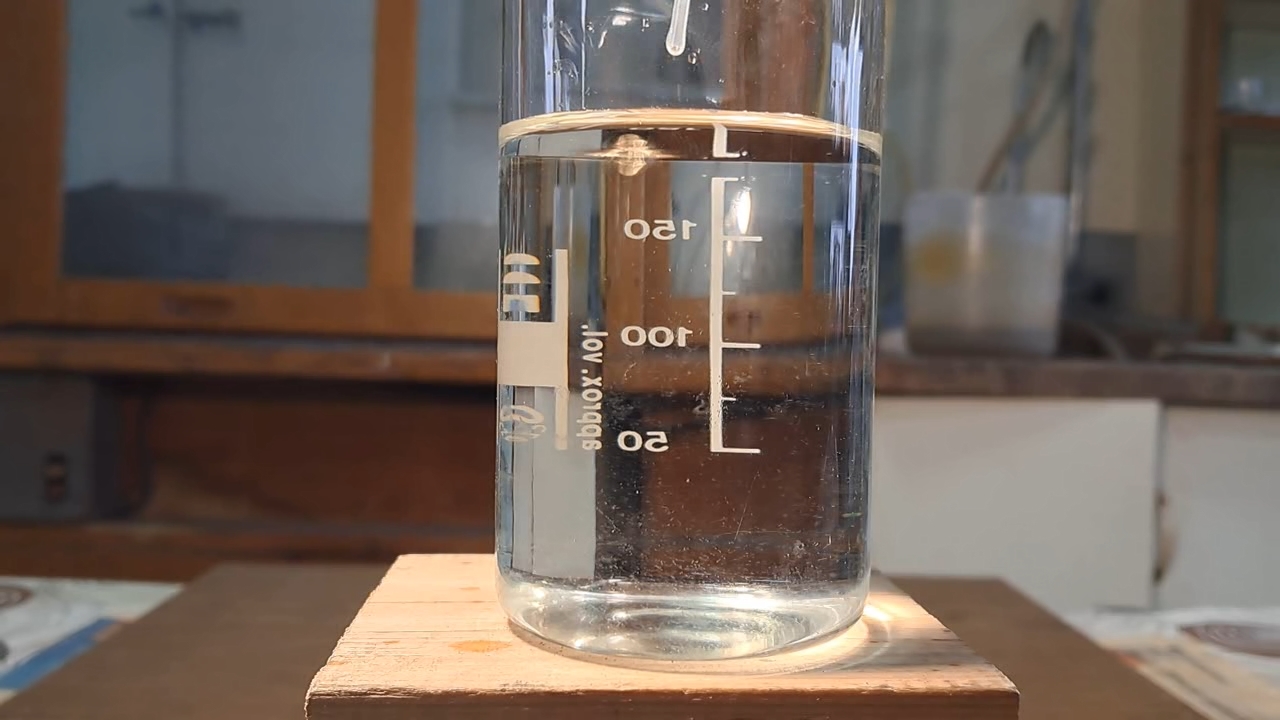
|
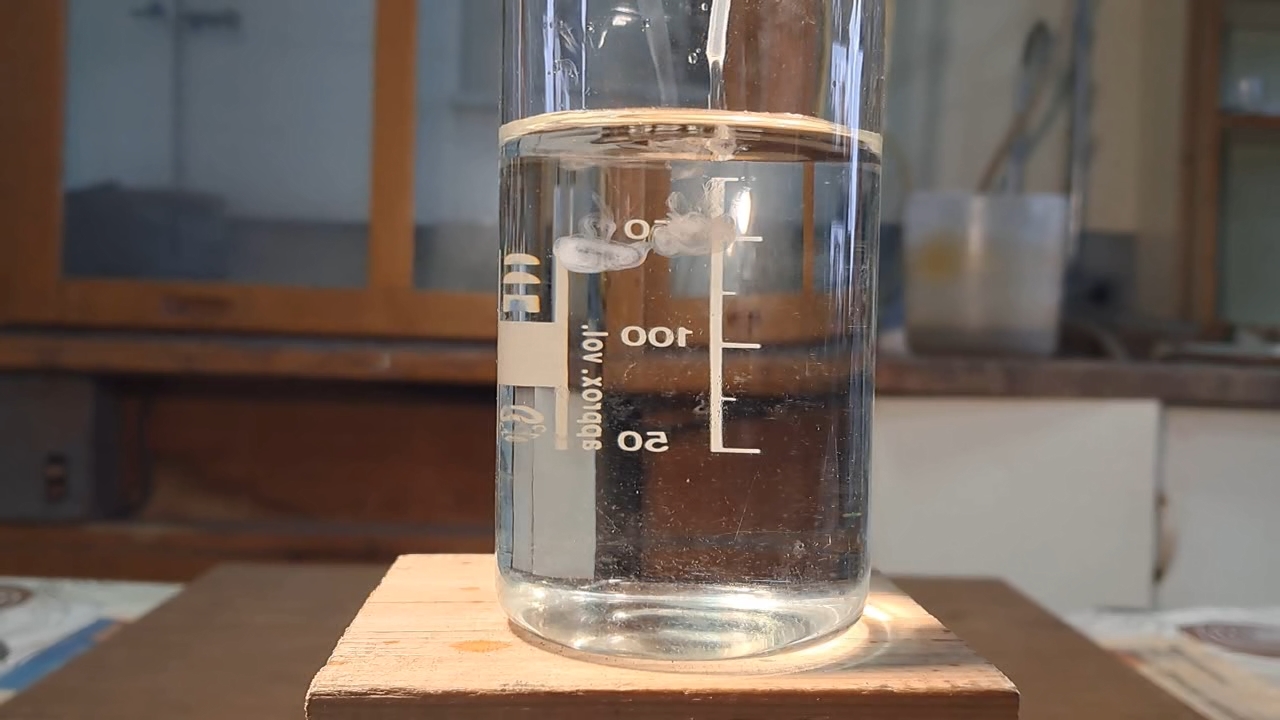
|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Reaction of Saturated Solution of Calcium Sulfate with Sodium Carbonate - Part 3
When a barium salt solution is added to a saturated calcium sulfate solution, a barium sulfate precipitate forms. After the previous experiment, I had approximately 300 ml of saturated calcium sulfate solution left, and I continued experimenting with it.
Реакция насыщенного раствора сульфата кальция с карбонатом натрия - Часть 3 The idea for the next experiment was based on two facts. First, a calcium sulfate solution contains not only sulfate ions but also an equivalent amount of calcium ions. Second, the solubility of calcium carbonate in water is lower than that of calcium sulfate. I poured 200 ml of the saturated calcium sulfate solution into a beaker and added 2 ml of a saturated sodium carbonate solution (calcined soda). I expected a calcium carbonate precipitate to form immediately, although I was not entirely certain. The sodium carbonate solution sank to the bottom, and the lower portion of the liquid instantly turned into a white suspension. I stirred the contents of the beaker, and the mixture began to resemble milk. Unlike the barium sulfate suspension, the calcium carbonate suspension proved to be less stable. After a few minutes, flocs formed, and the solid particles gradually settled to the bottom. Thus, a saturated solution of calcium sulfate in water forms a precipitate when mixed with a saturated solution of sodium carbonate. After the experiment, I recalled the method used to convert calcium sulfate into a form soluble in acids. A sodium carbonate solution is added to solid calcium sulfate, and the mixture is boiled. This converts the calcium sulfate into calcium carbonate and sodium sulfate. Because this reaction is reversible, the solution is separated from the precipitate, a fresh portion of sodium carbonate solution is added to the precipitate, and the mixture is boiled again. Repeating this procedure several times results in the conversion of calcium sulfate into calcium carbonate, which is soluble in acids [K1]. Barium sulfate can be converted in a similar manner into acid-soluble barium carbonate, despite the fact that barium sulfate has a lower solubility in water than barium carbonate (unlike the corresponding calcium salts). |
|
Реакция насыщенного раствора сульфата кальция с карбонатом натрия - Часть 3
Итак, при добавлении раствора соли бария к насыщенному раствору сульфата кальция образуется осадок сульфата бария. После прошлого эксперимента осталось примерно 300 мл насыщенного раствора сульфата кальция в воде, с которым я продолжил экспериментировать.
Идея следующего эксперимента основана на двух фактах. Во-первых, раствор сульфата кальция содержит не только ионы сульфата, но и эквивалентное количество ионов кальция. Во-вторых, растворимость карбоната кальция в воде меньше, чем растворимость сульфата кальция. Налил в стакан 200 мл насыщенного раствора сульфата кальция и добавил к нему 2 мл насыщенного раствора карбоната натрия (кальцинированная сода). Я рассчитывал, что сразу образуется осадок карбоната кальция, но не был уверен. Раствор соды опустился на дно, нижняя часть жидкости моментально превратилась в белую суспензию. Перемешал содержимое стакана - жидкость стала напоминать молоко. В отличие от суспензии сульфата бария, суспензия карбоната кальция оказалась менее стабильной. Через несколько минут образовались хлопья, твердые частицы постепенно оседали на дно. Таким образом, насыщенный раствор сульфата кальция в воде образует осадок с насыщенным раствором карбоната натрия. Уже после эксперимента вспомнил, каким способом сульфат кальция переводят в форму, растворимую в кислотах. К твердому сульфату кальция добавляют раствор карбоната натрия и кипятят. При этом сульфат кальция переходит в карбонат кальция и сульфат натрия. Данная реакция обратима, поэтому раствор отделяют от осадка, затем к осадку добавляют свежую порцию раствора карбоната натрия и снова кипятят. Процедуру повторяют несколько раз, в результате сульфат кальция превращается в карбонат кальция, который растворим в кислотах [K1]. Аналогичным методом сульфат бария превращают в растворимый в кислотах карбонат бария, несмотря на тот факт, что растворимость сульфата бария в воде меньше, чем растворимость карбоната бария (в противоположность соответствующим солям кальция). |

Reaction of Saturated Solution of Calcium Sulfate with Sodium Carbonate |

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Комментарии
К1
A long time ago, when I was often experimenting at home "for fun," I used this reaction to obtain sodium sulfate (since gypsum, as one of the starting materials, was less valuable than sulfuric acid). I used a saturated solution of sodium carbonate and alabaster (the latter with a slight excess, about +5-10% of the calculated amount), mixed them, heated them, and then stirred them periodically for several days without heating. Eventually, the indicator paper in the solution began to show a pH close to neutral. So, with these inputs, I wouldn't call the process reversible; it's just very slow, limited by the slow release of new portions of calcium sulfate into the solution.
Когда-то давно, когда я в домашних условиях часто проводил опыты "для души", эту реакцию доводилось проводить ради получения сульфата натрия (т.к. гипса в роли одного из исходников было не так жалко, как серной кислоты). Взял насыщенный раствор карбоната натрия и алебастр (последний - с некоторым избытком, где-то +5-10% от расчётного), смешал, нагрел, и затем уже без нагревания периодически перемешивал в течение нескольких дней. В итоге индикаторная бумага в растворе стала показывать pH, близкий к нейтральному. Так что при таких вводных я бы не назвал процесс обратимым, просто он идёт очень медленно, лимитируясь медленным переходом новых порций сульфата кальция в раствор. |