Experiments with Sparingly Soluble Calcium, Strontium, and Barium Salts - pt.6, 7, 8
Chemist
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
The method for converting sparingly soluble barium sulfate to barium carbonate, described in the analytical chemistry textbook, prompted a discussion on the forum. Since the solubility of barium sulfate in water is significantly lower than that of barium carbonate, the possibility of converting the sulfate to the carbonate in an aqueous medium was questioned.
Why is this method important? Unlike the sulfate, barium carbonate dissolves readily in acids (except in those that produce sparingly soluble barium salts).
According to the textbook, the barium sulfate precipitate is boiled with a sodium carbonate solution. Even though the sulfate is roughly ten times less soluble than barium carbonate, conversion still occurs due to the excess of sodium carbonate. For more complete conversion, the sodium carbonate solution is separated from the solid phase and replaced with fresh portions several times.
I decided that the textbook description was useful, but it would be better to perform an experiment, especially since the required substances were readily available.
The plan was as follows. Add a large excess of sodium carbonate, then distilled water to a small portion of barium sulfate. Boil the suspension for several hours. Then filter off the precipitate and collect the filtrate in a separate beaker. Rinse the precipitate with distilled water (without mixing the washings with the first filtrate), transfer the precipitate from the filter back into the beaker, add a fresh portion of sodium carbonate and water, and boil again. Filter the mixture and collect the second filtrate. Rinse the precipitate once more (again keeping the washings separate), and transfer it to a small beaker.
**Testing the filtrates.**
Neutralize the first and second filtrates with nitric acid until the solutions become strongly acidic. This converts sodium carbonate to sodium nitrate. Then add a few milliliters of barium nitrate solution. If barium sulfate has reacted with sodium carbonate, the filtrates will contain sodium sulfate, which will form a precipitate upon addition of barium nitrate. Neutralization is necessary to avoid the formation of barium carbonate.
**Testing the solid phase (the precipitate obtained by treating barium sulfate with sodium carbonate).**
Add nitric acid dropwise to the precipitate in a small beaker. If barium sulfate has been converted to barium carbonate, the solid will dissolve with the release of carbon dioxide, forming barium nitrate. If conversion is only partial, dissolution will be incomplete. If no reaction occurred, the precipitate will not dissolve in nitric acid and no gas will be released. To detect barium ions in the solution, filter off any undissolved residue and add sulfuric acid to the filtrate. The formation of a white precipitate of barium sulfate indicates the presence of barium ions, meaning that the original barium sulfate has partially or completely reacted with sodium carbonate to form barium carbonate.
I had some barium sulfate on hand — I had bought it earlier for preparing thermite mixtures. At the time, I had no other use for barium sulfate. Interestingly, this substance will now be used to perform reactions in solution.
|
Реакция сульфата бария с карбонатом натрия (план эксперимента) - Часть 6
Описанный в учебнике аналитической химии способ превращения малорастворимого сульфата бария в карбонат бария вызвал дискуссию на форуме. Поскольку растворимость сульфата бария в воде значительно ниже, чем карбоната, возможность превращения сульфата бария в карбонат бария в водном растворе вызывала сомнения.
Почему этот способ важен? В отличие от сульфата, карбонат бария легко растворяется в кислотах (за исключением тех, которые образуют малорастворимые соли бария).
Осадок сульфата бария кипятит с раствором карбоната натрия. Несмотря на то, что растворимость сульфата в воде примерно в десять раз ниже, чем карбоната бария, сульфат бария превращается в карбонат благодаря избытку раствора карбоната натрия. Кроме того, для более полной конверсии, раствор карбоната натрия несколько раз отделяют от твердой фазы и меняют на свежий.
Решил, что цитата из учебника - хорошо, но лучше провести эксперимент, тем более, что необходимые вещества легкодоступны.
Замысел был следующий. К небольшой порции сульфата бария добавить большой избыток карбоната натрия и дистиллированную воду. Раствор с осадком кипятить несколько часов. Затем отделить осадок фильтрованием, собрать фильтрат в отдельный стакан. Потом промыть осадок на фильтре дистиллированной водой (не смешивая промывные воды с предыдущим фильтратом), перенести осадок с фильтра в стакан, добавить новую порцию кальцинированной соды и воды, повторно кипятить. Отфильтровать осадок, собрать фильтрат. Затем промыть осадок на фильтре (не смешивая промывные воды с фильтратом) и перенести его в маленький стаканчик.
**Испытание фильтрата**.
Первый и второй фильтрат нейтрализовать азотной кислотой до сильнокислой реакции раствора. Карбонат натрия превратится в нитрат. Затем добавить несколько миллилитров раствора нитрата бария. Если сульфат бария прореагировал с карбонатом натрия, в растворе присутствует сульфат натрия, который образует осадок с нитратом бария. Нейтрализовать карбонат натрия было необходимо, чтобы не обрадовался осадок карбоната бария.
**Испытание твердой фазы (осадок, полученный обработкой сульфата бария карбонатом натрия)**.
К осадку в маленьком стаканчике добавить по каплям азотную кислоту. Если сульфат бария превратился в карбонат, осадок растворится с выделением углекислого газа и образованием нитрата бария. Если превращение сульфата в карбонат бария произошло лишь частично, растворение будет неполным. Если реакция между сульфатом бария и карбонатом натрия не имела место, осадок не растворится в азотной кислоте, газ не выделиться. Для обнаружения ионов бария в растворе необходимо отфильтровать раствор от не растворившегося остатка и добавить к фильтрату раствор серной кислоты. Образование белого осадка сульфата бария будет свидетельствовать, что в фильтрате присутствуют ионы бария, следовательно, исходный сульфат бария частично или полностью прореагировал с карбонатом натрия, образуя карбонат бария.
Сульфат бария был в наличии - я купил его ранее для приготовления термитных смесей. Другого применения для сульфата бария я не планировал. Любопытно, что теперь данное вещество будет использовано для проведения реакций в растворе.
|

Barium Sulfate
|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
I weighed 0.2 g of technical-grade barium sulfate and added 10 g of anhydrous sodium carbonate along with 100 ml of distilled water. After some consideration, I added another 5 g of sodium carbonate (15 g in total). I covered the beaker and placed it on a hot plate to boil. The mixture boiled for 2.5 hours, with additional water added periodically to compensate for evaporation. Then the power went out at the institute, so I left the beaker with the solution and precipitate overnight.
In the morning, I planned to quickly decant the solution from the sediment, add a fresh portion - 15 g of sodium carbonate and 100 ml of water - and return the mixture to the hot plate. I was in a hurry because another power outage was expected soon. However, the fine precipitate particles formed a stable suspension, making decantation impractical. As a result, I had to filter the mixture through a paper filter and then wash the precipitate on the filter, which took quite a long time.
After filtration, I transferred the precipitate into a beaker, added sodium carbonate and water, and brought the mixture to a boil. Unfortunately, the power went out again after just half an hour of boiling, so once more the beaker was left standing overnight.
In parallel, I began testing the filtrate. I added 56% nitric acid in small portions until the vigorous evolution of carbon dioxide ceased. A test with indicator paper showed that the solution was strongly acidic. I then added 3 ml of ~5% barium nitrate solution. I expected the liquid to turn white and turbid immediately.
However, no noticeable turbidity appeared at first. The solution remained clear, and carbon dioxide bubbles continued to form. After a few minutes, a slight cloudiness became visible. Sulfate anions were indeed present, but their concentration was low, which slowed the formation of barium sulfate.
A similar phenomenon had previously been observed in an experiment involving calcium sulfate and strontium chloride solutions: precipitation required either heating or prolonged standing.
I placed the beaker on a hot plate and heated it to boiling. The turbidity increased significantly. I left the beaker overnight, and by morning a white precipitate of barium sulfate had settled at the bottom.
Thus, after boiling the barium sulfate with sodium carbonate, sulfate anions were detected in the solution, confirming the conversion of barium sulfate into barium carbonate.
A control experiment would also be prudent: repeat the entire procedure using the same substances and quantities, but without barium sulfate. This ensures that any observed barium sulfate precipitate is not due to sulfate impurities in the original reagents. If the reagents are pure, no barium sulfate precipitate forms at the end of the control experiment.
I did not intentionally perform a control experiment, but I unintentionally conducted one the following day. After re-boiling the precipitate with sodium carbonate, I filtered it again and analyzed the second filtrate using the same method as before. In this case, after adding barium nitrate solution and heating, only a very slight turbidity was observed - if any at all. It is possible that I merely imagined it because I expected to see it.
The starting reagents were therefore pure: no sulfate anions were detected in the filtrate obtained after the second boiling of the precipitate with sodium carbonate.
|
Реакция сульфата бария с карбонатом натрия (эксперимент) - Часть 7
Взвесил 0.2 г сульфата бария технической квалификации. Добавил 10 г безводного карбоната натрия и 100 мл дистиллированной воды. Подумав, добавил еще 5 г карбоната натрия (всего 15 г). Накрыл стакан и поставил его на электрическую плитку кипятиться. Кипятил 2.5 часа, добавляя воду по мере испарения. Потом в институте отключили электричество. Оставил стакан с раствором и осадком на ночь.
Утром я планировал быстро декантировать раствор с осадка, затем добавить к осадку новую порцию - 15 г карбоната натрия, 100 мл воды и поставить раствор на плитку кипятиться. Спешил, поскольку согласно графику скоро опять должны были отключить электричество. Однако, мелкие частички осадка образовали устойчивую суспензию, поэтому раствор пришлось фильтровать сквозь бумажный фильтр, затем промывать осадок на фильтре, что заняло много времени.
После завершения фильтрования перенес осадок в стакан, добавил карбонат натрия и воду, поставил кипятиться. Успел прокипятить раствор только полчаса - электричество отключили - оставил стакан на ночь.
Параллельно приступил к испытанию фильтрата. Добавлял к фильтрату небольшими порциями 56% азотную кислоту до прекращения бурного выделения углекислого газа. Проверил индикаторной бумагой - среда была сильнокислой. Прилил 3 мл раствора нитрата бария (~5%). Ожидал, что раствор сразу же станет бело-мутным.
Однако, заметного помутнения не произошло. Жидкость осталась прозрачной, в ней продолжили образовываться пузырьки углекислого газа. Через несколько минут стало заметно легкое помутнение раствора. Анионы сульфата присутствовали в растворе, однако их концентрация была низкой, что замедляло образование осадка сульфата бария.
Подобное явление уже наблюдалось в эксперименте с растворами сульфата кальция и хлорида стронция. Чтобы образовался осадок, раствор необходимо было нагреть или оставить стоять на длительное время.
Поставил стакан на электрическую плитку, нагрел до кипения. Мутность раствора значительно усилилась. Оставил стакан на ночь. Утром на дне был белый осадок сульфата бария.
Таким образом, после кипячения раствора карбоната натрия с осадком сульфата бария, в растворе присутствовали анионы сульфата, что свидетельствует о превращении сульфата бария в карбонат бария.
Желательно было также провести контрольный эксперимент. Точно повторить описанную процедуру, используя те же вещества в тех же количествах, за исключением сульфата бария. Это было необходимо, чтобы доказать, что исходные реагенты не содержали примесь сульфата. Если реактивы чистые, в конце контрольного эксперимента не образуются осадок сульфата бария.
Целенаправленно контрольный эксперимент я не делал, однако, я провел его мимо воли на следующий день. После повторного кипячения осадка с карбонатом натрия, я отфильтровал осадок и исследовал второй фильтрат аналогично первому. В результате после добавления раствора нитрата бария и кипячения наблюдалось лишь слабое помутнение жидкости (возможно, помутнения не наблюдалось вовсе, и я увидел его потому, что ожидал увидеть).
Исходные реактивы оказались чистыми, а анион сульфата в фильтрате после повторного кипячения осадка с карбонатом натрия не обнаружен.
|

Reaction of Barium Sulfate with Sodium Carbonate
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
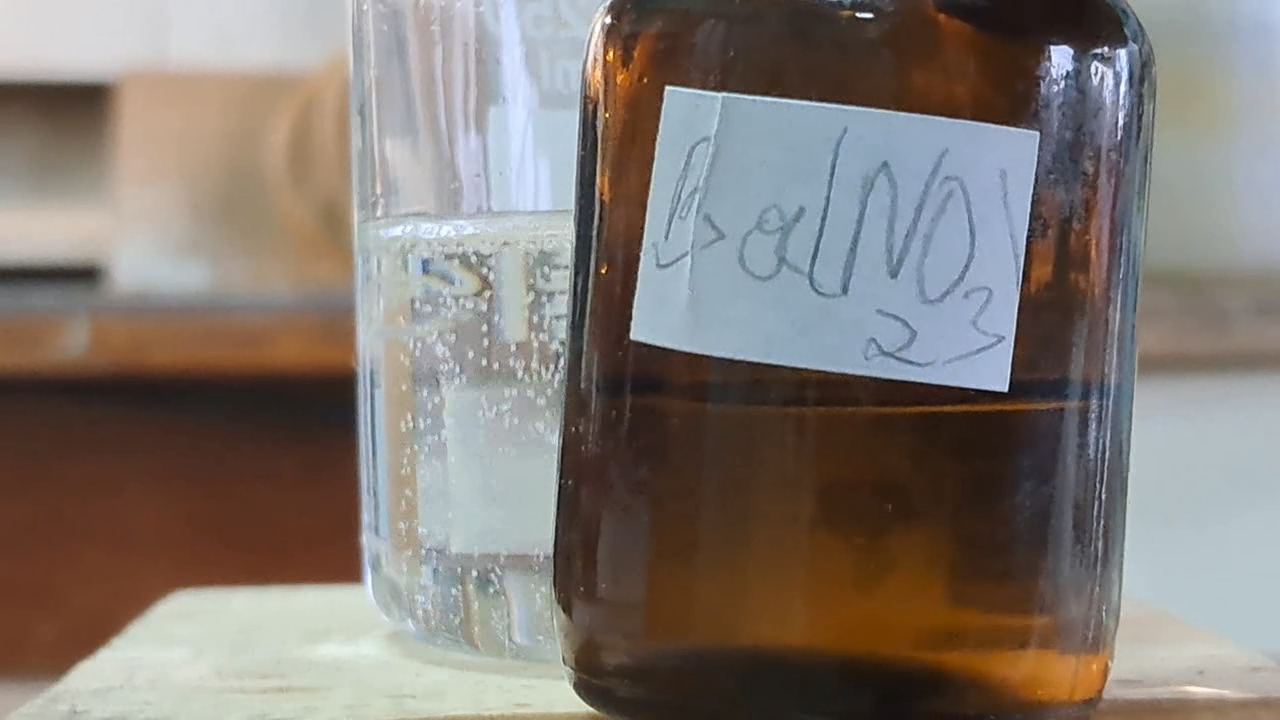
|

|

|

|

|

|

|
|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
After boiling the precipitate with a fresh portion of sodium carbonate, I left the beaker overnight. In the morning, I filtered the precipitate through a paper filter and rinsed it thoroughly with distilled water. Using a wash bottle, I transferred the washed precipitate from the filter into a small beaker.
I added 56% nitric acid to the precipitate drop by drop. Carbon dioxide bubbles immediately began to evolve. Most of the solid phase dissolved, and the gas evolution gradually ceased. However, the solution remained cloudy, and white particles floated on the surface; these did not dissolve even after additional portions of nitric acid were added. This indicated that, during boiling with the sodium carbonate solution, most of the barium sulfate had been converted to barium carbonate. The barium carbonate dissolved in the nitric acid to form barium nitrate. Meanwhile, a portion of the original barium sulfate did not react with the sodium carbonate. Unlike barium carbonate, barium sulfate did not dissolve when treated with nitric acid, leading to incomplete dissolution of the solid.
Thus, the undissolved residue consisted of barium sulfate that had not participated in the reaction with sodium carbonate during boiling. The solution contained barium nitrate.
To confirm the presence of barium cations, I filtered the liquid through paper and collected the filtrate in a beaker. A 35% sulfuric acid solution (an electrolyte for lead-acid batteries) was added dropwise. The solution immediately turned white and opaque due to the formation of barium sulfate, confirming the presence of barium ions.
Therefore, when barium sulfate is boiled with an excess of sodium carbonate solution, most of it converts to barium carbonate.
The boiling was carried out without additional stirring. I believe that using a magnetic stirrer with heating would have significantly accelerated the reaction.
|
Реакция сульфата бария с карбонатом натрия (заключительная часть) - Часть 8
После кипячения осадка со свежей порцией карбоната натрия, оставил стакан на ночь. Утром отфильтровал осадок сквозь бумажный фильтр, тщательно промыл его дистиллированной водой. Промытый осадок перенес с фильтра в маленький стаканчик с помощью промывалки.
К осадку прибавил 56% азотную кислоту по капле. Сразу же началось выделение пузырьков углекислого газа. Большая часть твердой фазы растворилась. Выделение газа прекратилось. Однако, раствор остался мутным, а на поверхности жидкости плавали белые частицы, которые не растворились при добавлении новых порций азотной кислоты.
Таким образом, при кипячении с раствором карбоната натрия, большая часть сульфата бария перешла в карбонат бария. Карбонат бария растворился в азотной кислоте, образуя нитрат бария. Однако, часть сульфата бария не прореагировала с карбонатом натрия. В отличие от карбоната бария, сульфат бария не перешел в раствор при обработке осадка азотной кислотой - следовательно, растворение осадка было неполным.
Итак, не растворившийся осадок представлял собой сульфат бария, который не вступил в реакцию с карбонатом натрия при кипячении. Раствор содержал нитрат бария.
Чтобы подтвердить наличие катионов бария в растворе, профильтровал жидкость сквозь бумажный фильтр. Фильтрат собрал в стакан и добавил к нему по каплям 35% раствор серной кислоты (электролит для свинцовых аккумуляторов). Раствор сразу стал белым и непрозрачным из-за образования сульфата бария - наличие бария в растворе доказано.
Таким образом, при кипячении сульфата бария с избытком раствора карбоната натрия, большая часть сульфата бария превратилась в карбонат.
Кипячение проводилось без дополнительного перемешивания. Думаю, что использование магнитной мешалки с нагревом значительно ускорило бы данную реакцию.
|

Reaction of Barium Sulfate with Sodium Carbonate (Final Part)
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
Комментарии
К1
Тот сульфат бария, который используют в медицине, обязан не содержать карбоната. Хотя, прецедент был, и на форуме обсуждался..
|
|