Experiments with Sparingly Soluble Calcium, Strontium, and Barium Salts - pt.9, 10
Chemist
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Although barium sulfate is about ten times less soluble than barium carbonate, it was nevertheless successfully converted to the carbonate in the previous experiment by boiling it with a soda ash solution. This inspired the next experiment.
The solubility of calcium sulfate in water is approximately 0.21 g/100 ml, while that of calcium carbonate is 0.0015 g/100 ml (at 20°C). Unlike the corresponding barium salts, calcium carbonate is less soluble in water than the sulfate; their solubility differs by about 140 times.
**Question:** Is it possible to convert calcium carbonate into calcium sulfate by reacting it with an excess of sodium sulfate solution, even though calcium carbonate is much less soluble? I estimated the chances of success to be low. Moreover, I doubted the practical value of converting chalk and sodium sulfate into gypsum and sodium carbonate. However, I was curious to see whether this reaction would occur, especially since the starting materials are inexpensive and readily available.
I arrived at the lab even though the power in the area was about to go out. I wanted to start the experiment quickly so I could boil the mixture for as long as possible. My first problem was finding the reagents. I found the calcium carbonate quickly, and then began looking for sodium sulfate. It is cheap and commonly available, but I did not have any on hand. I reviewed all the reagent lists in the lab but did not see sodium sulfate. Perhaps we did not have it? I wanted to ask a colleague, but he had not come to work because the power was expected to be shut down.
I carefully checked the lists again and found sodium sulfate on the last page. I opened the box where it was supposed to be stored and began removing bottles one by one, reading the labels. I found several rare and expensive substances, but still no sodium sulfate. Then I found ammonium sulfate, but it was unsuitable for this experiment because it partially hydrolyzes, forming sulfuric acid, which reacts with carbonates. With similar success, one could simply react calcium carbonate with sulfuric acid.
The sodium sulfate was in the last jar I pulled from the box. Since the search had taken longer than expected, I now had to work against the clock.
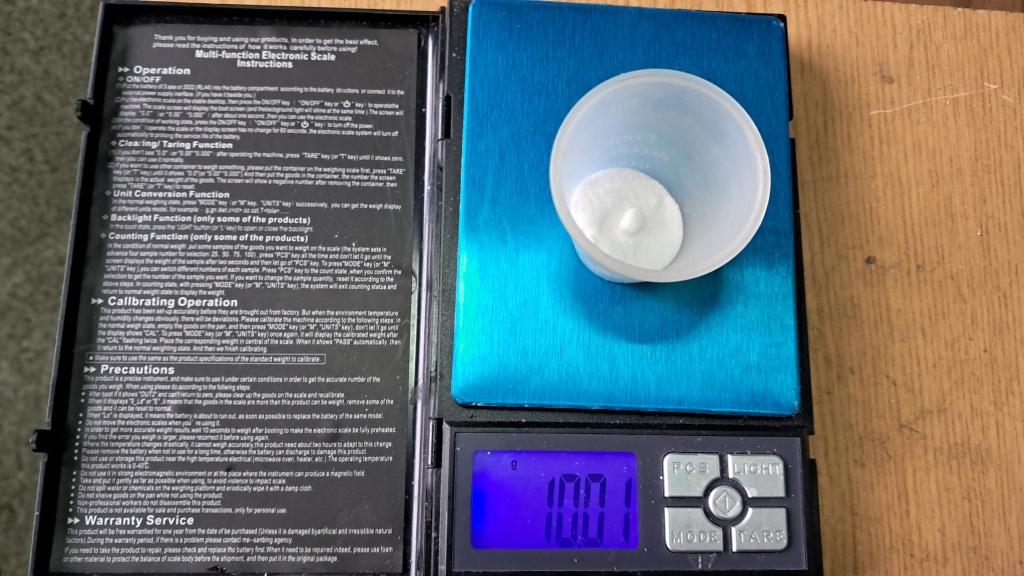
I weighed 0.36 g of calcium carbonate into a beaker, added 10 g of anhydrous sodium sulfate and 100 ml of water. I placed the beaker on a hot plate and covered it with a Petri dish. Then I became distracted with other work. A little later, I returned to the hot plate - the solution was boiling, the calcium carbonate had gathered mostly at the bottom, and the Petri dish… had disappeared. Had it fallen from the beaker because of vigorous boiling? I searched for the dish - it was nowhere to be seen. Then I noticed it on the floor about a meter and a half away from the beaker; to my surprise, the glass dish had not broken.
I covered the beaker with another, heavier Petri dish. The liquid boiled and foamed vigorously. To improve mixing, I placed a magnetic stir bar into the beaker and periodically moved the beaker from the hot plate to the magnetic stirrer. As the liquid evaporated, I added more distilled water. I managed to boil the mixture for an hour and then left it to stand overnight.
**What was my plan next?** If calcium carbonate partially converts to calcium sulfate in the solid phase, then a small portion of the sodium sulfate in the solution converts to sodium carbonate. The solid phase should then be filtered, and the filtrate collected in a separate beaker. Afterward, the solid should be rinsed thoroughly on the filter and transferred to a small beaker.
Then the filtrate should be analyzed. First, measure its pH; if sodium carbonate is present, the solution will be slightly alkaline. Next, add nitric acid to the filtrate. If sodium carbonate is present, carbon dioxide will be released.
Next, analyze the solid phase. Add an excess of nitric acid dropwise. Carbon dioxide will be released, and the calcium carbonate will dissolve. If some of the calcium carbonate converted to sulfate, a white suspension will appear, since calcium sulfate does not dissolve in nitric acid. If the solid dissolves completely, no calcium sulfate is present.
**Caution 1.** Calcium carbonate reacts with atmospheric carbon dioxide and water to form calcium bicarbonate. This can lead to bicarbonate anions in the solution, which release carbon dioxide when exposed to acids. To avoid this, heat the solution and boil it before filtering, then filter it hot. Calcium bicarbonate decomposes upon boiling.
**Caution 2.** Calcium sulfate is poorly soluble in water, but its solubility cannot be neglected in this experiment. It dissolves even better in dilute nitric acid. As the acid concentration increases, its solubility first increases, reaching a maximum around 10% HNO3, and then decreases. If only a small amount of calcium sulfate is present in the solid, it may dissolve completely in nitric acid. Therefore, use a minimal amount of water when transferring the precipitate from the filter to the beaker, and add 56% nitric acid.
The next day, I gradually heated the contents of the beaker to boiling, boiled it for about an hour, and then filtered the solution without letting it cool. A pleasant surprise occurred: large, rod-shaped crystals of sodium sulfate formed in the flask containing the filtrate. Some of them were as long as the diameter of the flask (8 cm).
I decanted the solution from the crystals and measured its pH with indicator paper. The solution was slightly alkaline, with a pH of about 8. This indirectly confirmed the presence of sodium carbonate in the solution. Meanwhile, sodium sulfate crystals continued to form.
I added 56% nitric acid to the solution. No carbon dioxide evolution was observed. Carbonate ions were not detected. This result contradicts the possibility of a reaction between calcium carbonate and sodium sulfate during boiling. However, if the carbonate concentration is very low, carbon dioxide evolution may not be noticeable.
I then examined the precipitate. I added 56% nitric acid dropwise to the solid transferred to the beaker. Carbon dioxide was released, and the calcium carbonate dissolved. However, despite the excess nitric acid, some of the solid remained suspended. These particles did not dissolve even when the pH reached 0. **Conclusion:** the undissolved residue was calcium sulfate.
Thus, when boiling calcium carbonate with an excess of sodium sulfate solution, part of the calcium carbonate converted to calcium sulfate, which did not dissolve in nitric acid.
**Question: Have we forgotten anything?**
|
Реагирует ли карбонат кальция с сульфатом натрия? - Часть 9
Несмотря на то, что сульфат бария примерно в 10 раз меньше растворим в воде, чем карбонат бария, в предыдущем эксперименте удалось превратить сульфат бария в карбонат действием раствора кальцинированной соды. Это подсказало идею для следующего эксперимента.
Растворимость сульфата кальция в воде составляет примерно 0.21 г/100 мл, карбоната кальция - 0.0015 г/100 мл (при 20°С). В отличие от соответствующих солей бария, карбонат кальция меньше растворим в воде, чем сульфат, причем их растворимость отличается примерно в 140 раз.
**Вопрос**: можно ли превратить карбонат кальция в сульфат кальция, используя реакцию карбоната кальция с избытком раствора сульфата натрия - несмотря на то, что карбонат кальция гораздо меньше растворим? Я оценивал шанс успеха такого эксперимента как низкий. Более того, сомневаюсь в практической ценности превращения мела и сульфата натрия в гипс и карбонат натрия. Зато было любопытно, произойдет ли данная реакция? Тем более, что исходные вещества дешевые и доступные.
Пришел в лабораторию, несмотря на то, что в этом районе скоро должны были отключить электричество. Хотел побыстрее начать эксперимент, чтобы успеть прокипятить смесь как можно дольше. Первая проблема: я должен был найти реактивы. Карбонат кальция нашел быстро, стал искать сульфат натрия. Реактив дешевый и доступный, но под рукой его не оказалось. Пересмотрел все списки реактивов, которые были в лаборатории, - сульфата натрия в списках не нашел. Может, его у нас нет? Хотел попросить у коллеги, но он не пришел на работу из-за скорого отключения электричества. Внимательно пересмотрел списки еще раз - на последней странице нашел сульфат натрия. Открыл коробку, в которой должен быть данный реактив, стал доставать баночки, читая этикетки. Нашел несколько редких и дорогих веществ, но сульфата натрия все не было. Затем нашел сульфат аммония, однако это вещество не подходило для данного эксперимента, поскольку сульфат аммония частично гидролизует, образуя серную кислоту, которая реагирует с карбонатами. С аналогичным успехом можно было бы провести реакцию карбоната кальция с серной кислотой.
Сульфат натрия оказался в последней баночке, которую я достал из коробки. Поскольку поиск затянулся, работать пришлось наперегонки со временем.
Взвесил в стакане 0.36 г карбоната кальция, добавил к нему 10 г безводного сульфата натрия и 100 мл воды. Поставил стакан греться на плитку, накрыл чашкой Петри. Вынужденно отвлекся, поскольку одновременно была другая работа. Чуть позже подошел к плитке - раствор кипел, карбонат кальция сосредоточился преимущественно на дне, а чашка Петри... исчезла. Упала из-за бурного кипения жидкости? Ищу чашку - ее нигде нет. Потом обнаружил чашку на полу на расстоянии полтора метра от стакана, к моему удивлению стеклянная чашка Петри не разбилась.
Накрыл стакан другой - более массивной - чашкой Петри. Жидкость кипела и активно пенилась. Для улучшения перемешивания поместил в стакан магнитный якорь и время от времени переставлял стакан с плитки на магнитную мешалку. По мере испарения, добавлял в стакан новые порции дистиллированной воды. Успел прокипятить стакан в течение часа. Оставил стоять на ночь.
**Что я планировал дальше?** Если в твердой фазе карбонат кальция частично превращается в сульфат кальция, это значит что, в растворе небольшая часть сульфата натрия превращается в карбонат натрия. Твердую фазу необходимо отфильтровать, фильтрат собрать в отдельный стакан. Далее, твердую фазу тщательно промыть на фильтре и перенести в маленький стаканчик.
Затем исследовать фильтрат. Сначала измерить рН фильтрата: если присутствует карбонат натрия, раствор будет слабощелочным. Далее добавить к фильтрату азотную кислоту. Если в растворе присутствует карбонат натрия, выделится углекислый газ.
После этого исследовать твердую фазу. Добавить к ней по капле избыток азотной кислоты. Выделится углекислый газ, карбонат кальция растворится. Если часть карбоната кальция превратилась в сульфат, образуется белая суспензия, поскольку сульфат кальция в азотной кислоте не растворится. Если твердая фаза растворяется полностью, сульфат кальция в ней отсутствует.
**Предостережение 1.** Карбонат кальция реагирует с углекислым газом воздуха и водой, переходя в раствор гидрокарбоната кальция. В результате в растворе могут оказаться анионы гидрокарбоната, которые выделяют углекислый газ при действии кислот. Чтобы избежать этого, раствор перед фильтрованием следует нагреть до кипения и фильтровать горячим. При кипячении гидрокарбонат кальция разлагается.
**Предостережение 2**. Сульфат кальция плохо растворяется в воде, однако в данном эксперименте его растворимостью пренебрегать нельзя. В разбавленной азотной кислоте сульфат кальция растворяется лучше. С увеличением концентрации кислоты, растворимость соли сначала возрастает, достигает максимума примерно при 10% HNO3, а затем уменьшается. Если в твердой фазе присутствует лишь небольшое количество сульфата кальция, вещество может полностью раствориться в азотной кислоте. Следовательно, необходимо использовать минимальное количество воды для перенесения осадка с фильтра в стакан и добавлять 56% азотную кислоту.
На следующий день повторно нагрел раствор в стакане до кипения, кипятил примерно час, затем профильтровал раствор, не дав ему остыть. Произошла приятная неожиданность - в колбе с фильтратом образовались огромные кристаллы сульфата натрия в форме палочек. Длина некоторых из них была равна диаметру колбы (8 см).
Декантировал раствор с кристаллов, измерил его рН индикаторной бумагой. Раствор оказался слабощелочным с рН около 8. Это косвенно подтверждало наличие в растворе карбоната натрия. Тем временем из раствора продолжали выпадать кристаллы сульфата натрия.
Добавил к раствору 56% азотную кислоту. Выделение углекислого газа не наблюдалось. Ионы карбоната в растворе не обнаружены. Данный факт отрицает протекание реакции между карбонатом кальция и сульфатом натрия при кипячении. Однако, если карбоната в растворе мало, выделения углекислого газа можно не заметить.
Перешел к исследованию осадка. К осадку, перенесенному в стаканчик, по каплям добавил 56% азотную кислоту. Выделился углекислый газ, карбонат кальция растворился. Однако, несмотря на избыток азотной кислоты, часть твердой фазы осталась в виде суспензии. Твердые частицы не растворились в кислоте, даже когда рН раствора был равен 0. **Вывод**: не растворившийся остаток представлял собой сульфат кальция.
Таким образом, при кипячении карбоната кальция с избытком раствора сульфата натрия часть карбоната кальция превратилась в сульфат, который не растворился в азотной кислоте.
**Вопрос: а мы ничего не забыли?**
|

I'm looking for sodium sulfate...
|

Sodium sulfate
|

|

Calcium carbonate
|
Sodium sulfate
|

Boiling of calcium carbonate with sodium sulfate
|

|

|

|

|

|

|

|

|

Filtration
|

|

|

Sodium sulfate crystals
|

|

|

|

|

The pH of the filtrate was ~8
|

|

|

I added 56% nitric acid to the filtrate. No carbon dioxide evolution was observed
|

|

I added 56% nitric acid dropwise to the solid transferred from the filter to the beaker. Carbon dioxide was released, and the calcium carbonate dissolved. However, despite the excess nitric acid, some of the solid remained suspended
|

|

|

|

The solid particles did not dissolve even when the pH reached 0
|

|

|

|
A small amount of nitric acid came into contact with my hand
|
Комментарии
К1
При кипячении равновесие реакции сдвигается в сторону образования гипса благодаря тому, что его растворимость уменьшается с температурой.
А что, если в оформлении опыта вместо кипения применить колонку? Насыпать в неё мел и пропускать раствор сульфата натрия.
Правда потом, когда колонка загипсуется, извлечь сульфат кальция из неё будет затруднительно. Да и в процессе наступит момент, когда раствор перестанет поступать. Надо что-нибудь придумать против этого.
P.S. Если добавить фенолфталеин, опыт будет нагляднее, но я не уверен, что фенолфталеин работает в кипящем растворе.
К1-1
Спасибо.
С мелом и сульфатом натрия - там все не совсем так, как казалось сразу. Вышло поучительно. На момент написания Части 9 я уже закончил эксперименты, однако, нужно время, чтобы описать, подбирая периоды, когда есть электричество.
|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
In the previous experiment, calcium carbonate was treated with a boiling solution of sodium sulfate, then filtered and dissolved in 56% nitric acid. The dissolution was incomplete, leading to the conclusion that some of the calcium carbonate had converted into calcium sulfate.
What did we overlook? I should have performed a control experiment. It is necessary to ensure that the starting materials do not contain impurities that could distort the results. Only then can a conclusion be drawn about the possibility of a reaction between calcium carbonate and sodium sulfate.
A residue insoluble in nitric acid could be due to impurities present in the starting materials. In particular, the calcium carbonate may contain substances that do not dissolve in acid. To rule out this possibility, the starting calcium carbonate should be treated with an excess of nitric acid to verify that it dissolves completely.
Next, it is necessary to check whether the sodium sulfate dissolves in distilled water without forming a solid residue.
I weighed 0.4 g of calcium carbonate in a small beaker and added 56% nitric acid to it in small portions. Vigorous evolution of carbon dioxide began immediately and soon ceased. I expected a clear, colorless solution to form. However, once the reaction had stopped, the liquid remained cloudy. I added more nitric acid, even though the pH of the solution was already 0. Nevertheless, the solid phase did not dissolve - the solution remained cloudy.
A similar result was obtained in the previous experiment, where the pre-treated calcium carbonate, rather than the original calcium carbonate, was dissolved in nitric acid. At that time, I concluded that some of the chalk had converted to gypsum as a result of the reaction with sodium sulfate, and that the resulting calcium sulfate did not dissolve in nitric acid. However, the original calcium carbonate, when reacted with nitric acid, also left an insoluble residue.
It is reasonable to conclude that the original calcium carbonate contained an impurity insoluble in nitric acid. In the previous experiment, after dissolving the chalk in the acid, it was this impurity - not calcium sulfate - that formed the suspension.
Seeing that the chalk had not completely dissolved in nitric acid, I took an illogical step: I added distilled water to the suspension and stirred. Why was this illogical? If the substance did not dissolve in 56% nitric acid, it seemed unlikely that it would dissolve in water.
Unexpectedly, the white suspension turned into a clear solution - the solid phase had dissolved.
Therefore, the white precipitate was a substance highly soluble in water but poorly soluble in nitric acid. I assumed it was calcium nitrate. I remembered that calcium nitrate is highly soluble in water (121.2 g per 100 ml at 20°C). However, I had never considered whether calcium nitrate dissolves in nitric acid. I assumed that this salt is poorly soluble in nitric acid, because I remembered a similar example.
Sodium chloride dissolves well in water, but it is poorly soluble in concentrated hydrochloric acid. If concentrated hydrochloric acid is added to a saturated aqueous solution of sodium chloride, the salt precipitates. One book even claims that weak luminescence is observed during the crystallization of sodium chloride.
Another example: sodium reacts violently with water - small pieces ignite, and larger pieces explode. However, sodium reacts with concentrated hydrochloric acid without flame or explosion. The metal floats on the surface of the acid, releasing hydrogen and producing occasional sparks. A film of poorly soluble sodium chloride forms on the surface of the metal, inhibiting a violent reaction.
[Warning: I used pieces of sodium approximately half a centimeter in size for this experiment. If a larger piece is used, an explosion cannot be ruled out. Moreover, potassium metal explodes under these conditions, even though potassium chloride is also poorly soluble in concentrated hydrochloric acid.]
A literature search confirmed that calcium nitrate is poorly soluble in nitric acid. Its solubility in aqueous nitric acid solutions is intermediate between its solubility in pure water and in pure nitric acid.
Therefore, when dissolving chalk in 56% nitric acid, a precipitate of calcium nitrate formed - another poorly soluble calcium salt. When distilled water was added, the precipitate dissolved.
Thus, the conclusion reached at the end of Part 9 was incorrect. The formation of a white precipitate after dissolving calcium carbonate in the acid was not due to the conversion of some of the chalk to gypsum, but rather to the poor solubility of calcium nitrate in nitric acid.
To record a video of the reaction, I poured approximately 15 ml of 56% nitric acid into a beaker and added calcium carbonate in small portions (the nitric acid was in excess). Gas was released, and the solution soon became white and turbid. As the mixture stood, a white precipitate of calcium nitrate formed.
I added distilled water to the beaker, increasing the volume to 30 ml, and stirred. The precipitate dissolved, forming a clear, colorless solution.
|
Контрольный эксперимент: еще одна нерастворимая соль кальция - Часть 10
В прошлом эксперименте карбонат кальция был обработан кипящим раствором сульфата натрия, затем отфильтрован и растворен в 56% азотной кислоте. Растворение оказалось неполным, на основе данного факта был сделан вывод, что часть карбоната кальция превратилась в сульфат кальция.
Что мы забыли? Мне следовало провести контрольный эксперимент. Необходимо убедиться, что исходные вещества не содержат примесей, способных исказить результаты. А только после этого следует делать вывод, относительно возможности реакции карбоната кальция с сульфатом натрия.
Остаток, нерастворимый в азотной кислоте, мог быть обусловлен наличием примесей в исходных веществах. В частности, карбонат кальция мог содержать примеси веществ, нерастворимых в кислоте. Чтобы исключить такую возможность, необходимо обработать исходный карбонат кальция избытком азотной кислоты и убедиться, что вещество растворяется полностью.
Далее необходимо проверить, растворяется ли исходный сульфат натрия в дистиллированной воде, не образуя твердого остатка.
В стаканчике взвесил 0.4 г карбоната кальция и добавил к нему 56% азотную кислоту небольшими порциями. Произошло активное выделение углекислого газа, которое вскоре прекратилось. Я ожидал, что образуется прозрачный и бесцветный раствор. Однако, после прекращения реакции жидкость так и осталась мутной. Добавил больше азотной кислоты, хотя рН раствора уже был равен 0. В результате твердая фаза не растворилась - раствор оставался мутным.
Аналогичный результат имел место в прошлом эксперименте, когда я растворил в азотной кислоте не исходный карбонат кальция, а карбонат кальция, предварительно обработанный сульфатом натрия при кипячении. Тогда я сделал вывод, что часть мела превратилась в гипс в результате реакции с сульфатом натрия, и что образовавшийся сульфат кальция затем не растворился в азотной кислоте. Однако, исходный карбонат кальция, реагируя с азотной кислотой, также дал нерастворимый остаток.
Логично сделать вывод, что исходный карбонат кальция содержал примесь, нерастворимую в азотной кислоте. В прошлом эксперименте после растворения мела в кислоте именно данная примесь образовала суспензию, а не сульфат кальция.
Увидев, что мел растворился в азотной кислоте не полностью, я совершил нелогичное действие - добавил к суспензии дистиллированную воду и перемешал. Почему это было нелогичным? Если вещество не растворилось в 56% азотной кислоте, было крайне маловероятным, что оно растворится в воде.
Неожиданно белая суспензия превратилась в прозрачный раствор - твердая фаза растворилась!
Следовательно, белый осадок представлял собой вещество, хорошо растворимое в воде, но плохо растворимое в азотной кислоте. Предположил, что это - нитрат кальция. Я помнил, что нитрат кальция прекрасно растворяется в воде (121.2 г/100 мл при 20°C). Однако, я раньше даже не задумывался, растворяется ли нитрат кальция в азотной кислоте? Предположил, что данная соль плохо растворима в азотной кислоте, поскольку помнил аналогичный пример.
Хлорид натрия хорошо растворяется в воде, однако, он плохо растворим в концентрированной соляной кислоте. Если к насыщенному водному раствору хлорида натрия добавить концентрированную соляную кислоту, соль выпадет в осадок. В одной книге даже утверждается, что при этом в процессе кристаллизации хлорида натрия наблюдается слабая люминесценция.
Другой пример. Натрий бурно реагирует с водой, маленькие кусочки металла загораются, большие куски - взрываются. Зато с концентрированной соляной кислотой натрий реагирует без вспышки и взрыва - металл плавает по поверхности кислоты, выделяя водород и отбрасывая отдельные искры. На поверхности натрия образуется пленка труднорастворимого хлорида натрия, которая препятствует бурной реакции.
[Предупреждение: я использовал для данного эксперимента куски натрия размером примерно полсантиметра. Если взять большой кусок натрия, нельзя исключить, что произойдет взрыв. Кстати, металлический калий в этих условиях взрывается, хотя хлорид калия также плохо растворим в концентрированной соляной кислоте].
Литературный поиск подтвердил, что нитрат кальция плохо растворим в азотной кислоте. Растворимость данной соли в водных растворах азотной кислоты занимает промежуточное положение между растворимостью нитрата кальция в чистой воде и в чистой азотной кислоте.
Следовательно, при растворении мела в 56% азотной кислоте образовался осадок нитрата кальция - еще одной малорастворимой соли кальция! Добавление дистиллированной воды вызвало растворение осадка.
Таким образом, вывод, сделанный в конце части 9, оказался ошибочным. Образование белого осадка после растворения карбоната кальция в кислоте было обусловлено не превращением части мела в гипс, а тем фактом, что нитрат кальция плохо растворим в азотной кислоте.
Чтобы снять видео реакции, налил в стакан примерно 15 мл 56% азотной кислоты и добавлял карбонат кальция небольшими порциями (азотная кислота была в избытке). Выделился газ, вскоре раствор стал бело-мутным. При стоянии жидкости выпал белый осадок нитрата кальция.
Добавил в стакан дистиллированную воду, доведя объем жидкости до 30 мл, перемешал. Осадок растворился, образуя прозрачный и бесцветный раствор.
|

Sodium sulfate and calcium carbonate
|

Reaction of 56% nitric acid with calcium carbonate
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|

|

|
|