Experiments with Sparingly Soluble Calcium, Strontium, and Barium Salts - pt.11, 11
Chemist
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Barium sulfate is practically insoluble in water and in dilute acids. However, the solubility of any compound varies depending on the solvent. According to the literature, this salt is soluble in concentrated sulfuric acid. On the one hand, sulfuric acid contains the same anion as barium sulfate—SO42-—which should reduce the solubility of barium sulfate in its presence. On the other hand, in concentrated sulfuric acid, the sulfate anion is partially converted to the hydrogen sulfate anion, which significantly increases the solubility of barium sulfate:
2BaSO4 + H2SO4 <=> 2Ba(HSO4)2
I initially planned the experiment as follows: pour a known mass of concentrated sulfuric acid into a test tube or cylinder. Add an excess of barium sulfate to ensure that some of the salt remains undissolved once equilibrium is reached. Mix the substances thoroughly, seal the test tube tightly, and leave the mixture to stand for several hours. Some of the salt should dissolve, and the undissolved portion should settle to the bottom. Carefully pipette the clear solution (to avoid disturbing the precipitate) and pour it into a large volume of water. A white suspension of barium sulfate should form immediately, since this salt is very poorly soluble in water and in dilute sulfuric acid.
If the barium sulfate particles do not settle but instead form a stable suspension in sulfuric acid, they must be centrifuged or filtered through a fritted-glass filter. Paper filters are unsuitable.
It would also be reasonable to heat a mixture of barium sulfate and concentrated sulfuric acid. Heating would probably increase the solubility of barium sulfate, and even if it did not, it would certainly increase the rate of dissolution. Nevertheless, I decided to keep the procedure simple and to carry out the experiment at room temperature.
I shared my plans with a colleague. He said, "I tried that once. You need freshly precipitated barium sulfate, and the reagent you have isn't suitable. Besides, I added barium sulfate to sulfuric acid in small portions - it doesn't dissolve well."
I am not sure whether my colleague actually performed this experiment in the past. However, I do know that he has a habit of overcomplicating things. Sometimes he makes an experiment as complicated as possible and then complains that he lacks the necessary materials. For example, where ordinary fiberglass from a local hardware store would work perfectly well, he insists on using exclusive Nafion membranes with precisely defined porosity — materials that are difficult to obtain even at a high price.
His comment, however, made me reconsider the plan. Instead of adding a large excess of barium sulfate to the sulfuric acid immediately, it would be better to proceed differently: add a small portion of barium sulfate to the acid, stir, and let the mixture stand for a few hours. If the salt dissolves, add the next portion, stir, wait again, and continue this sequence until the next portion stops dissolving.
This approach should be sufficient to demonstrate the dissolution of barium sulfate in sulfuric acid. After dissolution ceases, the solid particles can be allowed to settle to the bottom of the test tube. Then the clear liquid can be drawn into a pipette and poured into a large volume of water to demonstrate the precipitation of barium sulfate.
I did not know the solubility of barium sulfate in concentrated sulfuric acid, but I expected it to be about 0.1 g per 100 g of the acid.
I poured 11.735 g of concentrated sulfuric acid into the test tube. The exact concentration of the acid was unknown; the seller claimed 96-98%. I did not verify this, as the exact concentration (e.g., 92% or 96%) was not relevant to my previous work.
I added 0.100 g of technical-grade barium sulfate to the sulfuric acid. The salt slowly settled to the bottom. I sealed the test tube and shook it vigorously. This method proved ineffective - the sulfuric acid was too viscous. I had to stir the mixture with a glass rod. Then I sealed the test tube again and let it stand.
Over time, most of the barium sulfate dissolved, leaving a small amount of sediment at the bottom. I stirred the mixture with a glass rod, sealed the tube, and let it stand again. All of the barium sulfate dissolved, forming a slightly cloudy solution.
I added two portions of barium sulfate, each 0.125 g, stirring occasionally and allowing the mixture to stand. The solid phase gradually dissolved, although the solution remained slightly cloudy.
In total, 0.35 g of barium sulfate dissolved in the sulfuric acid.
I then decided to add a clear excess of barium sulfate to ensure that the solution became saturated and that a portion of the salt remained undissolved. I added 0.725 g of barium sulfate to the test tube, stirred periodically, and left it overnight. Imagine my surprise when I found the next morning that the liquid in the test tube was transparent — and that there was no sediment at the bottom! As in the previous cases, the solution was slightly whitish-turbid, which can be explained by impurities in the technical-grade reagent or by incomplete dissolution of a small portion of the barium sulfate.
Thus, 1.075 g of barium sulfate dissolved in 11.735 g of concentrated sulfuric acid. The concentration of the resulting solution was 9.2%.
Once again, I weighed 1.000 g of barium sulfate, added it to the test tube, stirred the mixture, and left it overnight. This time, I was confident that most of the barium sulfate would remain undissolved.
|
Растворение сульфата бария в концентрированной серной кислоте - Часть 11
Сульфат бария практически нерастворим в воде и разбавленных кислотах. Однако растворимость любого соединения варьируется в зависимости от растворителя. Согласно литературе, данная соль растворима в концентрированной серной кислоте. С одной стороны, серная кислота имеет общий с сульфатом бария анион—SO42-—, что должно уменьшать растворимость сульфата бария в присутствии серной кислоты. С другой стороны, в концентрированной серной кислоте сульфат-анион частично переходит в гидросульфат, благодаря чему растворимость сульфата бария значительно возрастает.
2BaSO4 + H2SO4 <=> 2Ba(HSO4)2
Я планировал провести эксперимент следующим образом. В пробирку или цилиндр налить концентрированную серную кислоту известной массы. Добавить к ней избыток сульфата бария, чтобы после наступления равновесия часть соли осталась в нерастворенном виде. Вещества тщательно перемешать, герметично закрыть пробирку и оставить смесь на несколько часов. Часть соли растворится, а не растворившийся сульфат бария должен осесть на дно. Аккуратно отобрать прозрачный раствор сульфата бария пипеткой (чтобы не взмутить осадок) и вылить его в большое количество воды. Моментально должна образоваться белая суспензия сульфата бария, поскольку данная соль очень плохо растворима в воде и в разбавленной серной кислоте.
Если частицы сульфата бария не осядут полностью, а образуют устойчивую суспензию в серной кислоте, ее придется центрифугировать или фильтровать сквозь фильтр из пористого стекла. Бумажные фильтры для этой цели не подходят.
Логично также нагреть смесь сульфата бария с концентрированной серной кислотой. Скорее всего, при нагревании растворимость сульфата бария увеличится. Даже, если растворимость сульфата бария в серной кислоте не будет возрастать с температурой, при нагревании увеличится скорость растворения твердой фазы. Однако, я решил не усложнять процедуру и провести эксперимент при комнатной температуре.
Поделился своими планами с коллегой. Он ответил.
- Я как-то пробовал. Нужен свежеосажденный сульфат бария, а тот реактив, который есть у тебя, не подходит. Кроме того, я добавлял сульфат бария в серную кислоту небольшими порциями - он плохо растворяется.
Я не уверен, действительно ли коллега проводил этот экспермиент в прошлом. Зато я знаю наверняка, что он привык все усложнять. Временами он усложняет эксперимент до невозможности, а потом жалуется, что у него нет необходимых материалов. Например, там, где хорошо подойдет обычная стеклоткань, которая продается в ближайшем супермаркете, коллега будет утверждать, что нужны эксклюзивные мембраны из материала Nafion со строго заданной пористостью, которые проблематично купить даже за большие деньги.
Однако, слова коллеги заставили меня задуматься и изменить план эксперимента. Вместо того, чтобы сразу добавить к серной кислоте избыток сульфата бария, целесообразно поступить иначе. Добавить в кислоту небольшую порцию сульфата, перемешать, оставить на несколько часов. Если соль растворится, добавить следующую порцию, перемешать, подождать пока новая порция растворится. Повторять эту последовательность действий до тех пор, пока очередная порция сульфата бария не перестанет растворяться.
Данной процедуры уже достаточно, чтобы продемонстрировать растворение сульфата бария в серной кислоте. Дополнительно, после прекращения растворения можно дождаться осаждения твердых частиц на дно пробирки. Затем набрать жидкую фазу в пипетку и вылить ее в большое количество воды, чтобы продемонстрировать осаждение сульфата бария.
Какая растворимость сульфата бария в концентрированной серной кислоте, я не знал, но ожидал, что она составляет порядка 0.1 г на 100 г кислоты.
Налил в пробирку 11.735 г концентрированной серной кислоты. Точная концентрация кислоты была неизвестна, продавец утверждал, что она составляла 96-98%. Я эти данные не проверял, поскольку точная концентрация кислоты (например, 92 или 96%) для моих прошлых работ не имела значения.
Добавил к серной кислоте 0.100 г сульфата бария технической квалификации. Соль медленно опустилась на дно. Герметично закрыл пробирку, затем интенсивно встряхнул ее. Такой способ перемешивания оказался неэффективным — серная кислота слишком вязкая. Пришлось воспользоваться стеклянной палочкой. Снова закрыл пробирку, оставил стоять.
Со временем большая часть сульфата бария растворилась. Небольшая часть соли осталась на дне. Перемешал содержимое пробирки стеклянной палочкой, закрыл пробирку, оставил стоять. Весь сульфат бария растворился, образуя слегка мутный раствор.
Дважды добавлял в пробирку порции сульфата бария весом по 0.125 г, оставил пробирку стоять, периодически перемешивая смесь. Твердая фаза постепенно растворилась, хотя раствор остался слегка мутным.
Суммарно в серной кислоте растворилось 0.35 г сульфат бария.
Решил добавить избыток сульфата бария, чтобы образовался насыщенный раствор, и часть соли осталась в осадке. Добавил в пробирку 0.725 г соли, периодически перемешал содержимое, оставил на ночь. Представьте мое удивление, когда утром обнаружил, что жидкость в пробирке была прозрачная, и осадок на дне отсутствовал! Аналогично предыдущим случаям, раствор был слегка бело-мутным, что может быть объяснено примесями в техническом реактиве или неполным растворением небольшой части сульфата бария.
Таким образом, 1.075 г сульфата бария растворилось в 11.735 г концентрированной серной кислоты. Концентрация образовавшегося раствора составляла 9.2%.
Снова, взвесил 1.000 г сульфата бария, добавил его в пробирку, перемешал содержимое и оставил стоять на ночь. Не сомневался, что в этот раз большая часть сульфата бария не растворится.
|

Dissolution of Barium Sulfate in Concentrated Sulfuric Acid
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
I left the sulfuric acid - barium sulfate mixture overnight. Meanwhile, I began searching the literature for the solubility of barium sulfate in concentrated sulfuric acid. According to the authors [1], the solubility of this salt in 100% sulfuric acid is quite significant. The concentration of a saturated barium sulfate solution is 15.89% at 25°C. As the water content of sulfuric acid increases, the solubility of barium sulfate decreases sharply, as can be seen from the table:
Let us return to our experiment. I added 2.075 g of barium sulfate to 11.735 g of concentrated sulfuric acid, which corresponds to a barium sulfate solution concentration of 15.03%. Such a solution can form only if the concentration of the starting sulfuric acid is 99.5% or higher. Considering that the acid concentration I used was no higher than 98%, some barium sulfate should remain as a precipitate.
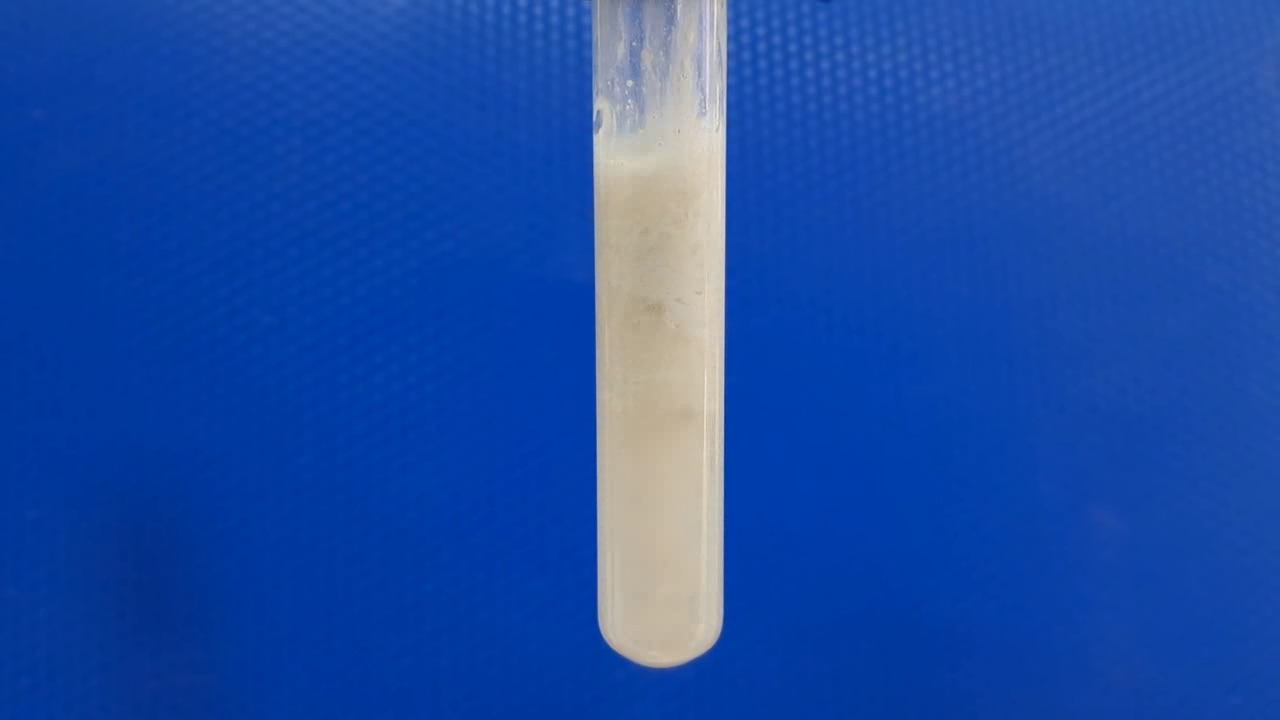
The next day, I discovered that a barium sulfate precipitate had formed in the test tube, with a slightly turbid liquid above it. This liquid was a saturated solution of barium sulfate in concentrated sulfuric acid.
I poured 800 ml of tap water into a beaker (distilled water is not necessary for this purpose). I then added 1 ml of the barium sulfate solution in concentrated sulfuric acid. A white suspension immediately formed. I stirred the contents of the beaker, and the liquid began to resemble milk.
When the solution of barium sulfate in sulfuric acid was diluted with water, the solubility of the salt decreased sharply, and the barium sulfate transitioned from the dissolved state to the solid phase. As the solution stood, barium sulfate particles slowly settled to the bottom.
An idea then occurred to me: to heat the test tube containing the barium sulfate solution in sulfuric acid along with the precipitate of this substance that had not dissolved overnight. Would the barium sulfate dissolve? I kept the test tube in a boiling water bath for half an hour, stirring occasionally. The precipitate did not dissolve. However, the viscosity of the sulfuric acid decreased, causing the barium sulfate particles to settle more rapidly to the bottom.
After cooling, I added another 1 ml of the barium sulfate solution to the same beaker of water; as a result, a new portion of the suspension formed.
Finally, I decided to reverse the order of adding the reagents. I added approximately 5 ml of water to the test tube containing the remaining barium sulfate solution in sulfuric acid and the barium sulfate precipitate. The upper layer (water) became white and turbid, resembling milk, while the sulfuric acid layer remained unchanged. I stirred the contents of the test tube, and the two liquid layers combined to form a white suspension of barium sulfate.
**Caution 1:** When adding water to concentrated sulfuric acid, sudden heating may occur, accompanied by boiling and splashing of the liquid.
**Caution 2:** A glass test tube is a fairly fragile vessel. In Ukrainian, the word *"probirka"* (test tube) sounds similar to the word *"probyty"* (to break through). This coincidence is accidental, but it illustrates the essence of the problem well. For example, when stirring the contents of a test tube with a glass rod, the tube can easily break - a careless movement can cause a crack or even a hole in the bottom. If the test tube contains concentrated sulfuric acid, the acid may come into contact with your eyes, skin, or clothing. Wear protective goggles and gloves. Handle with care.
__________________________________________________
1
N.R. Trenner and H.A. Taylor. The Solubility of Barium Sulphate in Sulphuric Acid // J. Phys. Chem. 1931, 35, 5, 1336-1344 [link].
|
Осаждение сульфата бария из раствора добавлением воды - Часть 12
Оставил смесь серной кислоты и сульфата бария на ночь. Тем временем, стал искать в литературе растворимость сульфата бария в концентрированной серной кислоте. По данным авторов [1], растворимость данной соли в 100%-й серной кислоте довольно значительна. Концентрация насыщенного раствора сульфата бария составляет 15.89% (25°С). С увеличением содержания в серной кислоте воды растворимость сульфата бария резко уменьшается, в чем можно убедиться из таблицы:
Вернемся к нашему эксперименту. Я добавил 2.075 г сульфата бария к 11.735 концентрированной серной кислоты, что соответствует концентрации раствора сульфата бария 15.03%. Такой раствор может образоваться, если концентрация исходной серной кислоты составляет 99.5% или выше. Учитывая, что концентрация кислоты, которую я использовал, не выше 98%, часть сульфата бария должна остаться в осадке.
На следующий день обнаружил, что в пробирке образовался осадок сульфата бария, над которым находилась слегка мутная жидкость, она представляла собой насыщенной раствор сульфата бария в концентрированной серной кислоте.
Налил в стакан 800 мл водопроводной воды (дистиллированную воду использовать для этих целей не обязательно). Добавил в воду 1 мл раствора сульфата бария в концентрированной серной кислоте. Моментально образовалась белая суспензия. Перемешал содержимое стакана, жидкость стала похожа на молоко.
В результате разбавления водой раствора сульфата бария в серной кислоте, растворимость соли резко уменьшилась, и сульфат бария перешел из раствора в твердую фазу. При стоянии раствора частички сульфата бария медленно оседали на дно.
Возникла идея: нагреть пробирку, содержащую раствор сульфата бария в кислоте и осадок данного вещества, который не растворился за ночь. Произойдет ли растворение сульфата бария? Выдержал пробирку на кипящей водяной бане в течение получаса, периодически перемешивая. Осадок не растворился. Зато вязкость серной кислоты уменьшилась, благодаря чему частицы сульфата бария быстро оседали на дно.
После охлаждения добавил еще 1 мл раствора сульфата бария в тот же стакан с водой - образовалась новая порция суспензии.
В заключение, решил поменять порядок добавления реагентов. Добавил примерно 5 мл воды в пробирку с оставшимся раствором сульфата бария в серной кислоте и осадком сульфата бария. Верхний слой (вода) стал белым и мутным - похожим на молоко. Слой серной кислоты не изменился. Перемешал содержимое пробирки - оба слоя жидкости смешались и превратились в белую суспензию сульфата бария.
**Предостережение 1.** При добавлении воды к концентрированной серной кислоте возможен резкий разогрев, который сопровождается вскипанием и разбрызгиванием жидкости.
**Предостережение 2.** Стеклянная пробирка - довольно хрупкий сосуд. В украинском или русском языках слово "пробирка" созвучно со словом "пробить". Такое совпадение слов случайно, но оно отображает суть проблемы. Например, при перемешивании содержимого пробирки стеклянной палочкой, пробирку легко разбить - от неосторожного движения в дне может образоваться трещина или отверстие. Если внутри пробирки находится концентрированная серная кислота, она может попасть в глаза, на кожу или на одежду. Пользуйтесь защитными очками и защитными перчатками. Работайте аккуратно.
|

Precipitation of Barium Sulfate from Solution by Adding Water
|

|

|

|
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|