Диаграмма состояния воды
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 4 2015 Журнал Химиков-Энтузиастов |
Сверхкритическое состояние (углекислый газ) И.Н. Григорьев, В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Возьмем открытый сосуд с водой и нагреем. Когда будет достигнута точка кипения, вода закипит и будет переходить в пар (напомню, при давлении 1 атм. температура кипения воды 100°С). Кипение воды будет продолжаться до тех пор, пока вся вода не перейдет в газообразное состояние (пар). Пар улетучится из открытого сосуда.
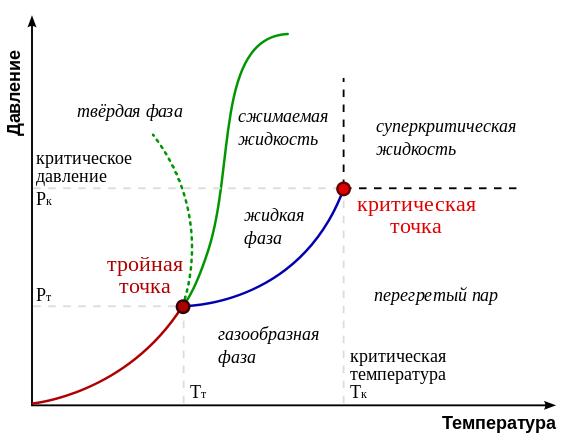
А что будет, если сосуд закрыть, т.е. как будет вести себя вода при нагревании в закрытом сосуде? При достижении температуры 100°С давление воздуха будет 1 атм. (возрастание давление воздуха при нагреве не учитываем), плюс давление насыщенного пара воды 1 атм., вместе - 2 атм. Вода кипеть не будет, поскольку при давлении в 2 атм. температура кипения воды более высокая (119.6°С). Если теперь мы нагреем сосуд до 119.6°С, давление водяного пара станет 2 атм., давление воздуха 1 атм., общее давление - 3 атм. Под давлением 3 атм. вода кипит при 132.9°С и т.д. Напомню, температура кипения воды возрастает при увеличении внешнего давления (и наоборот уменьшается, если давление ниже атмосферного). В результате, если нагревать воду в закрытом сосуде, давление будет расти вместе с температурой, поэтому вода кипеть не будет. Тем не менее, изменения будут происходить. Плотность воды будет уменьшаться при возрастании температуры, а давление пара - увеличиваться. Вместе с давлением пара растет и его плотность. В результате при определенной температуре плотность жидкости и пара сравняется, и разница между ними исчезнет. Достигнута критическая температура воды, выше которой вода существует исключительно в виде пара и не переходит в жидкое состояние при любом, - столь угодно высоком - давлении. Такое состояние жидкости называют сверхкритическим (сверхкритическая жидкость). Для воды критическая температура 374°С, критическое давление - 218 атм. Мало какой прозрачный сосуд выдержит такое давление. Увы, самая доступная на Земле жидкость - вода - далеко не самый удобный объект для наблюдения за переходом в сверхкритическое состояние. |

Диаграмма состояния воды |
|
Для некоторых жидкостей критическая температура и давление гораздо ниже. Для гелия, например, критическое давление равно всего 2 атм., зато критическая температура - минус 268°С (5К), для азота критическая точка - 33.5 атм. и минус 147°С (126К).
Разумеется, работа с жидким гелием и даже жидким азотом доступна далеко не каждому. Но есть доступное вещество с удобным значением критической температуры и давления. Это углекислый газ, для него критическая точка - 31°С и 71 атм. Приведу цитату из работы: Эндрюс Т. - О непрерывности газообразного и жидкого состояний вещества [ссылка]. При частичном сжижении углекислоты посредством одного только давления и при постепенном повышении в то самое время температуры до 88° Фар. (31°С) поверхность раздела между жидкостью и газом делается менее резкой, теряет свою кривизну и, наконец, исчезает. В это время пространство заполнено однородным текучим веществом, в котором, в случае внезапного уменьшения давления или небольшого понижения температуры, обнаруживается характерное явление полос, перебегающих или волнующихся по всей его массе. При температурах выше 88° Фар. нельзя получить никакого видимого сжижения углекислоты или разделения ее на две отличных друг от друга формы вещества, даже если прилагать давление в 300 или 400 атмосфер. Окись азота дала сходные результаты. На примере углекислого газа можно наблюдать переход жидкости в сверхкритическое состояние даже в домашних условиях. Самодельные установки, которые будут работать под давлением порядка 71 атм., в домашних условиях опасны, но сделать их вполне реально. Например, один энтузиаст сделал установку из толстого алюминиевого кольца, закрытого с торцов толстым прозрачным пластиком, который зажат болтами (фланцевое соединение). Сквозь прозрачное стекло можно наблюдать, как исчезает поверхность разделения между жидким и газообразным диоксидом углерода, если температура поднимается выше критической. А если сверхкритический углекислый газ охладить, поверхность раздела возникает вновь. Заполнить сосуд жидким углекислым газом можно, поместив в него кусок сухого льда. Сборка и работа установки показана автором в ролике, размещенном на сайте youtube https://www.youtube.com/watch?v=-gCTKteN5Y4. |

|

|

|

|
|
Несложно сделать более опасный, но простейший прибор - запаянную толстостенную трубку с углекислым газом.
Трубка подходит от мерной пипетки на миллилитр. Она уже была описана в опытах по трубкам Фарадея [1]. Трубка охлаждается в стаканчике с жидким азотом, после конденсации небольшого количества углекислого газа запаивается. Выждав некоторое время для охлаждения спаянного конца, не вынимая из азота, трубку помещаем во взрывозащищенный контейнер - коробку, пенопласт (или тому подобное) для нагрева. Некоторые трубки лопаются. Поэтому нужно сделать несколько. Углекислый газ после таяния льда в трубке сильно расширяется, поэтому с конденсацией надо не переборщить. Если трубка выдержала нагрев и внутри видна углекислота, надо ее испытать давлением - поместить в пластиковый сосуд с водой при 50°С. Если трубка выдерживает - ее можно использовать для наблюдений. Понятно, что работать необходимо в защитных очках. Визуально наблюдать описанные выше явления - легко и занятно. __________________________________________________ 1 Опыты с трубкой Фарадея (получение сжиженных газов) [ссылка] |

|

|
|
В моем случае получилось, правда, не совсем идеально: надо было брать меньше углекислого газа, чтобы трубка была заполнена наполовину, но рассчитать уровень сложно - вроде льда крохи, а потом при нагреве запаянной трубки жидкость все прибывает
![[Улыбка]](http://chemistry-chemists.com/img/ab.gif) , из трех трубок уцелела и прошла испытание только одна. Во второй трубке было много жидкости или спайка оказалась некачественной - при нагреве до комнатной температуры она взорвалась в коробке. В третьей трубке, наоборот, было слишком мало углекислого газа, в результате не появлялся мениск. , из трех трубок уцелела и прошла испытание только одна. Во второй трубке было много жидкости или спайка оказалась некачественной - при нагреве до комнатной температуры она взорвалась в коробке. В третьей трубке, наоборот, было слишком мало углекислого газа, в результате не появлялся мениск.
|

Трубку с жидким углекислым газом нагреваем феном |

|

|

|

При достижении критической температуры поверхность разделения исчезает |

При охлаждении поверхность разделения появляется вновь |

|

|

|

|