Химия и Химики № 4 2020
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 4 2020 Журнал Химиков-Энтузиастов |
Эксперименты с молибдатами ч.1 Experiments with molybdates В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Молибдат аммония и гидрохлорид гидроксиламина
Недавно я проводил эксперименты с молибденовыми синями. Получаются эти вещества, например, действием некоторых восстановителей на раствор молибдата аммония. Посмотрел свои запасы и выбрал в качестве восстановителя сульфат гидразина. Растворил сульфат гидразина, добавил к молибдату аммония - постепенно появилась синяя окраска. Это и есть молибденовая синь.Ammonium molybdate and hydroxylamine hydrochloride Во время очередного эксперимента решил использовать вместо гидразина хлорид гидроксиламина. Такую замену я рассматривал как чисто механическую, целью было просто получить молибденовую синь и проверить, как на нее действуют те или иные вещества. К раствору молибдата аммония прилил раствор солянокислого гидроксиламина (оба раствора насыщенные). Результат оказался неожиданным: вместо ожидаемой синей окраски раствор стал светло-желтый и мутный - т.е. образовался желтый взвешенный осадок. На молибденовую синь явно не похоже. Осадок внешне напоминал желтый осадок, который образуется при гравиметрическом определении фосфора хинолин-молибденовым методом (там образовывалась соль фосфорномолибденовой гетерополикислоты с органическим основанием - хинолином), хотя в том случае осадок был более желтым. Предположил, что гидроксиламин образовал комплекс с шестивалентным молибденом. Начал искать в сети (на русском) - мало что нашел. Тогда посмотрел монографию Бусев А.И. Аналитическая химия молибдена (1962) [ссылка]. Сразу нашел: "N-Бензоилфенилгидроксиламин 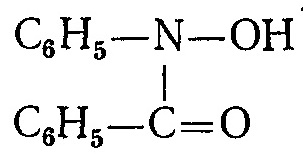
Образует с шестивалентным молибденом желтовато-белый осадок. Осадок немного растворим в горячей воде (при 80° С и выше), в концентрированных кислотах при комнатной температуре и в этаноле. Результаты химического анализа осадка соответствуют формуле MoO2(C13H10O2N)2. Осадок разлагается при 165-166°С. Шестивалентный молибден осаждается количественно, если избыток реагента составляет 0,03%, осаждение производится при температуре ниже 70°С; кислотность раствора находится в пределах 0,01-2,5 N HCl. Реагент применяют для гравиметрического определения молибдена." Это - не гидроксиламин, а его производное, но можно предположить, что аналогичный (или немного другой) комплекс шестивалентный молибден дает и с гидроксиламином. Даже цвет осадка в обоих случаях - бело-желтый. Дальше в этой же книге нашел параграф, посвященный взаимодействию шестивалентного молибдена с гидразином и с гидроксиламином. Здесь информация была менее определенной: "Изучалось восстановление шестивалентного молибдена гидроксиламином. Вероятно, при определенных условиях сначала образуется соединение шестивалентного молибдена с гидроксиламином, которое, разрушаясь, образует азот и окислы азота. Несомненно, процессы восстановления шестивалентного молибдена гидроксиламином и гидразином значительно различаются. Иногда сульфат гидроксиламина применяется для восстановления шестивалентного молибдена". Т.е., прямых указаний нет, но гидроксиламин, по-видимому, образует комплекс с молибдатом, который при определенных условиях разлагается с выделением азота (и его оксидов) и восстановлением шестивалентного молибдена. Суммарно эти два процесса эквивалентны окислительно-восстановительной реакции между молибдатом и гидроксиламином. Зато по взаимодействию молибдата с сульфатом гидразина сказано более определенно: "Шестивалентный молибден восстанавливается гидразином в сильносолянокислой среде при температуре кипения только до пятивалентного состояния. В присутствии избытка ионов шестивалентного молибдена гидразин окисляется практически количественно до азота. В случае восстановления растворов парамолибдата аммония с очень низкой кислотностью при помощи сульфата гидразина было получено кристаллическое вещество красно-коричневого цвета, которое по данным анализа имеет формулу NH4[Mo2vO(OH)7MoVIO4], При несколько большей кислотности раствора образуется молибденовая синь. В сильносолянокислых растворах шестивалентный молибден непосредственно восстанавливается до пятивалентного состояния избытком гидразина. Концентрация соляной кислоты при восстановлении должна быть выше 0,3М, иначе образуется молибденовая синь. При восстановлении 18,9 мг MoVI количество N2H4·2НCl должно быть более 10 мг на 40 мл раствора; при меньших количествах шестивалентный молибден восстанавливается неполностью. Раствор достаточно кипятить 2 мин. Лучше всего к кипящему кислому раствору N2H4·2НCl прибавлять по каплям анализируемый раствор (10 мл), содержащий 10-100 мг Мо. В этом случае не образуется молибденовой сини. Если появится немного молибденовой сини, то при дальнейшем кипячении она обычно исчезает. По опытам индийских ученых, шестивалентный молибден количественно восстанавливается небольшим избытком N2H4·H2SO4 в среде 1-2 N НCl при нагревании на водяной бане 10-15 мин. В среде H2SO4 шестивалентный молибден количественно не восстанавливается. Гидразин применяют как восстановитель шестивалентного молибдена при его определении различными методами, а также для идентификации в форме молибденовой сини и при обнаружении молибдена каталитическим методом." Т.е., при больших концентрациях соляной кислоты избыток гидразина восстанавливает молибдат до пятивалентного молибдена, при меньших концентрациях образуется молибденовая синь (молибден пять и молибден шесть), а при низкой кислотности даже было выделено кристаллическое вещество красно-коричневого цвета NH4[Mo2vO(OH)7MoVIO4], содержащее пяти- и шестивалентный молибден. Коричневый осадок иногда наблюдался на заключительной стадии восстановления молибдата аммония цинком в среде соляной кислоты (когда кислота заканчивалась, а цинк был в избытке). Возможно при этих условиях тоже образовывалось аналогичное вещество. Из приведенной выше цитаты также ясно, почему в предыдущих опытах высокая концентрация соляной кислоты разрушала молибденовую синь: реакция восстановления молибдата гидразином шла дальше - до перехода всего молибдена в пятивалентное состояние. |
Молибдат аммония и гидрохлорид гидроксиламина Ammonium molybdate and hydroxylamine hydrochloride |

|

|

|

|

|
Эксперименты с молибдатами ч.2, 3 Experiments with molybdates В.Н. Витер |
|
Комплекс молибдена (V) с роданидом
Чтобы не изобретать велосипед, открыл первый попавшийся под руку практикум Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии (1986) [ссылка] - и посмотрел его на предмет экспериментов, которые можно сделать с молибдатами в "кухонных условиях". Внимание привлекло получение комплекса молибдена (V) с тиоцианатом:Thiocyanate complex of molybdenum (V) "Получение комплексного соединения молибдена (V) Выполнение работы. В пробирку с раствором молибдата аммония (3 капли) добавить одну каплю хлороводородной кислоты (плотность 1.19 г/см3), 3 капли раствора роданида калия KSCN и 2 капли раствора хлорида олова (II). Отметить появление красного окрашивания в результате образования комплексного соединения K2[MoO(SCN)5]. Какова степень окисления молибдена в этом соединении? В ту же пробирку внести 2-3 капли эфира, смешать все стеклянной палочкой, дать смеси отстояться и отметить образование окрашенного эфирного слоя. Эфир экстрагирует образовавшееся комплексное соединение. Запись данных опыта. Написать уравнение реакции получения комплексного соединения молибдена, учитывая, что реакция протекает в кислой среде. Указать значение прибавления хлорида олова. Данная реакция применяется для обнаружения молибдена". Итак, взял, 20 мл насыщенного раствора молибдата аммония, добавил примерно 15 мл соляной кислоты. Как я понял, кислота нужна в избытке, чтобы при восстановлении молибдата аммония не образовывалась молибденовая синь (смесь молибдена (V) и (VI)), а восстановление шло сразу до молибдена (V). Добавил миллилитров 15 раствора роданида калия (примерно насыщенного). Раствор стал оранжевым - без прибавления восстановителя. По идее, окраска должна была появиться после добавления хлорида олова (II). Я засомневался: фокусы роданида с катионами железа (III) мне известны - фокусы не только в буквальном смысле (имитация кровавого пореза на руке, например), но и в переносном. Много какие реактивы - несмотря на этикетки вроде "ЧДА", "ХЧ" и даже "ОСЧ" - содержат примеси железа и дают красную окраску с роданидом калия (аммония). Может, железо было в соляной кислоте "ХЧ"? Позже провел холостую пробу - действительно было, но на результат нашего эксперимента это не повлияло (подробности - в конце). После тиоцианата калия нужно было добавить восстановитель - хлорид олова (II), его у меня не было. Вместо того, чтобы плакать по временам, когда на прошлой работе хлорид олова лежал килограммами, решил заменить его сульфатом гидразина: при избытке соляной кислоты он тоже восстанавливает молибден до (V). Добавил примерно 20 мл насыщенного раствора сульфата гидразина. В первый момент видимых изменений не произошло, но потом медленно - на протяжении нескольких минут - раствор стал вишнево-красным, темным (непрозрачным). Возникновение и углубление окраски происходило постепенно, как и в случае молибденовой сини. Комплекс пятивалентного молибдена получен. Теперь - экстракция. Открыл я 20-канистру с диэтиловым эфиром... точнее маленькую бутылочку с нормальным бутанолом (бутанол-1) и добавил бутанол в стакан, размешал стеклянной палочкой. Для некоторых качественных реакций с экстракцией вместо традиционного диэтилового эфира подходит бутанол. Подошел он и в нашем случае. Когда жидкости расслоились, обе они были темно-красными: и нижний водный слой и верхний слой бутанола. Между слоями осталась т.н. "борода" устойчивая эмульсия бутанола возле границы слоев. Такая "борода" нередко создает проблемы при разделении двух жидких фаз в делительной воронке. Концентрация вишневого комплекса молибдена оказалась слишком высокой - комплекса хватило, чтобы окрасить оба слоя (водный и органический). Получил комплекс заново, отлил часть его раствора и развел дистиллированной водой раз в 5. Добавил бутанол, перемешал. После нескольких циклов перемешивания-расслоения верхний органический слой стал темно-вишневым, а нижний водный слой - светло-коричневым. Большая часть комплекса перешла в бутанол. С помощью этой реакции мой коллега определил, был ли в образце фторопласта-4 (тефлон) сульфид молибдена в качестве наполнителя. Для этого он провел реакцию фторопласта-4 с натрием под слоем плавленой буры (она тоже реагирует с натрием, но зато не было прямого контакта с кислородом воздуха), потом обработал получившийся продукт кислотой, добавил роданид и хлорид олова (II) - красная окраска, характерная для комплекса молибдена, не появилась. Желающие узнать больше о комплексах молибдена с тиоцианатом, могут ознакомиться со статьей. C. F. Hiskey and V. W. Meloche - The Nature of the Thiocyanate Complex of Molybdenum // J. Am. Chem. Soc. 1940, 62, 6, 1565-1574 [ссылка]. |

Молибдат аммония и соляная кислота |

Добавлен тиоцианат калия |

Добавлен сульфат гидразина - появилась и на протяжении примерно 3-х минут углублялась вишнево-красная окраска комплекса молибдена (V) с тиоцианатом. В конце раствор стал темным и непрозрачным
|

|

|

|

|

Стакан на просвет |

|

Комплекс разбавил водой примерно в 5 раз, добавил бутанол-1, несколько раз перемешал |

|

|

|

|

|

|

|

|

|

|
|
Обнаружение примеси железа (III) в соляной кислоте
Итак, вопрос: "А мы точно наблюдали окраску комплекса молибдена, или это был роданидный комплекс железа, которое содержалось в соляной кислоте?" Здравый смысл подсказывает, что дело не в железе - окраска комплекса была очень интенсивной - для такого нужно слишком много железа. Но это - философия, нужно провести холостую пробу. К 15 мл соляной кислоты добавил примерно сколько же раствора роданида калия (близкий к насыщенному). Появилась розовая окраска: железо в кислоте есть, но его мало. Finding of iron (III) impurities in hydrochloric acid Кстати, при работе с сульфидными люминофорами (на основе сульфидов кальция и цинка) примеси железа в реактивах - проблема. Железо (и некоторые другие металлы, например, серебро) гасят не так свечение, как послесвечение. Мой коллега долго вспоминал бутылку c азотной кислотой "ОСЧ", содержимое которой дало яркую - кроваво-красную окраску с роданидом. Возьми он эту кислоту - вся бы работа пошла насмарку. |

Обнаружение примеси железа (III) в соляной кислоте Finding of iron (III) impurities in hydrochloric acid |

|

|

|