Металлическая связь
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 7 2014 Журнал Химиков-Энтузиастов |
Гальванический элемент ч.1 В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Химические источники тока. Вступление
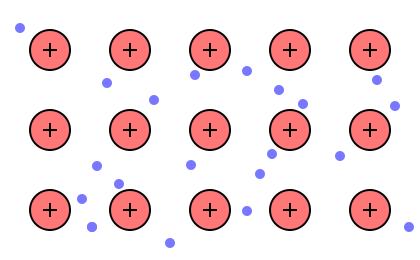
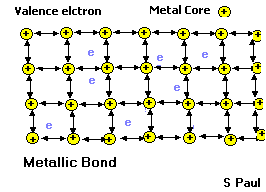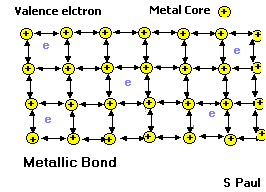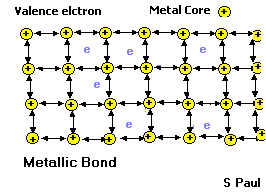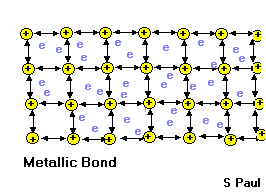
В твердых (и жидких) металлах атомы связаны металлической связью. В упрощенном виде ее можно описать так. Атомы металлов отдают свои валентные электроны в межатомное пространство - т.н. зону проводимости. В результате в узлах кристаллической решетки находятся ионы металла, окруженные "электронным газом" - валентными электронами, которые стали общими для всех атомов. Электроны (почти) свободно движутся в межатомном пространстве, этим, в частности, объясняется хорошая электропроводность и теплопроводность металлов, их ковкость и металлический блеск.
|

|

Металлическая связь |
|
Если опустить пластинку металла в воду, часть катионов перейдет в раствор, электроны останутся. В результате металл будет заряжен отрицательно, а раствор - положительно. Избыточные электроны соберутся возле поверхности металла, катионы - возле поверхности раствора: возникнет двойной электрический слой. Чем активнее металл, тем больше его катионов переходит в раствор и тем более отрицательно заряжена поверхность металла.
Абсолютное значение разницы потенциалов между металлом и раствором измерить не представляется возможным, однако можно измерить относительную разность потенциалов - между двумя разными металлами, погруженными в раствор. Поскольку разница потенциалов между металлом и раствором зависит не только от химической активности металла, но и от концентрации его катионов в растворе, концентрацию необходимо стандартизировать. Для этого металл погружают в раствор его соли с концентрацией катионов металла 1 моль/л. Теперь соединим два металла электрическим проводником (например, проводом), по которому будут двигаться электроны. Сосуды с растворами солей соединяют "электролитическим мостиком". Электролитический мостик - трубка с раствором хлорида калия [1] (или другого электролита - на рисунке показан сульфат натрия), по которой будут двигаться ионы (чтобы раствор хлорида калия не вытекал, вместо раствора лучше взять гель хлорида калия, например, с агаром). Когда мы соединим электрический и ионный проводник, в системе потечет ток: электроны будут переходить от металла, который заряжен более отрицательно, к металлу который заряжен более положительно. Одновременно по трубке с хлоридом калия будут двигаться ионы. Между металлами можно установить вольтметр, определив, таким образом, разницу потенциалов. Вот как это выглядит для цинка и меди. |
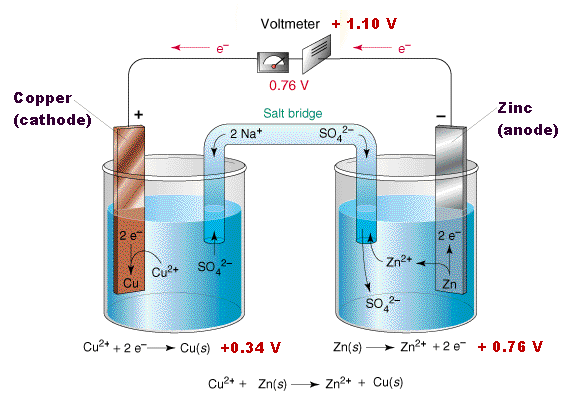
Гальванический элемент |
|
В растворе цинк заряжен более отрицательно, чем медь. В результате электроны будут переходить от пластинки цинка к меди. На поверхности меди эти электроны будут соединяться с катионами меди из раствора (медь оседает на электроде), одновременно катионы цинка будут переходить с поверхности металла в раствор. Анионы (например, сульфата), которые были в сосуде с раствором соли меди, будут переходить по электролитическому мостику в сосуд с солью цинка - чтобы компенсировать избыток катионов в этом сосуде (т.к. катионы цинка переходят из металла в раствор и их количество в растворе растет).
Таким образом, в системе потечет электрический ток: электроны будут двигаться от цинка к меди, а анионы сульфата будут двигаться из сосуда с раствором сульфата меди в сосуд с раствором сульфата цинка. Ток будет течь до тех пор, пока весь цинк не раствориться или все катионы меди из раствора не восстановятся до металлической меди [1]. Zn0 => Zn2+ + 2e- Cu2+ + 2e- = Cu0 Такое устройство называется гальванический элемент. Описанный принцип лежит в основе всех химических источников тока (ХИТ) - батареек, аккумуляторов, топливных элементов. Конструкции и химические реакции, которые лежат в основе работы химических источников тока, могут сильно отличаться, но принцип один: на одном электроде происходит окисление, на другом - восстановление. В первом случае ионы или нейтральные молекулы отдают электроны электроду, во втором - отнимают электроны от электрода: в результате между электродами течет электрический ток. Если электроды состоят из двух разных металлов (меди и цинка, например), то совсем не обязательно они должны быть погружены в растворы солей именно этих металлов (меди и цинка), можно, например, взять раствор кислоты и погрузить в него пластинки меди и цинка. Более того, два металлических электрода часто находятся не в разных сосудах, а в одном и том же (т.е. их окружает один и тот же раствор). Главное, чтобы катионы из этого раствора забирали электроны с поверхности медной пластинки, поддерживая этим растворение цинка, а значит - и электрический ток в системе (в случае кислоты таким катионом будет катион водорода). Zn0 => Zn2+ + 2e- 2H+ + 2e- = H20 Оба электрода могут быть сделаны из одинакового металла (например, из меди), но находиться в двух растворах соли (сульфат меди) с разной концентрацией катионов. - В таком гальваническом элементе тоже потечет ток (т.н. концентрационный элемент). Cu0 => Cu2+ + 2e- (там, где ниже концентрация меди в растворе) Cu2+ + 2e- = Cu0 (там, где выше концентрация меди в растворе) __________________________________________________ 1 Строго говоря, электрический ток будет течь до наступления равновесия в системе: пока потенциалы обеих электродов не сравняются. По мере растворения цинка концентрация его катионов в растворе растет - в результате потенциал цинка становится менее отрицательным (по отношению к меди), а по мере осаждения меди из раствора концентрация ее катионов в растворе уменьшается и потенциал меди становится менее положительным (по отношению к цинку). Теоретически должен наступить момент, когда цинк перестанет растворяться, а медь - осаждаться из раствора - т.к. разница потенциалов станет равной нулю (хотя к тому моменту не весь цинк растворится и не вся медь осядет из раствора). На практике концентрация катионов меди, при которой медь перестанет осаждаться из раствора, а цинк - перестанет растворяться, очень, очень низкая - часто ней можно пренебречь. |
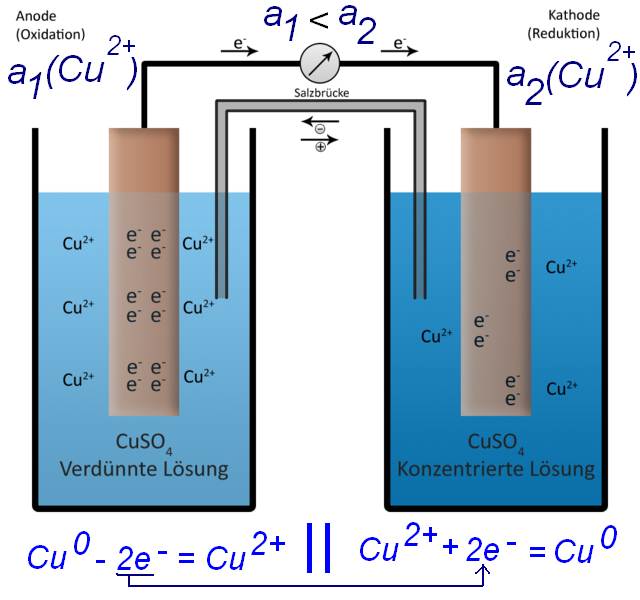
Концентрационный элемент (в правом стакане более высокая концентрация ионов меди, в левом - более низкая) |
|
В некоторых случаях и оба электрода и раствор одинаковы, например, в свинцовом аккумуляторе. Свинцовые пластины покрыты сульфатом свинца и погружены в разбавленную серную кислоту. Ток между ними не течет, т.к. и пластины, и раствор одинаковы. Однако во время зарядки к аккумулятору подключают ток: к одним пластинам положительный электрод, к другим - отрицательный. В результате на положительном электроде сульфат свинца PbSO4 окисляется до диоксида PbO2, на отрицательном сульфат свинца восстанавливается до металла Pb. Аккумулятор заряжен и готов к работе. Когда электроды соединяют проводником, между ними течет ток: на одном электроде свинец окисляется до сульфата и отдает электроны, на другом электроде диоксид свинца принимает электроны и восстанавливается до сульфата свинца.
Pb0 - 2e- + SO42- = PbSO4 PbO2 + 2e- + SO42- + 4H+ = PbSO4 + 2H2O Когда весь свинец на одном электроде окислится, а диоксид свинца на другом электроде восстановится (в обоих случаях - до сульфата свинца), аккумулятор разрядится и ток перестанет течь. Но отличие аккумулятора от батареек в том, что его можно много раз разряжать, а потом опять заряжать. Принцип действия аккумуляторов может быть разный, но главная особенность в том, что их можно заряжать. Хорошие аккумуляторы выдерживают тысячи циклов зарядки-разрядки. |

Свинцовый аккумулятор (вскрытый) |

Свинцовый аккумулятор |
|
В простейшем топливном элементе окислителем служит газообразный кислород, восстановителем - водород, оба процесса происходят на платиновых или палладиевых электродах, погруженных в раствор щелочи. На платиновом или палладиевом электроде водород не только сорбируется, но и активируется - в таком состоянии его атомы способны отдавать свои электроны электроду.
2H20 + 4OH- - 4e-=> 2H2O O20 + 2H2O + 4e- => 4OH- |
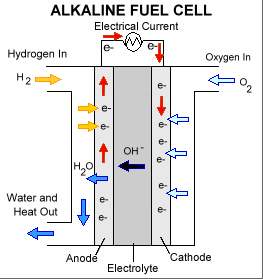
Топливный элемент (водородно-кислородный со щелочным электролитом) |
|
На бумаге все выглядит просто, но водород - далеко не самое удобное, дешевое и безопасное топливо (и не такое экологически чистое, кстати - чтобы получить водород, часто сжигают обычное органическое топливо). Поэтому целесообразно заменить водород другими - более дешевыми, удобными и безопасными видами топлива. Также целесообразно разработать топливные элементы, которые не содержат дорогие и дефицитные платиновые металлы. Работы в этом направлении активно ведутся, но до совершенства современным топливным элементам еще далеко: либо рабочие температуры слишком высокие, либо в качестве топлива приходится использовать дешевый, но токсичный метанол.
Ниже показан топливный элемент на метаноле. |

Топливный элемент на метаноле |
|
Выше отмечалось, что технически возможно измерить не абсолютный, а только относительный электродный потенциал (т.е. потенциал одного электрода по отношению к другому). Для удобства необходимо было выбрать стандартный электрод, потенциал которого принять равным нулю (0 В). За ноль принят потенциал стандартного водородного электрода.
Конструкция стандартного водородного электрода проста. Платиновый электрод, покрытый платиновой чернью, опущен в раствор кислоты (обычно соляной) в котором концентрация ионов водорода равна 1 моль/л (вернее, не концентрация, а активность). Платина омывается потоком водорода при температуре 298 К и давлении 1 атм. |
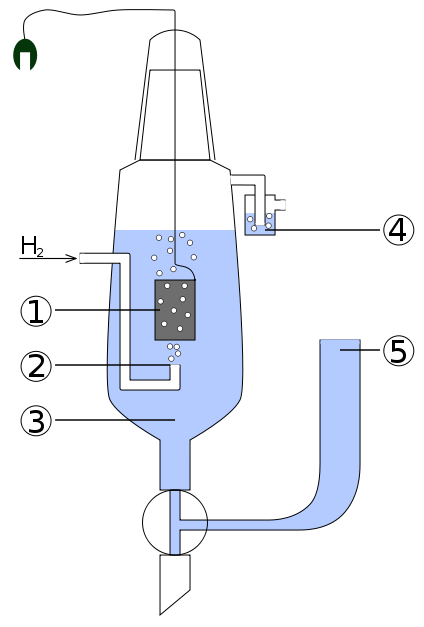
Стандартный водородный электрод: 1 - Платиновый электрод.
2 - Подводимый газообразный водород. 3 - Раствор кислоты с концентрацией H+ = 1 моль/л. 4 - Водяной затвор, препятствующий попаданию кислорода воздуха. 5 - Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента. |
|
Несмотря на кажущуюся простоту, стандартный водородный электрод капризен и неудобен в работе, поэтому вместо него применяют другие электроды сравнения, которые имеют стабильный и надежно измеренный потенциал. Например: хлорсеребряный, каломельный, и хингидронный электроды.
В частности, хлорсеребряный электрод часто используется в рН-метрах (приборах для измерения концентрации ионов водорода в растворе). |
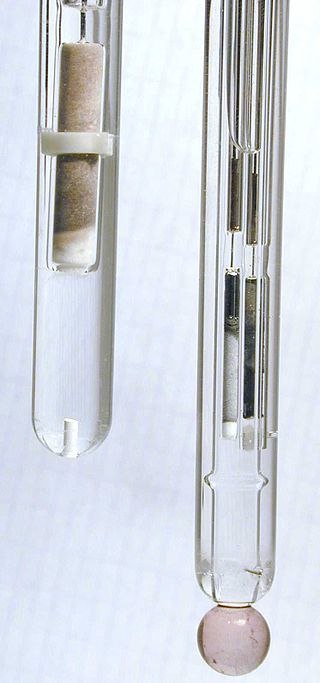
Хлоридсеребряный электрод (слева) и стеклянный электрод (справа) - электродная пара рН-метра |
|
Но все это теория. Вернемся к практике. Какими бы ни были разнообразными химические источники тока, для их работы необходимо выполнить несколько условий.
1. Химическая реакция: на одном электроде ионы или нейтральные молекулы должны отдавать свои электроны электроду; на втором электроде ионы или молекулы должны принимать электроны от электрода. 2. Электроды должны быть соединены проводником электрического тока. 3. Электроды должны быть погружены в электролит, причем ионы должны свободно перемещаться между сосудами с электролитом, в которые погружены электроды (сосуды связывают мостиком из электролита или мембраной, которая пропускает ионы). Если электроды в одном сосуде - тем лучше, но это не всегда возможно. Электролит может быть не жидким, а например, гелеобразным или пастообразным. Электрод может быть не из металла, а из графита. Но если нарушить хотя бы одно из трех приведенных условий, химический источник тока работать не будет. В любом случае, "источником возникновения тока" - электродвижущей силой - является химическая реакция. Химический источник тока будет работать до тех пор, пока в нем происходит химическая реакция. |
Вольтов столб (Вольтова батарея, элемент Вольта) - первый гальванический элемент |
|
|
Гальванический элемент ч.2 В.Н. Витер |
|
Гальванический элемент медь - цинк - серная кислота
Налил в стакан разбавленной серной кислоты, опустил в нее пластинку оцинкованной жести. Началось выделение водорода. К пластинке прикрепил "крокодильчиком" провод, соединенный с помощью другого крокодильчика с расплющенной медной трубкой. Опустил медь в стакан с цинком и кислотой - с поверхности меди началось выделение водорода.
Мы получили гальванический элемент: цинк растворяется, электроны по проводу переходят к меди, на поверхности меди разряжаются (восстанавливаются) ионы водорода. В идеале после погружения меди в кислоту выделение водорода на поверхности цинка должно было бы прекратиться, но реально водород выделялся и на меди, и на цинке. Если вынуть цинковую пластинку из кислоты, но оставить медную, выделение водорода с поверхности меди прекратится: медь не вытесняет водород из серной кислоты. Подключил между пластинками электроды тестера - напряжение оказалось 0.8-0.9 В. Если вынуть одну из пластинок (медь или цинк) из раствора - напряжение упадет до нуля (в системе нет электрического тока). То же самое произойдет, если медь и цинк в растворе соприкоснуться: электроны будут переходить от цинка к меди непосредственно - минуя провод и тестер. Как можно увеличить напряжение нашего гальванического элемента? Ответ мы получим, если рассмотрим уравнения происходящих процессов: Zn0 => Zn2+ + 2e- 2H+ + 2e- = H20 Электродвижущая сила (ЭДС) гальванического элемента равна разности потенциалов электродов, в нашем случае - "водородного" [2] и цинкового: ЭДС = Е(2H+/H2) - Е(Zn2+/Zn) Чем больше потенциал водородного электрода и чем меньше - цинкового, тем больше ЭДС гальванического элемента. В обоих случаях потенциал электрода - водородного или цинкового возрастает с увеличением концентрации катионов водорода или цинка в растворе, соответственно. Выхода два: понизить концентрацию ионов цинка или повысить концентрацию ионов водорода. В начальный момент концентрация катионов цинка практически равна нулю (снижать ее некуда), зато можно повысить концентрацию катионов водорода - добавить в стакан еще серной кислоты. Потенциал водородного электрода возрастет, в результате разница потенциалов увеличится. И сразу же существенное уточнение: по мере работы гальванического элемента концентрация ионов водорода в растворе будет уменьшаться, а ионов цинка - возрастать (цинк переходит в раствор, а ионы водорода восстанавливаются до H2). Вывод: ЭДС нашего гальванического элемента со временем будет падать. Еще один вариант - заменить цинк на любой металл, который стоит в электрохимическом ряду напряжений левее цинка (т.е. на металл, более активный, чем цинк). Потенциал электрода с таким металлом более положительный (при прочих равных условиях). Например, вместо цинка можно взять магний. А что изменится, если вместо меди взять другой - менее активный металл (который в ряду напряжений стоит правее меди), например - серебро, платину и т.п.? Потенциал гальванического элемента увеличится? Нет, поскольку мы имеем дело не с гальваническим элементом с цинковым и медным электродами (он же элемента Даниэля): Zn | ZnSO4 || CuSO4 | Cu - [см. выше], а с гальваническим элементом с цинковым и водородным электродами. Zn | ZnSO4 || H2SO4 | H2. Zn0 => Zn2+ + 2e- 2H+ + 2e- = H20 Легко видеть, что материал электрода, на котором выделяется водород, не входит в уравнения, а значит, не имеет значения [3]. __________________________________________________ 2 Термин "водородный электрод" взят в кавычки потому, что в стандартном водородном электроде пластинка не медная, а платиновая - это существенно влияет на его работу. 3 Строго говоря, материал электрода, на котором выделяется водород, имеет значение (еще как имеет). - Иначе для стандартного водородного электрода не было бы потребности использовать платину. Но не будем усложнять изложение. |

Гальванический элемент медь - цинк - серная кислота |

|
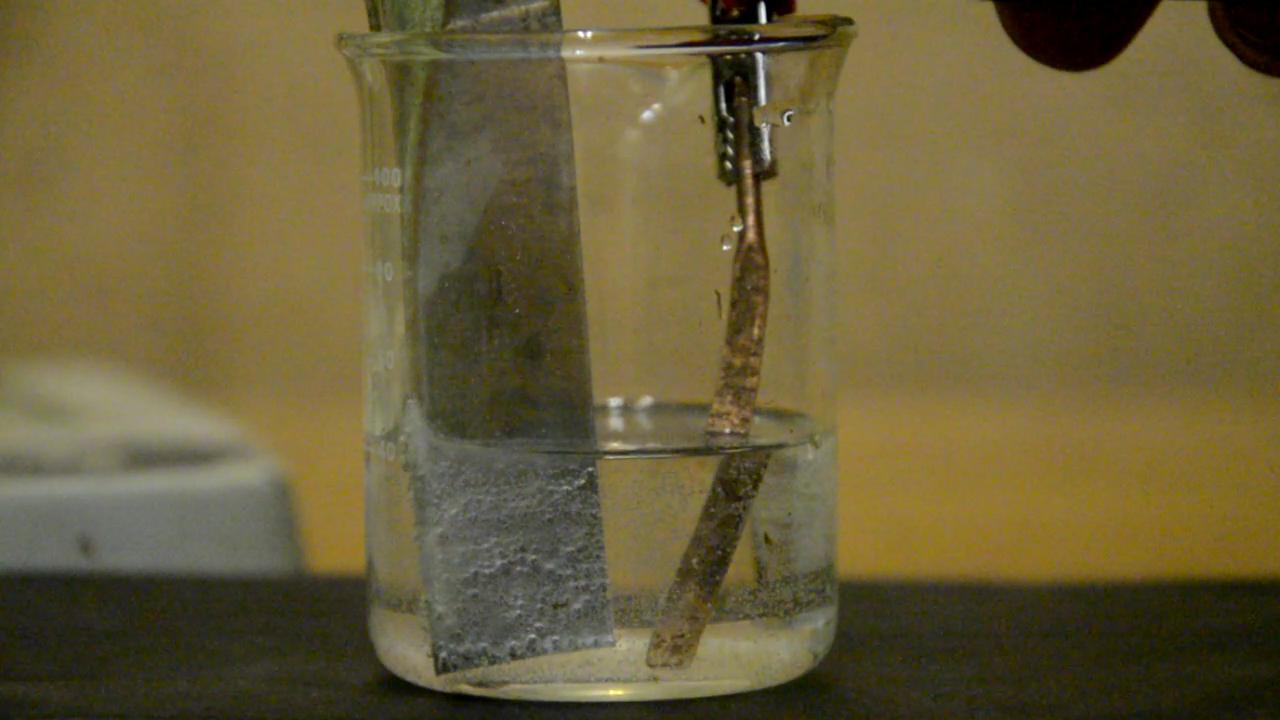
|

|

|

|

|

|

|

|

|

|
|
Комментарии
К1
При потенциометрических измерениях электролит для электролитического (солевого) мостика выбирают таким образом, чтобы величины подвижности его катиона и аниона были как можно ближе. В водных растворах обычно используют хлорид калия или нитрат аммония. Если подвижности катиона и аниона электролита значительно отличаются, то в местах контакта растворов разного состава возникает разность потенциалов за счет разной скорости диффузии катиона и аниона. Таким образом, результаты измерения потенциала будут содержать систематическую погрешность на величину диффузионного потенциала.
К2 Примечание редактора: с научной стороной комментария спорить не буду, но для тех читателей, которые не в курсе, что такое уровни Ферми, в данный комментарий лучше не вникать, чтобы не запутаться. Строго говоря, заряд металла, погруженного в раствор электролита, не связан однозначно со свойствами металла и раствора. Работа гальванического элемента основана на разности химических потенциалов, которые, в свою очередь, непосредственно определяются значениями энергии Ферми для металлов катода и анода и температурой. При контакте двух металлов электроны перемещаются из металла с бОльшим уровнем Ферми в металл с меньшим уровнем Ферми. Процесс протекает до тех пор, пока уровни Ферми, а, следовательно, и химические потенциалы металлов не установятся на некотором новом одинаковом значении. Металлы приобретают равный и противоположный по знаку заряд, и на этом релаксация завершается. (Здесь заметим, что в случае пары медь-цинк положительный заряд приобретает цинк.) Нетрудно видеть, что если два проводника из разных металлов соединить в кольцо, то равновесная ЭДС в цепи будет равна нулю. Однако в гальваническом элементе цепь замыкается через раствор электролита. На границе металл-раствор происходит обмен ионов между раствором и поверхностью металла. Скорости прямого и обратного процесса (называемые токами обмена) зависят от величины химического потенциала, как металла, так и раствора. В некоторых случаях прямой и обратный процессы могут протекать даже с участием разных веществ. В соответствии с изменением химического потенциала двух металлов при их контакте (то есть при замыкании цепи) изменяются и токи обмена: падает скорость одного и растет скорость другого. (Отметим, что зависимость скорости обмена от величины потенциала экспоненциальная.) Таким образом, на одном электроде бОльшая часть ионов переходит с поверхности в раствор, на другом - из раствора на поверхность. Одновременно происходит перетекание электронов через контакт между металлами в направлении уравнивания уровней Ферми. Процесс продолжается до тех пор, пока химические потенциалы в системе не уравняются. |