Гальванический элемент
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 7 2014 Журнал Химиков-Энтузиастов |
Гальванический элемент ч.7 В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Концентрационный гальванический элемент
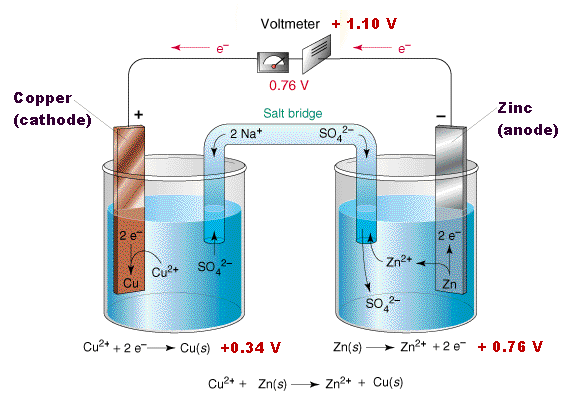
Вернемся к "классическому" гальваническому элементу, описанному в первой части статьи. Есть два сосуда. В каждом из сосудов пластинка из металла опущена в раствор соли этого же металла. Эти два сосуда - с разными металлами - соединены солевым мостиком (ионный проводник), а две пластинки из разных металлов - электронным проводником (проводом). Для меди и цинка это выглядит так:
|

Гальванический элемент |
|
Потенциал такого гальванического элемента - электродвижущая сила (ЭДС) равна разнице потенциалов медного и цинкового электродов (полуэлементов):
ЭДС = Е(Cu2+/Cu) - Е(Zn2+/Zn)
Потенциал медного и цинкового электродов (полуэлементов), в свою очередь, зависит от концентрации ионов меди (цинка) в растворе. Если концентрация ионов меди (цинка) отличается от стандартной (1 моль/л), потенциал электрода рассчитывают по уравнению Нернста:
Е - фактический потенциал электрода в В; Е0 - стандартный электродный потенциал в В; R - универсальная газовая постоянная 8.31 Дж/(моль·K); F - постоянная Фарадея 96485.35 Кл/моль; Т - абсолютная температура в К; n - число электронов, которые участвуют в реакции (в нашем случае для меди и цинка n = 2); aox и ared - концентрации (точнее - активности) окислителя и восстановителя. Если подставить в уравнение значения R и F (они ведь константы), принять температуру равной Т= 298К (25°С) и перейти от натуральным логарифмов к десятичным [ lg(X) ≈ 0.43429 ln(X)], уравнение Нернста упростится: Для реакции Zn2+ + 2e- = Zn0 уравнение еще больше упростится, поскольку в растворе есть только окислитель (катион Zn2+), но нет восстановителя (восстановитель - металлический цинк Zn, он в твердой фазе - поэтому из уравнения исключается): Аналогично выглядит и уравнение для медного электрода. Зная концентрацию меди и цинка в растворе возле электродов, мы сможем вычислить Е(Cu2+/Cu) и Е(Zn2+/Zn), затем - ЭДС гальванического элемента. А теперь, внимание: что будет, если в нашем гальваническом элементе заменить цинковый электрод медным? - Т.е. сделать гальванический элемент из двух медных электродов, опущенных в раствор соли меди? ЭДС = Е2(Cu2+/Cu) - Е1(Cu2+/Cu)
Где потенциалы левого и правого медных электродов - Е1(Cu2+/Cu) и Е2(Cu2+/Cu); их можно рассчитать по уравнению Нернста: Без всяких расчетов видно, что если в обоих сосудах концентрации (активности) ионов меди - a1(Cu2+) и a2(Cu2+) равны, то равны будут и потенциалы обеих электродов Е1(Cu2+/Cu) = Е2(Cu2+/Cu). Следовательно ЭДС = 0. Ток в цепи течь не будет. Если же концентрации ионов меди в правом и левом сосудах будут отличаться [a1(Cu2+) ≠ a2(Cu2+) ] - будут отличаться и потенциалы правого и левого электродов (поскольку потенциал медного электрода зависит от концентрации ионов меди в растворе - что очевидно из уравнения Нернста). Следовательно, ЭДС ≠ 0 - в цепи потечет электрический ток. И хотя обе медных пластинки были одинаковы, одна из них будет растворяться (в сосуде, где концентрация ионов меди меньше), а другая - наращиваться (в сосуде, где концентрация ионов меди больше). Процесс будет идти до тех пор, пока концентрация ионов меди в обоих сосудах не сравняется (или пока один из медных электродов полностью не растворится). |
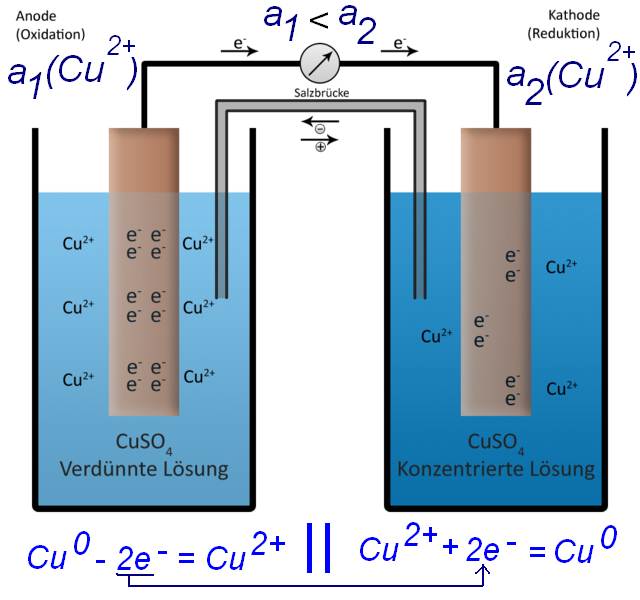
Концентрационный гальванический элемент |
|
Попробуем упростить уравнение Нернста (для температуры 25°С), учитывая, что два электрода отличаются только концентрацией (активностью) ионов меди в растворе.
ЭДС = Е2(Cu2+/Cu) - Е1(Cu2+/Cu)=
Попробуем рассчитать напряжение концентрационного элемента. Например, a2(Cu2+) = 1 моль/л и a1(Cu2+) = 0.1 моль/л - т.е. концентрации ионов меди в двух стаканах отличаются в 10 раз. = [E0(Cu2+/Cu) + (0.059/2) · lg(a2(Cu2+))] - [E0(Cu2+/Cu) + (0.059/2) · lg(a1(Cu2+))] = = (0.059/2) · [lg(a2(Cu2+)) - lg(a1(Cu2+))]= (0.059/2) · [lg(a2(Cu2+)/a1(Cu2+))] ЭДС = (0.059/2) · lg[a2(Cu2+) / a1(Cu2+)] ЭДС = (0.059/2) · lg[1/0.1] = (0.059/2) · 1 = 0.0295 В.
Примерно 0.03 В (30 мВ) - немного, но такое напряжение вполне можно измерить тестером.
Перейдем к эксперименту
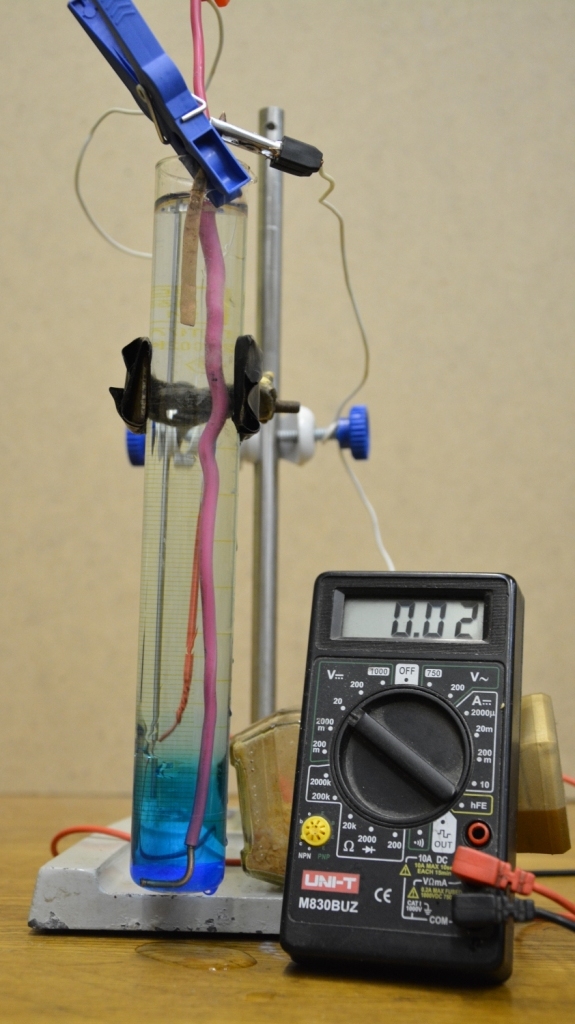
Решил все упростить и провести опыт в мерном цилиндре на 100 мл. Идея такая: оба медных электрода находятся в одном и том же сосуде, но контактируют с раствором сульфата меди разной концентрации. Это очень просто.
На дно цилиндра насыпал несколько грамм медного купороса, добавил немного воды, встряхнул - чтобы соль частично растворилась. Воды было заведомо недостаточно, чтобы растворить весь медный купорос и бОльшая его часть осталась в виде осадка на дне. Цилиндр закрепил в штативе. Потом аккуратно, небольшими порциями стал добавлять в цилиндр дистиллированную воду - так, чтобы она стекала вниз по стенкам цилиндра и не смешивалась с раствором на дне. Воду добавил почти доверху. Раствор сульфата меди (вместе с осадком) был на дне, а поверх его - вода. Четкой границы, как между маслом и водой, не получилось: синий раствор плавно переходил в бесцветную воду. Снизу жидкость была синей, выше - бледно-синей, еще выше - чуть заметно синей. Верхние слои жидкости были бесцветными: синей окраски катионов меди в них не было заметно (очень разбавленный раствор катионов меди). На дно раствора нужно было опустить изолированный медный провод, причем с нижней части провода изоляция была снята - в результате медь контактировала бы с кристаллами сульфата меди, с его насыщенным раствором, но не контактировала бы с разбавленным раствором сульфата меди и очень разбавленным раствором сульфата меди - поскольку средняя и верхняя часть провода были заизолированы. Это первый электрод нашего гальванического элемента: медь, опущенная в раствор соли меди с более высокой концентрацией. Сверху цилиндра закрепил расплющенную медную трубку - чтобы она контактировала только с "чистой" водой (очень разбавленный раствор катионов меди). Это второй электрод нашего гальванического элемента: медь, опущенная в раствор соли меди с более низкой концентрацией. Осталось бы только замкнуть цепь - соединить электроды с клеммами тестера. Но я сделал чуть по-другому: поместил медные электроды в цилиндр до того, как долил поверх раствора сульфата меди дистиллированную воду, подключил к электродам клеммы тестера - и только потом долил в цилиндр поверх раствора сульфата меди дистиллированную воду. Когда вода покрыла верхний электрод - цепь замкнулась. Потек электрический ток. Напряжение небольшое: в первые мгновения - 0.10-0.09 В, потом быстро упало до 0.03-0.02 В, но на бОльшее не стоило и надеяться (выше мы уже провели расчет потенциала концентрационного элемента с медными электродами - получилось 0.03 В). Итак, нам удалось сконструировать концентрационный гальванический элемент. Очень примитивный, зато он работает. |

Концентрационный гальванический элемент |

|

|

|

|

|

|

|

|
|
|
Но это еще не все: можно продемонстрировать зависимость потенциала нашего элемента от разницы концентраций ионов меди возле электродов. В нашем мерном цилиндре концентрация катионов меди падает при движении со дна цилиндра вверх (причем очень неравномерно - большая часть растворенного сульфата меди в самом низу).
На дне находится насыщенный раствор сульфата меди, сверху - очень разбавленный раствор сульфата меди. Верхний электрод закреплен прищепкой (он контактирует с очень разбавленным раствором ионов меди). Нижний электрод - изолированный медный провод, который просто лежит на дне. Его можно двигать вверх-вниз (только очень аккуратно, чтобы не перемешать раствор!). Если электрод поднимать вверх, то он будет контактировать с раствором сульфата меди со все более низкой концентрацией - в результате напряжение гальванического элемента будет падать (в идеале - до 0 В, когда он окажется в том же очень разбавленном растворе, что и верхний электрод). Теперь если электрод постепенно опускать вниз (на дно) - разница потенциалов будет расти, пока не вернется к первоначальному значению, поскольку нижний электрод будет контактировать с раствором сульфата меди со все более высокой концентрацией Cu2+ и, наконец, он снова окажется в насыщенном растворе на дне. Теория - теорией. Теперь - практика. Поскольку напряжение нашего гальванического элемента низкое, переключил шкалу тестера на милливольты (1мВ = 0.001 В). Нужно было это сделать сразу, но лучше поздно, чем никогда. Показания - 22 мВ. Поднимаю нижний электрод верх. На границе, где интенсивно-синий раствор переходит в слегка синий - уже 20 мВ, а дальше падение пошло стремительнее: на полвысоты цилиндра - 6 мВ, еще выше и 0 мВ - напряжение упало до нуля, хотя нижний электрод был все еще на несколько сантиметров ниже верхнего (закрепленного) электрода. Еще выше (уже выше низа верхнего электрода) и разница потенциалов - минус 1 мВ, еще выше - минус 4 мВ - электроны пошли в противоположном направлении! Опускаю электрод вниз. Электроны снова должны потечь в прежнем направлении, а напряжение - снова расти. Но не тут-то было! Да - направление тока изменилось на первоначальное и, по мере опускания электрода, напряжение снова стало расти. Но при поднятии и опускании электрода проявилась сильная асимметрия напряжения. По мере опускания электрода напряжение росло гораздо медленнее, чем до этого падало во время подъема электрода вверх. Например, на половине высоты цилиндра напряжение было все еще минус 4 мВ (электроны текли в обратном направлении), ноль был достигнут только на границе интенсивно-синего и бледно-синего растворов (т.е. почти у самого дна), при дальнейшем погружении электрода постепенно восстановилось прежнее напряжение 23 мВ. Почему наблюдалась такая асимметрия? Одна из явных причин в том, что электродное равновесие достигается далеко не мгновенно, причем явно медленнее, чем я опускал и поднимал электрод. |

Поднимаю электрод |

|

|

|

|

|

|

|

|

Опускаю электрод (на дно) |

|

|

|

|

|

|
|
После напряжения решил измерить силу тока. Когда нижний электрод находился на дне, сила тока составила 15 мкА (микроампер, 1 мкА = 10-6 А), когда стал поднимать электрод - ток постепенно упал сначала до нуля, а потом электроны потекли в противоположном направлении (знак "-" перед показаниями тестера), сила тока составила 2 мкА.
Когда постепенно опустил электрод вниз, электроны снова потекли в первоначальном направлении, сила тока прошла через ноль, затем выросла до первоначального значения. Как и в случае напряжения, наблюдалась асимметрия - при погружении электрода ток рос гораздо медленнее, чем падал при поднятии электрода. |

|

Поднимаю электрод |

|

|

|

|

|

Опускаю электрод |

|

|

|

|

|