Гальванический элемент
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 8 2009 Журнал Химиков-Энтузиастов |
Фруктовая батарейка В.Н. Витер |
|
В окружающем нас мире очень важную роль играют химические источники тока. Они используются в мобильных телефонах и космических кораблях, в крылатых ракетах и ноутбуках, в автомобилях, фонариках и обыкновенных игрушках. Мы каждый день сталкиваемся с батарейками, аккумуляторами, топливными элементами. Несмотря на большие различия в конструкции и назначении, химические источники тока работают по схожему принципу.
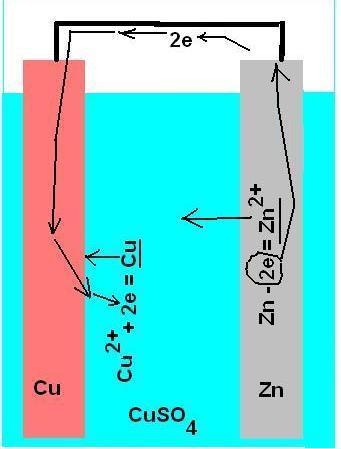
В раствор электролита погружено два электрода. На первом электроде какое-то вещество отдает свои электроны, они двигаются по внешней электрической цепи ко второму электроду, где эти электроны присоединяет другое вещество. На первом электроде проходит процесс окисления, на втором - восстановления. Окисляться может, как материал электрода (цинк, железо, магний, натрий), так и вещество, растворенное в электролите (водород, метанол). Окислителем служит вещество, растворенное в электролите, например, ионы водорода и металлов, кислород или расплавленная сера. Первый электрод заряжен отрицательно (он отдает электроны в систему), второй - положительно (он забирает электроны из системы). В цепи течет электрический ток. Рассмотрим это на простом примере. В стакан с раствором сульфата меди опустим две пластинки: цинковую и медную. Соединим пластинки проводом. Ионы цинка будут переходить в раствор, а электроны, которые при этом освободятся, перейдут через проводник к медной пластинке. На поверхности меди ионы Cu2+ присоединяют электроны, превращаясь в нейтральные атомы. В результате, цинковая пластинка будет растворяться, на поверхности медной пластинки будет оседать металлическая медь, а по проводу потечет электрический ток: Zn - 2e- => Zn2+ Cu2+ + 2e- => Cu Цинковый электрод заряжен отрицательно, медный положительно. Восстановителем служит цинк, окислителем - ионы меди в растворе. Если вместо раствора медного купороса использовать разбавленную серную кислоту, то окислителем будут ионы водорода, а если просто подсоленную воду - роль окислителя будет играть кислород. |

Гальванический элемент |
|
Итак, чтобы сделать гальванический элемент нам необходимо: два электрода, окислитель, восстановитель и электролит.
Возьмем три пластинки: медную, железную и магниевую - они будут служить электродами. Чтобы измерить напряжение, нам необходим вольтметр, для этих целей вполне подойдет цифровой (или аналоговый) тестер. А в качестве "стакана" с электролитом мы используем большой и красивый... апельсин. Сок фруктов и овощей содержит растворенные электролиты - соли и органические кислоты. Их концентрация не очень высока, но нас это вполне устраивает. Итак, положим апельсин на стол и воткнем в него три наших электрода (медный, железный и магниевый) [1]. К каждому из электродов предварительно прикрепите по проводку (для этого удобно пользоваться "крокодильчиками"). Теперь присоедините контакты тестера к медному и железному электроду. Прибор покажет напряжение около 0.4-0.5 В. Отсоедините контакт от железного электрода и подключите его к магниевому. Между медным и магниевым электродами возникнет разница потенциалов около 1.4-1.5 В - примерно как у "пальчиковой" батарейки. И наконец, гальванический элемент железо-магний даст напряжение около 0.8-0.9 В. Если поменять контакты местами, то показаниях прибора изменится знак ("+" на "-" или наоборот). Другими словами, ток потечет через вольтметр в противоположном направлении. __________________________________________________ 1 Разумеется, электроды не должны между собой соприкасаться. |

Батарейка из апельсина. Левый электрод медный, правый - железный (гвоздь) |

Подключены магниевый и медный электроды |

Подключены магниевый и железный электроды |
|
Вместо апельсина можно использовать грейпфрут, яблоко, лимон, луковицу, картофель и многие другие фрукты или овощи. Любопытно, что батарейки из апельсина, яблока, грейпфрута и луковицы давали довольно близкие значения напряжения - разница не превышала 0.1 В [2]. Восстановителем в нашем случае служит железо или магний, окислителем - ионы водорода и кислород (которые содержатся в соке). Обратите внимание, что железо в гальваническом элементе медь-железо заряжено отрицательно, а в элементе железо-магний - положительно. Если у вас нет магния, эксперимент можно провести и с двумя электродами - медным и железным. Вместо железа можно взять цинк или кусочек оцинкованной жести. Цинковый электрод должен дать большую разность потенциалов с медью и меньшую с магнием.
__________________________________________________ 2 Во всех случаях электроды были те же самые. |

Батарейка из фруктов и овощей |

|

|

|

|
|
В случае цитрусовых, эксперимент выглядит особенно красиво, если разрезать плод поперек, так, чтобы были видны "дольки" и вставить в них электроды (обычно так разрезают лимон). Если плод разрезать вдоль, это будет выглядеть не так эффектно.
|

|
|
Приведенные цифры не следует воспринимать как абсолютные. Напряжение нашей батарейки зависит от концентрации ионов водорода (а также - других ионов) в соке фруктов и овощей, скорости диффузии кислорода, состояния поверхности электродов и других факторов. Напряжение сделанной вами батарейки может значительно отличатся от того, что наблюдалось в данном эксперименте.
Можно соединить несколько фруктовых батареек последовательно - это увеличит напряжение пропорционально количеству взятых фруктов (см. схему ниже). Предлагаю вам сделать этот эксперимент самостоятельно. |

|

|