
Пороховой вулкан. (Реакция калиевой селитры с углем и серой)











| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2015 Журнал Химиков-Энтузиастов |
Химические вулканы В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Пороховой вулкан. (Реакция калиевой селитры с углем и серой)
Закрепите в штативе металлическое кольцо и поставьте в него фарфоровую выпарную чашку. Поместите в чашку 5-10 г нитрата калия КNO3 и расплавьте содержимое в пламени горелки. Отставьте горелку в сторону и раскалите в ее пламени кусочек древесного угля (размером около 1 см). После чего бросьте уголек в расплав. (№ 4 2009) Уголь сразу же начинает ярко гореть, при этом он будет бегать по поверхности расплава и подпрыгивать. Теперь высыпьте в расплав половину чайной ложки порошка серы. Появятся яркое желто-белое пламя и белый дым оксидов серы. Все это напоминает активное извержение вулкана. Опыт будет выглядеть особенно эффектно, если показывать его в сумерках или ночью на открытом воздухе. Обратите внимание: серу нужно добавить до того, как сгорит уголь. Реакции угля и серы с нитратом калия можно выразить уравнениями: 4КNO3 + 5С = 2К2CO3 + 2N2 + 3CO2 2КNO3 + 4S = К2S + N2 + 3SO2 При взаимодействии КNO3 и серы также могут образовываться К2SO4 и SO3. Смесь из 75% нитрата калия, 10% серы и 15% угля называется черным порохом [1]. Черный порох был известен еще в древнем Китае и многие века служил основным взрывчатым веществом. Выполняя опыт, будьте осторожны: раскаленный уголь и брызги расплавленной серы нередко вылетают из чашки. Поэтому перед опытом нужно надеть защитные очки, а после начала горения отойти на расстояние полтора-два метра. Ни в коем случае нельзя наклоняться над чашкой и прикасаться к ней, пока процесс не закончится и все вещества не остынут. Рядом не должно быть никаких легковоспламеняемых материалов. Данный эксперимент выглядит гораздо красивее при выполнении его в широкой пробирке [2]. __________________________________________________ 1 Это только одна из многих рецептур: в зависимости от назначения пороха, качества исходных компонентов, страны, исторических традиций и т.д. состав черного пороха может значительно варьироваться. Подробнее о черном порохе см. подборку статей Порох [ссылка], а также книгу Келли Дж. - Порох. От алхимии до артиллерии: история вещества, которое изменило мир [ссылка] 2 См. Горение угля и серы в расплаве калиевой селитры (№ 5 2012) [ссылка]; Горение серы в расплаве селитры; Горение угля и серы в расплаве селитры [ссылка] |

Пороховой вулкан. (Реакция калиевой селитры с углем и серой) |

|

|

|

|

|

|

|

|

|

|

|
|
На дно высокого химического стакана насыпают слой песка толщиной 3-4 см и ставят фарфоровую чашку, в которую из пипетки наливают по 10 мл концентрированной азотной кислоты HNO3 (дымящая азотная кислота плотностью 1.50 г/мл) и концентрированной серной кислоты Н2SO4 (плотностью 1.84 г/мл). Стакан с чашкой помещают в вытяжной шкаф и из пипетки приливают по каплям только что перегнанный скипидар. Каждая капля, попадая на поверхность смеси двух кислот, воспламеняется и сгорает с выделением густого черного дыма с большим количеством копоти.
Азотная кислота является окислителем скипидара, а серная кислота действует как обезвоживающее средство. При сгорании скипидара образуются вода и диоксид углерода СО2. Фотографии и видео эксперимента вы можете посмотреть в статьях Самовоспламенение скипидара (нитрующая смесь) [ссылка] и Воспламенение скипидара под действием дымящей азотной кислоты [ссылка]. |
Воспламенение скипидара смесью азотной и серной кислот |
|
В 1898 г. немецкий инженер-металлург Ганс Гольдшмидт изобрел способ выплавки металлов из их оксидов с помощью алюминия как восстановителя. Для этого использовалась смесь порошков алюминия и оксида металла, которую ученый назвал термитом (от греческого "терме" - жар, теплота).
В случае термита из Fe3O4 и алюминия развивается температура около 2400°С, а сама эта реакция начинается, когда температура достигает 1000°С. Способ получения металлов с помощью термита назвали алюмотермией, а смесь порошков оксида металла и алюминия - термитом Гольдшмидта. Алюмотермия является частным случаем металлотермии, которую открыл в 1856 р. Н.Н. Бекетов. На сегодняшний день известно много самых разнообразных термитных составов. В роли восстановителя может выступать не только алюминий, но и магний, кальций, ферросилиций, бор, бориды, кремний, титан и др. В качестве окислителей также берут фториды или хлориды малоактивных металлов и даже тефлон (фторопласт-4). Термиты служат не только для получения металлов, но и для сварки, а также в качестве боевых зажигательных смесей. Теперь проведем реакцию горения термита Fe3O4 [4] + Al, которая внешне напоминает извержение лавы из кратера вулкана. Для опыта предварительно готовят совершенно сухой речной песок, высушивая его при 200°С в сушильном шкафу или просто в духовке. Одновременно высушивают небольшой керамический горшок. Широкую металлическую емкость (тазик, сковородку и т.п.) наполняют сухим песком, а над ним укрепляют в кольце штатива глиняный цветочный горшок и закрывают его донное отверстие листом фильтровальной бумаги. Высушенные порошки оксида железа Fe3O4 и алюминия смешивают в соотношении 3:1 по массе. Этой смеси - термита - берут не более 200 г (около 50 г Аl и приблизительно 150 г Fe3O4) и засыпают ее в горшок на 3/4 его объема. Для приготовления термитной смеси не следует вместо алюминиевого порошка брать алюминиевую пудру. Алюминиевая пудра содержит окисленный алюминий, что сильно мешает началу реакции. Но главная неприятность состоит в том, что алюминиевая пудра содержит много воздуха, а это приводит к сильному разбрызгиванию очень горячей смеси. В термитной смеси, засыпанной в горшок, делают по центру углубление и помещают в него запал - обрезок магниевой ленты, зачищенной мелкозернистой наждачной бумагой. С помощью длинной лучинки зажигают магниевую ленту и быстро отходят в сторону на расстояние 2-3 м. После того как сгорает запал, начинается бурная реакция. Над горшком появляется пламя и дым, из него вылетают раскаленные частички смеси, а из донного отверстия вытекает струйка расплавленного железа, образовавшегося по реакции: 8Al + 3Fe3O4 = 6Fe + 4Al2O3 Алюминий - металл более активный, чем железо, поэтому он отнимает кислород у оксида железа, превращаясь при этом в оксид алюминия. Когда расплавленное железо остынет, извлекают образовавшийся королек из песка и очищают от шлака - оксида алюминия. Теперь становится очевидным, почему песок должен быть совершенно сухим. Из влажного песка будет испаряться вода, и капли расплавленного железа начнут разбрызгиваться. В этом случае опыт станет крайне опасным. Если проводить эксперимент на улице, то в качестве одноразового реакционного сосуда подойдет и железная консервная банка, которую закапывают в песок. Получить Fe3O4 можно действием избытка раствора аммиака на раствор, который содержит равные количества солей Fe(II) и Fe(III). Выпадает осадок, его фильтруют, промывают водой, сушат и прокаливают примерно при 200°С. __________________________________________________ 4 Иногда предлагается использовать Fe2O3, это допустимо, но опыт получится хуже, чем в случае Fe3O4 |

Термитная смесь Fe2O3 + Al |

Горение термита |

Горение термита |

Горение термита на поверхности замерзшего озера Смотреть Видео (3 Мб, .mp4) |
|
Этот опыт требует большой подготовки, он порадует тех, кто не боится подобной работы. Вначале готовят бумажную гильзу или патрон. Из листа бумаги вырезают прямоугольник шириной 4 см и длинной 10 см. Его наворачивают на обрезок круглой деревянной палки диаметром 6-8 мм и длиной 12-13 см, смазав бумажную заготовку клейстером с внутренней стороны на ширину 3-4 см. Последний оборот бумаги также смазывают клейстером и плотно прижимают к деревянной вставке. Затем вставку выдвигают на 1 см и освобождают гильзу на ее конце. Этот конец с двух противоположных сторон сгибают, чтобы получилось донышко, смазывают клейстером и придавливают деревянной вставкой к плоской поверхности. Полученную таким образом гильзу снимают со вставки и сушат. После этого готовят смесь из 8 г тщательно растертого в фарфоровой ступке нитрата калия КNO3 и 2 г мелкозернистого древесного угля, которую и насыпают в гильзу, слегка утрамбовывая деревянной вставкой. Когда гильза будет почти заполнена, вставляют конец фитиля и досыпают смесь. Выступающий конец фитиля должен иметь длину 3-4 см.
Фитиль - это слабо скрученная льняная веревка или шнур толщиной 3-5 мм, вываренная в водном растворе ацетата свинца в течение 5-10 минут. Раствор должен содержать на каждые 10 г соли 20 мл воды. Пропитанную солью свинца веревку сушат, а потом протирают суконкой для удаления ворса, который мог бы увеличить скорость горения фитиля. Она должна быть около 25 см/ч. Теперь все готово, пора привести "вулкан" в действие. Гильзу закапывают в сухой песок, помещенный в железное ведро или железную банку, оставляя 1/4 высоты гильзы над песком, и поджигают фитиль, а потом отходят от вулкана на расстояние 2-3 м. Фитиль воспламеняет смесь, и из гильзы начинает вылетать сноп мелких искр с дымом, вырывается розоватое пламя. Вулкан действует 2-3 минуты, а потом извержение прекращается. Горение смеси ведет к образованию К2СО3, оксидов углерода и азота. Если в смесь добавить щепотку нитрата бария Ва(NО3)2 то пламя приобретет зеленый цвет. Добавка нитрата стронция Sr(NО3)2 предает пламени красный цвет. |

|

|
|
|
Горение угля и серы в расплаве нитрата калия В.Н. Витер |
|
(№ 6 2009)
В пробирку насыпьте порошок KNO3, чтобы высота его слоя составляла 3-4 см. Верхнюю часть пробирки закрепите в штативе под углом 45 градусов [3]. С помощью газовой горелки нагрейте содержимое пробирки: сначала аккуратно (чтобы не треснуло стекло), потом сильно - до полного плавления KNO3 и начала выделения пузырьков кислорода.
__________________________________________________ 3 В случае опыта с горением угля пробирку более удобно закрепить почти вертикально. |

Нагревание нитрата калия (калиевой селитры) |
|
Теперь проведем эксперименты по горению угля и серы.
Горение угля в расплаве калиевой селитры
Возьмите кусочек дерева (размером примерно 1 х 1 х 1.5 см) и аккуратно обуглите его в пламени горелки. Когда уголек раскалится, бросьте его в пробирку с расплавом селитры. Не прекращайте нагревать пробирку. Желательно, чтобы пламя горелки было в районе верхней части расплава. Когда раскаленный уголь коснется расплава KNO3, начнется активное его горение. Место контакта будет светиться ярко-желтым, послышится шипение, образуется много черного дыма. Если уголек в начале опыта погаснет - попробуйте раскалить и кинуть в расплав еще один, при этом не забывайте нагревать в пламени горелки пробирку в том месте, где проходит граница расплав-воздух. 4KNO3 + 5C = 2K2CO3 + 2N2 + 3CO2 |

Горение угля в расплаве нитрата калия |

|

|

|

|

|

Горение серы в расплаве нитрата калия В расплав KNO3 бросают кусочек серы |

Скоро мы будем наблюдать несколько коротких, но очень ярких вспышек паров |

Основная масса серы при этом может не загореться |

Воспламенение расплавленной серы произойдет немного позже |

Аккуратно будем добавлять новые кусочки серы |

Пробирка начнет изгибаться и вытягиваться |

|

|

В результате плавления стекла дно пробирки отпадет |

Горение серы в расплаве нитрата калия |

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Техника безопасности
Описанные эксперименты связаны с повышенной опасностью: как для самого экспериментатора, так и для зрителей. Поэтому их необходимо выполнять очень аккуратно, но, ни в коем случае не бойтесь.Работать следует в защитной маске из оргстекла, в крайнем случае - в защитных очках. Берегите лицо и глаза! Поблизости не должно быть никаких горючих предметов. В противном случае, опыт может закончиться пожаром. Под пробирку подставляют металлический лист или лоток с песком. Отверстие пробирки должно быть направлено в сторону от экспериментатора и окружающих. Не следует добавлять серу в расплав селитры слишком быстро - это может привести к выбросу из пробирки кусочков горящей серы. При съемках экспериментов пострадало около десяти пробирок. Вот некоторые из них: |
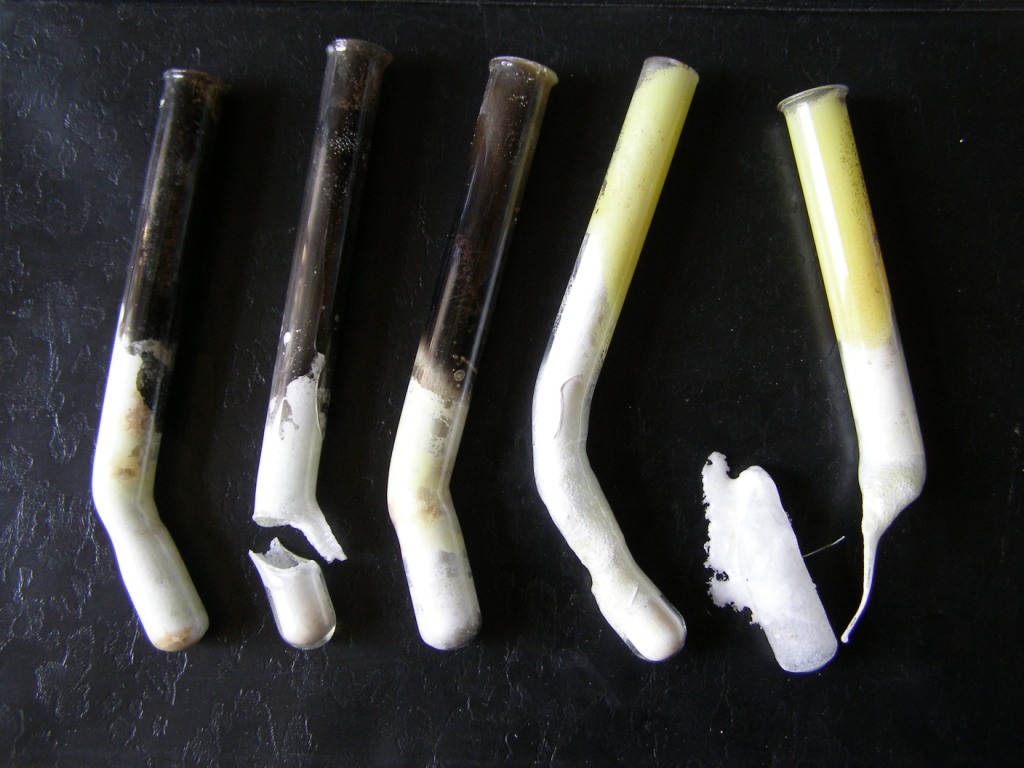
|