
Разложение бихромата аммония















| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2015 Журнал Химиков-Энтузиастов |
Химические вулканы В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Бихроматный вулкан (Разложение бихромата аммония)
В фарфоровой ступке разотрите 50 г [1] оранжево-красных кристаллов бихромата аммония (NH4)2Cr2O7. Порошок насыпьте горкой на большой лист металла или асбестового картона. На вершине "вулкана" сделайте углубление - "кратер" и налейте туда 1-2 мл спирта. Спирт поджигают, в помещении гасят свет. Начинается активное разложение бихромата аммония. При этом появляется сноп ярких искр и образуется серовато-зеленый Cr2O3 "вулканический пепел". Объем оксида хрома во много раз превышает объем исходного бихромата аммония. Опыт очень напоминает извержение настоящего вулкана, особенно на заключительной стадии, когда снопы красных искр прорываются из глубины пушистого Cr2O3. №4 2009 Реакция разложения бихромата аммония протекает с выделением большого количества тепла, поэтому после поджигания соли она протекает самопроизвольно - до тех пор, пока весь бихромат не разложится. (NH4)2Cr2O7 = Сr2O3 + N2 + 4H2O Впервые за разложением бихромата аммония наблюдал первооткрыватель этого вещества - Рудольф Беттгер (1843 г.). Есть несколько модифицированных вариантов данного опыта. Например, насыпьте горку сахарной пудры и сделайте в ней углубление, в которое засыпьте бихромат аммония (NH4)2Cr2O7. Подожгите бихромат. Начало опыта ни чем не отличается от описанного выше эксперимента. Однако, оксид хрома Сr2O3, который образовался в результате разложения, является катализатором окисления сахарозы. Поэтому если в конце разложения бихромата смесь перемешать, опыт перейдет во вторую стадию. Потом почти сгоревшую, но еще горячую горку посыпьте селитрой, при этом получатся красивые мерцающие огни, разъедающие массу. __________________________________________________ 1 Можно использовать и меньшее количество бихромата аммония, но тогда опыт будет менее красивым. С другой стороны, брать более 200 г бихромата аммония не имеет смысла. |

Разложение бихромата аммония |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Горение смеси магния и иода при попадании капли воды |

|
|

|
|

|
|
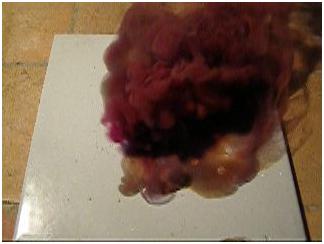
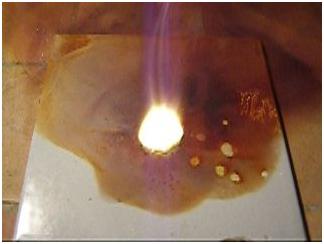
С грубодисперсным порошкообразным алюминием этот опыт не получается, магниевую стружку использовать можно, но в этом случае не всегда происходит воспламенение.
Показанная на фотографиях реакция Mg + I2 началась неожиданно: во время включения фотоаппарата из пипетки (которую я держал в другой руке) вылетело несколько мелких брызг воды, одна из которых попала в смесь. Взаимодействие началось моментально. |