lena5528 wrote:
Но не пойму как перейти с мольной доли, на моляльность раствора. (Я приняла количество вещества всего раствора 1 моль, тогда количество вещества соли 0,08 моль, воды 0,92 моль, перешла на массу, соответсвенно 5,96 г и 16,56 г).
Моляльная концентрация - количество молей KCl в килограмме растворителя (воды). Массу KCl находить не нужно.
m = n*1000/n0*M = 0,08*1000/0,92*18 = 4,83 моль/кг.
lena5528 wrote:
дана температура кристаллизации, а константа дана эбулиоскопическая для кипения растворов
1) Если имелась в виду криоскопическая константа (которая для воды равна 1,86), то, подставив это значение в формулу
 t = i*K*m
t = i*K*mполучаем изотонический коэффициент і < 1, тогда как его значение всегда от 1 и выше.
2) Если под словом "кристаллизация" имелось в виду кипение, а "-3,7" -не абсолютное значение, а разница с Ткип. чистой воды, то подставляем всё как есть:
 t = i*Е*m;
t = i*Е*m; і = 1,47.
i = 1 +
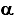 (n-1) = 1 +
(n-1) = 1 + 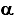 ;
;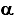 = 0,47 (а не 0,7).
= 0,47 (а не 0,7).Так что задача действительно несуразная.

