У О. Ольгина описан опыт с получением натриевого зеркала внутри маленькой лампочки путем электролиза натриевой селитры:
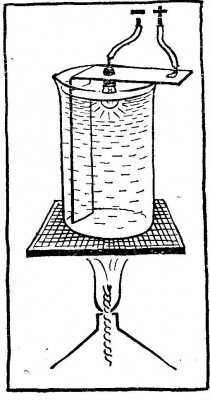
И еще один, не вполне обычный опыт с электрической лампочкой, но не с большой, а от карманного фонаря. Укрепите ее в полоске жести, согнутой под прямым углом, и вставьте полоску в небольшой химический стакан так, чтобы стеклянный баллон лампочки оказался внутри стакана и был обращен к его дну. Подключите лампочку к батарейке: выступ на цоколе, самый крайний его участок соедините с отрицательным полюсом, а полоску жести — с положительным. Обратите внимание: припаивать проводники нельзя, потому что во время опыта припой может расплавиться. Надо придумать механический контакт или же использовать патрон от старого карманного фонаря.
До начала опыта выньте лампу из стакана и насыпьте в него нитрат натрия (нитрат калия в этом случае не годится; почему — станет ясно позже). Поставьте стакан на асбестовую сетку или металлическую пластинку и нагрейте его на пламени газовой горелки или спиртовки; сухой спирт не очень удобен, так как трудно регулировать температуру расплава. Селитра плавится при 309 °С, а при 390 °С уже разлагается; вот в таком интервале и придется поддерживать температуру. Для этого изменяйте либо размер пламени, либо расстояние до стакана. Следите, чтобы расплав не застывал, даже с поверхности.
В расплавленную селитру осторожно опустите лампочку. Большая часть стеклянного баллона должна быть погружена в расплав, но следите за тем, чтобы верхняя часть цоколя, к которой припаян проводник, не соприкоснулась с селитрой — произойдет короткое замыкание. Зажженную лампочку подержите в селитре около часа, потом отключите ток, погасите горелку и аккуратно доставьте лампочку. Когда она остынет, промойте ее водой, и вы увидите, что лампочка изнутри покрыта зеркальным слоем!
Мы уже говорили, что при нагревании заряженные частицы в стекле приобретают подвижность (поэтому и зажглась лампа, когда трубку нагревали спичкой). Главные действующие лица—ионы натрия: уже при температуре выше 300 °С они становятся достаточно подвижными. Само стекло остается при этом совершенно твердым.
Когда вы погрузили включенную лампочку в расплав селитры, то стекло, из которого сделан баллончик, оказалось в электрическом поле: спираль — отрицательный полюс, расплав, который соприкасается с полоской жести,— положительный. Подвижные ионы натрия начали двигаться в стекле в сторону катода, т. е. по направлению к спирали. Иными словами, они перемещались к внутренней стенке баллона.
Значит, зеркальный налет изнутри натриевый? Да. Но как же ионы превратились в металл?
Раскаленные металлы (в том числе и те, из которых изготовлена спираль) испускают электроны. От спирали они попали на внутреннюю поверхность стекла и соединились там с ионами натрия. Так образовался металлический натрий.
Но почему для опыта не годится калиевая селитра? Ведь нитрат вроде бы и не участвует в процессе... Нет, участвует. Когда ион натрия стал нейтральным атомом, в стекле осталась отрицательно заряженная ионная дырка. Тут и нужна натриевая селитра: из ее расплава под действием электрического поля в стекло проникают ионы натрия и заполняют дырки. А ионы калия примерно в полтора раза больше ионов натрия, они не смогут войти в стекло. В калиевой селитре лампа просто треснет.
Такой необычный электролиз через стекло иногда применяют на практике, чтобы получить слой очень чистого натрия, или, более строго, — спектрально чистого.
Говорят, этот эксперимент взят из очень серьезного физического практикума, но я не видел не одного человека, который бы его воспроизвел. Поэтому решайте сами - верить или нет.
