Кукурбитурил - тривиальное название группы органических макроциклических кавитандов состава (C
6H
6N
4O
2)
n, построенных из нескольких (5⩽n⩽10) гликолурильных фрагментов, соединенных через метиленовые мостики.
Кукурбитурил был впервые получен в 1905 г. путём конденсации в кислой среде формальдегида и гликолурила (продукта конденсации мочевины и глиоксаля). Однако методы того времени не позволили правильно определить его состав и структуру. Впервые кристаллическая структура этого соединения была определена только в 1981 г. По данным РСА, кукурбитурил представляет собой макроциклический кавитанд, имеющий форму полого бочонка, в плоскости дна и крышки которого находятся атомы кислорода карбонильных групп (порталы). Своё тривиальное название — кукурбитурил (cucurbituril) — этот кавитанд получил в связи с внешним сходством формы молекулы с тыквой (лат. cucurbitus).
Attachment:
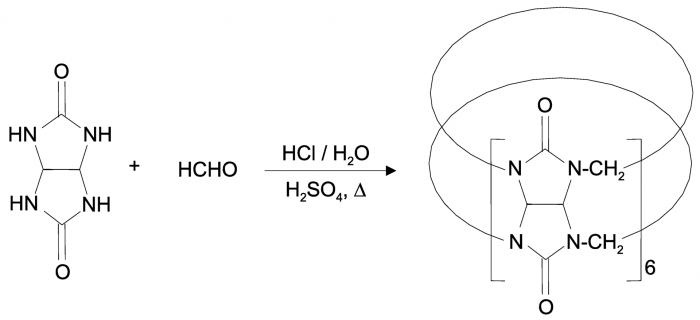 SynthesisCB6.png [ 44 KiB | Viewed 51354 times ]
SynthesisCB6.png [ 44 KiB | Viewed 51354 times ]
Кукурбитурил — бесцветное кристаллическое вещество, труднорастворимое в воде или органических растворителях, но хорошо растворимое в некоторых минеральных (HCl, H2SO4, CF3SO3H) и карбоновых кислотах (например, HCOOH), в водных растворах солей многих металлов. Уникальное строение, простота в получении, термическая устойчивость (не разлагается при нагревании до 400 °C) делают его удобным для синтеза разнообразных супрамолекулярных соединений. В настоящее время кукурбитурил легко доступен и, в частности, включен в каталог фирмы «Merck».
Размеры внутренней полости молекулы кукурбитурила (высота ~6 Å, внутренний диаметр ~5,5 Å) позволяют включать небольшие органические молекулы или ионы (образуя комплексы гость—хозяин), а образованные карбонильными группами порталы (диаметры порталов составляют ~4 Å) способны связывать катионы металлов. Определение строения кукурбитурила дало импульс широкому исследованию этого соединения как макроциклического кавитанда. Сходный по размерам полости с α-циклодекстрином и 18-краун-6-эфиром, кукурбитурил имеет более высокий отрицательный заряд на донорных атомах кислорода, что повышает стабильность его аддуктов с положительно заряженными ионами. Ещё одним отличием кукурбитурила от других кавитандов, например, каликсаренов, является его структурная «жёсткость» — он практически не изменяет свою форму при включении различных молекул-гостей и, следовательно, проявляет более высокую селективность при образовании соединений включения. Образование таких соединений включения доказано кристаллографически, а также различными физико-химическими методами — абсорбционные, флуоресцентные и ЯМР-спектры молекул-гостей изменяются при переходе его из окружения растворителя (как правило, слабо кислые водные растворы) в гидрофобную полость кукурбитурила. Кукурбитурил образует стабильные соединения включения с аминами и диаминами, алкил- и бензиламмониевыми ионами, молекулами красителей.