| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 1 2008 |
Хромит меди (катализатор дегидрогенизации) |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
1) Раствор 260 г меди (II) нитрата тригидрата в 900 см3
воды из-под крана при 80°C добавить при
перемешивании к раствору 178 г дигидрата бихромата натрия и 225 мл 28% NH3, доведённого до
объёма 900 мл (при 25°C). Осадок отделить вакуумным фильтрованием и трижды промыть методом
декантации. Хромат меди-аммония оставить на ночь сушиться при 75-80°C. Далее - мелко измельчить и
добавить маленькими порциями в литровую 3-горлую колбу, оборудованную мешалкой Хершберга из
нержавеющей стали, которая достаёт почти до дна колбы. Колбу частично погрузить в металлическую
баню из сплава Вуда при 350°C (при 300-320°C можно получить хорошие результаты). Время
добавления - 15 минут (много паров), смесь размешивали при 350°C в течение ещё 15 минут.
Охлажденный черный порошок, Cu(CrO2)2, готов для используется в качестве катализатора
дегидрогенизации.
2) Сливают вместе эквимолярные количества горячих растворов нитрата меди и хромата аммония, при этом выпадает осадок, его оставляют на ночь, а потом фильтруют на воронке Бюхнера. Сушат при 100 градусах, далее разлагают получившийся комплекс при 300-350 градусах (можно просто прожарить на чистой ненужной сковородке, при этом нагрев плитки должен быть включен на полную мощность). При разложении выделяются оксиды азота, поэтому процедуру необходимо делать под тягой или на свежем воздухе. Как только перестанут выделяться газы, препарат прокаливают при перемешивании еще 15 мин. Катализатор готов. Сульфат меди лучше не использовать, а растворить моток медной проволоки в HNO3 или провести обменную реакцию медного купороса и нитрата кальция (выпадает осадок гипса, его отфильтровывают и в растворе остается нитрат меди). Нитрат кальция продается как удобрение, или же его можно сделать, осторожно прибавляя окись кальция к азотной кислоте. Ну а если нет хромата аммония, то можно взять раствор бихромата натрия (бихромат калия хуже растворяется в воде) и смешать его с соответствующим количеством водного аммиака. (по материалам интернета) |
Получение азотной кислоты |
|
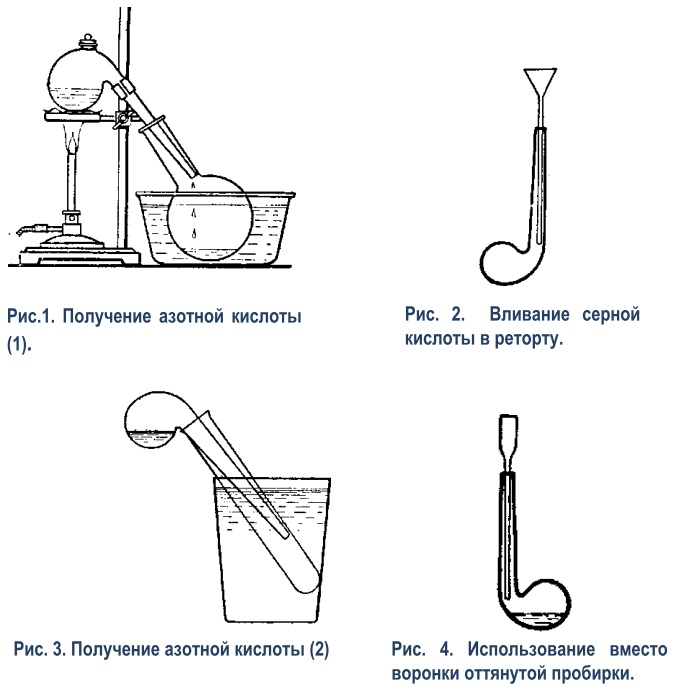
1) Собрать прибор, как на рисунке 1, состоящий из реторты (нетугоплавкой на 200 мл с тубулусом и
притертой пробкой), помещенной в штативе, на сетке, и колбы, служащей приемником. Колбу погрузить
в чашку с водой. Если есть водопровод, то можно поместить колбу в большую воронку, соединенную с
раковиной. На колбу пустить струю воды через изогнутую стеклянную трубку, соединенную резиновой
трубкой с краном водопровода и укрепленную в зажиме штатива.
В реторту поместить 30-40 г селитры (KNО3 или NaNО3). Прилить в реторту через вставленную в тубулус воронку столько концентрированной серной кислоты H2SO4 (уд.в. 1,84), чтобы после размешивания стеклянной палочкой получилась жидкая кашица. Закрыв реторту, начать нагревание, сначала осторожно, затем сильнее. В колбе довольно скоро набирается несколько миллилитров азотной кислоты, достаточных для испытания. Прекратить нагревание и, дав реторте немного остыть, вынуть ее (захватив полотенцем) из колбы и погрузить концом в укрепленную на штативе вторую колбу, цилиндр и т.п., чтобы пары азотной кислоты по возможности не попадали в воздух. Во избежание растрескивания реторты нагревание ее следует вести на песочной бане (железная чаша с нетолстым слоем чистого песка). Показав учащимся полученную азотную кислоту, испытать ее действием на лакмус, индиго или на стружки меди (в бокалах или стаканчиках). Индиго нужно взять немного и в слабом растворе. Лакмус от разбавленной азотной кислоты краснеет, а от концентрированной в первый момент краснеет, а затем быстро обесцвечивается. Медные стружки нужно сначала облить водой, а затем уже приливать кислоту. Последний опыт следует производить под тягой. За неимением реторты с тубулусом можно воспользоваться и обыкновенной. Тогда кислоту нужно наливать через длинную воронку (рис.2). Смешивание кислоты с селитрой можно произвести осторожным взбалтыванием; |

|
|
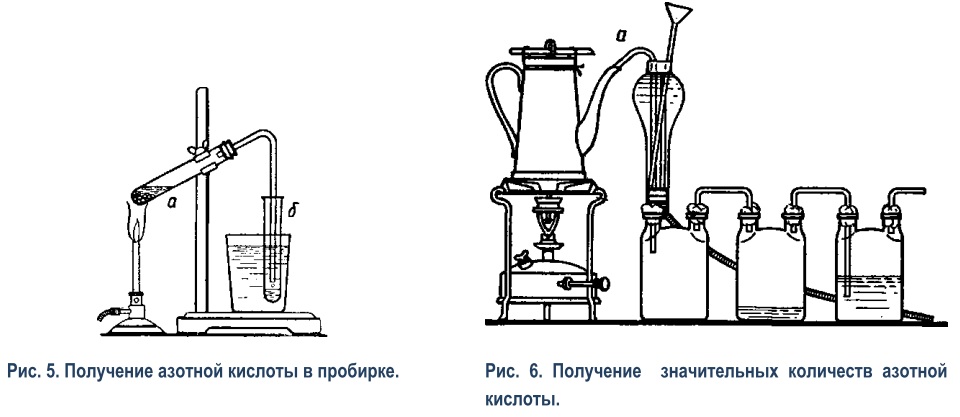
2) Для лабораторного опыта реторта может быть на 10 мл, приемником может служить пробирка, погруженная в стакан с водой (рис.3). Для наливания серной кислоты служит вороночка (рис.4), оттянутая из пробирки. Укрепить сухую пробирку в зажиме штатива в таком положении, как показано на рисунке 3, погрузив ее в стакан с холодной водой. Насыпать в реторту немного селитры КNO3 (около 1/4 пробирки). Держа реторту, как показано на рисунке 4, вставить в нее воронку и влить немного концентрированной серной кислоты Н2SO4 (уд.в. 1,84), столько, чтобы она смочила всю селитру. Вливать очень осторожно, чтобы не обжечь руки. Вынуть воронку так, чтобы не запачкать стенки реторты, и поместить в пробирку или в стаканчик с водой (не класть воронку на стол!). Вставить реторту в пробирку (рис.3) и осторожно нагревать, держа горелку в руках. Не греть стекло выше уровня жидкости. Когда в пробирке наберется некоторое количество азотной кислоты, прекратить нагревание. Когда реторта остынет, вынуть ее и вымыть под краном. Не класть на стол невымытую реторту. 3) За неимением маленькой реторты вполне возможно получать азотную кислоту и в пробирке, закрытой пробкой с газоотводной трубкой (рис.5). Пробка во время опыта разрушается довольно быстро и под конец нередко вываливается вместе с трубкой, но учащиеся успевают получить нужные 1-2 мл азотной кислоты и попутно наблюдают действие азотной кислоты на органическое вещество. При работе необходимо соблюдать те же предосторожности, что и при опыте с ретортой. Особенно, важно следить, чтобы учащиеся не нагревали пробирки выше уровня жидкости, так как при этом пробирка может легко лопнуть. По окончании опыта, вынув пробку с отводной трубочкой, поместить ее в пробирку, но не класть на стол. Горячую жидкость из пробирки, в которой шла реакция, учащиеся могут сразу же вливать в общую банку, что облегчит мытье пробирок. |
|
|
4) Получение значительных количеств азотной кислоты. Для этой цели используется прибор, изображенный на рисунке 6, при помощи которого легко получить до килограмма концентрированной азотной кислоты. Роль «реторты» в этой модели завода для получения азотной кислоты играет эмалированный кофейник (или чайник). Чтобы крышка кофейника не пропускала паров азотной кислоты, между крышкой и краями кофейника помещается прокладка из асбестового картона. Кружок картона смачивается водой и зажимается между краями кофейника и крышкой. После того как прокладка таким образом сформирована, ее вынимают вместе с крышкой и просушивают. Не следует забывать, что только концентрированная азотная кислота делает железо пассивным и на него не действует, а в эмали всегда могут быть трещины. Поэтому влажную прокладку применять нельзя. Для того чтобы плотно прижать крышку к краям кофейника, служит приспособление, состоящее из двух петель, сделанных из медной проволоки, обвивающей верхний рант кофейника. В петли вставляются концы деревянной планки, в середину которой ввинчен обыкновенный большой винт для дерева (шуруп). Конец шурупа, который нужно затупить напильником, упирается в крышку. Если шишечка крышки к ней привинчена, то ее следует отвинтить, отверстие закрыть кусочком асбестового картона, поверх последнего положить кружочек из жести и т.п., в который и упереть конец винта. Если шишечка составляет с крышкой одно целое, то конец шишечки нужно спилить напильником, чтобы получилась плоскость для упора винта. К «реторте» присоединен холодильник из лампового стекла, и «конденсационные горшки» в виде двугорлых склянок. Все соединения должны быть сделаны без пробок и резины. Вместо пробок можно воспользоваться асбестовой ватой. Трубка а вставляется в носик кофейника поглубже, и затем в носик изнутри забивается асбестовая вата. Для этого удобно воспользоваться загнутым на конце в виде крюка большим гвоздем и т.п. В двугорлые склянки трубки вставляются тоже на асбестовой вате. На трубку навертывается жгут из ваты и затем плотно забивается в отверстие склянки. Соединения с кофейником должны быть сделаны при помощи сухого асбеста (см, выше), для остальных же соединений асбест можно взять влажный, благодаря чему без особых затруднений получаются достаточно плотные соединения. Первая из склянок оставляется пустой, во вторую наливается немного воды, в последнюю вода наливается до половины, а трубка слегка погружается в воду. В первой банке собирается главная масса азотной кислоты, во второй — поглощается водой большая часть паров, в третьей же — удерживаются остальные пары. Если прибор можно поместить под тягу или есть приспособление для отвода газов за окно, то третью склянку можно и не ставить. Если все соединения сделаны аккуратно, то во время работы пары азотной кислоты почти совсем не выделяются из прибора. Вместо двугорлых склянок можно взять и обыкновенные. Тогда обе вставленные трубки сначала обвивают асбестовой ватой, каждую отдельно, затем вместе, и вставляют одновременно. В кофейник насыпать селитры КNO3 или NaNO3 почти до половины высоты; прилить столько концентрированной серной кислоты, чтобы после размешивания получилась кашицеобразная масса; крышку закрыть и начать нагревание. Воду в холодильник лучше пустить непрерывной струей, но можно и подливать по мере надобности. (В.Н. Верховский. Техника и методика химического эксперимента в школе.) |
Дымящая азотная кислота |
|
1) В колбе 150 мл HNO3 обрабатывают 300 мл
конц. H2SO4, причем обе кислоты предварительно
охлаждают смесью льда и соли. При смешивании также необходимо охлаждать. После этого в приборе
создают вакуум и осторожно нагревают смесь на водяной бане. HNO3 при 22 мм рт.ст. и температуре
37-40°С отгоняют в приемник в виде бесцветной жидкости. Дистиллят ещё раз перегоняют таким же
образом с двойным объёмом конц. H2SO4. При давлении 20 мм рт.ст. и температуре
36-40°С перегоняется чистая кислота.
Свойства: Тк = 83°С, плотность = 1,522. Не может храниться на свету в течение длительного времени без разложения. (Руководств по препаративной неорганической химии. Под ред. Г.Брауера) (кустарные условия) 2) В перегонном аппарате смешивают HNO3 (65%) и H2SO4 (конц) в соотношении 1:1 (по объему). Смесь сильно разогревается, дальнейший нагрев проводят с помощью электрической плитки или примуса. В случае отсутствия проточной воды холодильник заполняют водой и охлаждают в ходе процесса снегом (снаружи). Смесь закипает и в интервале 3-4 градуса перегоняется практически 100% HNO3. Все части прибора должны быть соединены на шлифах, а отвод аллонжа закрыт хлорокальциевой трубкой (она довольно эффективно предохраняет от паров HNO3). Иногда полученная кислота имеет желтоватый цвет. (по материалам интернета) |
Получение коллоидного серебра |
|
1) К 200 мл 10% раствора AgNO3 прибавить смесь 200мл 30% раствора FeSO4 и 280 мл 40%
раствора цитрата натрия и около 50 мл 10% NaOH Выпадает осадок коллоидного серебра, которому
дают осесть и промывают методом декантации 4-5 раз 10% раствором нитрата аммония, затем 2 раза
96% спиртом. После этого осадок центрифугируют и осторожно высушивают на водяной бане или в
эксикаторе.
2) К 100 мл 0,001N раствора AgNO3 капают несколько капель свежеприготовленного раствора танина и 1 каплю 1% раствора Na2CO3. При нагревании образуется золь. 3) Восстановление 0,001N раствора AgNO3 (100 мл) при нагревании 0,005% раствором гидразин гидрата, который прибавляют по каплям. 4) К 30 мл лимоннокислого натрия (0,01 N) прибавляют 0,2 мл 0,25%-ой желатины, 1 мл 0,001 N-го гидрохинона и 2 мл 17%-го AgNO3, значение рН=9,8 раствора добиваются введением буферного раствора. Коллоидные растворы серебра получают при комнатной температуре. 5) Существует также способ электрораспыления, который требует соответствующего оборудования. Его описание можно найти в "Руководстве по неорганическому синтезу" под ред. П. Брауэра, М., "Мир", т.4,1985. Получается черный зернистый порошок, содержащий прибл. 97% серебра. Коллоидное серебро растворяется в воде с образованием буро-красного или черного мелкодисперсного золя серебра. |
|
Оглавление
< Опыты по химии > < Беспламенное горение уротропина > < Олимпиадные задачи > |