
Борная кислота, банка с борной кислотой, борная кислота перекристаллизованная
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2014 Журнал Химиков-Энтузиастов |
Элементы вокруг нас agrael |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Время от времени каждый из нас задавался вопросами: какие элементы, особенно редкие, нас окружают? [1] Сегодня я расскажу о своих поисках и находках. Заранее прошу извинить за рассказ от первого лица - это часть истории моей жизни, поэтому без местоимений "я", "мне", "моё" никак не обойтись. К тому же, для лучшего понимания направлений моих поисков потребуется довольно пространное вступление.
Началось все с того, что однажды я вынужден был сесть за рентгенофлуоресцентный спектрометр. Прошу понять меня правильно - вообще-то по образованию я как раз оптик-спектроскопист, но особым желанием брать на себя такую ответственную работу не горел, тем более по совместительству. Однако, нужда заставила. Впрочем, о том, что такое энергодисперсионный рентгенофлуоресцентный анализ, я расскажу как-нибудь в другой раз. А сейчас главное. С самого начала я задался вопросом, где брать реактивы. Для приготовления аттестованных смесей, предназначенных для градуировки спектрометра (справедливо также и для классического спектрального анализа с дуговым или искровым возбуждением спектра), необходимо иметь так называемую "матрицу", в которую добавляется определяемый элемент (или несколько элементов). В случае единичных проб или заводской лаборатории, имеющей дело с одним-двумя продуктами всегда можно взять в качестве "матрицы" чистый анализируемый продукт и в него уже добавлять "примеси". Но как быть в случае постоянно меняющегося валового состава геологических проб? Особенно если и содержание "матричных" элементов (т. е. породобразующие) также требуется определять? Наилучшим выходом в таком случае будет, разумеется, имитация полного состава образца, включая матрицу, используя стехиометрические соединения - в весовом анализе их называют "весовые формы", то есть соединения с известными массовыми долями составляющих элементов. Конечно, многие используют сертифицированные стандартные материалы (калька с английского certified reference material - CRM), но опять же, это больше применимо для заводских лабораторий с небольшой номенклатурой анализируемых продуктов. И потом, мы же не ищем легких путей, верно? Итак, ниже в, так сказать, "алфавитно-менделеевском" порядке (то есть по возрастанию номера элемента - атомного числа) представлены элементы и места, где их можно найти. Комментарии часто касаются именно рентгенофлуоресцентного анализа. Попутно я постарался предоставить данные для тех, кому эти элементы нужны в растворимой форме. Элементы, которые мне не были нужны в работе, либо те, про нахождение которых в обычных окружающих нас веществах или изделиях мне ничего не известно, в списке пропущены. Некоторые элементы и их соединения могут показаться тривиальными, но я их все равно поместил для полноты картины. Дополнения даны серым шрифтом - прим. ред. Литий. Важнейший компонент современных емких аккумуляторов электрической энергии. Но извлекать его из аккумулятора, тем более с ненулевой остаточной емкостью, крайне не рекомендуется - в случае взрыва можно устроить пожар и остаться без глаз. Впрочем, для рентгеновского излучения литий все равно прозрачен. Бериллий. Из него изготовлены окошки рентгеновских трубок, так как он представляет самый легкий устойчивый на воздухе материал, который практически прозрачен для рентгеновского излучения. Содержится также в минерале берилл и его разновидностях, в том числе в изумруде. Соединения бериллия и его пыль крайне токсичны! Бор. Тут все понятно - бура (натрий тетраборнокислый десятиводный) или еще лучше борная кислота H3BO3. Последняя - хорошее связующее для приготовления прессованных образцов, к тому же может быть использовано и как "обволакивающее" - то есть без разбавления пробы она помещается в "стаканчик" из борной кислоты и все вместе прессуется. Падение с высоты метра-полутора, как правило, выдерживает. Люди, незнакомые с данной техникой, часто спрашивают, а что за пластмасса, в которую запрессована проба? Немаловажное достоинство - прозрачна для рентгеновского излучения, при двукратном разбавлении пробы сигнал падает всего лишь на 25% - то есть только за счет более "размазанных" в объеме частиц пробы. Второе достоинство - десятикратный температурный градиент растворимости, т. е. ее легко рекристаллизовать при регенерации из таблеток, уже ненужных для анализа. Недостаток - по нормальной цене можно приобрести только на складах и в объеме двадцатипятикилограммового мешка, а в аптеках действует наценка на малые количества от трех до десяти(!) раз. Зато можно взять только 10 граммов. Мы с этого начинали - устроили ажиотаж в местных аптеках, скупив там все запасы. А потом нашли, где приобрести мешок. Интересно, что подумали в аптеках? |

Борная кислота, банка с борной кислотой, борная кислота перекристаллизованная |
|
Углерод. Мне он понадобился для имитации матрицы торфяников. Казалось бы, все просто - берем активированный уголь, и - вперед! Так, да не так. Уголь активированный готовят из косточковых либо из березы (уголь БАУ). Как ни крути, зольность там отнюдь не нулевая. Может, он и хорош с точки зрения развитой поверхности, но как "матричная" добавка пригоден не всегда (содержит до двух процентов оксида кальция). Сажа газовая PBk6, PBk7 [2] вроде как должна продаваться в художественных магазинах, но мне без связующего не встречалась. Выход из положения был найден довольно просто - осторожным обжигом сахара без доступа открытого огня. Зольность такого угля практически нулевая. Это что касается аморфного углерода. Графит добывается из электродов (например, от марганцево-цинковых элементов питания). "Чистым" источником карбонат-иона CO32- может служить разрыхлитель для теста - карбонат аммония (не все разрыхлители из него!). Можно, конечно, использовать и соду (см. ниже), но тогда полученный продукт придется отмывать еще и от ионов натрия. Алмазы можно упомянуть с чисто академической точки зрения.
|

Сахарный уголь, уголь БАУ в заводской упаковке, уголь БАУ россыпью |
|
Азот. Тут стоит упомянуть аммиачную селитру - источник сразу и аммиака (при взаимодействии со щелочью), и нитрат-иона. Недобросовестные кондитеры часто используют вместо карбоната аммония.
|
Нитраты бария, стронция и свинца, нитрит калия |
|
Натрий. Тут простор для исследований. В хозяйственных магазинах продается сода каустическая NaOH и сода кальцинированная Na2CO3, причем слово "кальцинированная" никакого отношения к кальцию не имеет, а означает, в переводе с германо-романских языков, "обожженная" (приходилось встречаться с заблуждениями на эту тему). Тут следует отметить, что из растворов, как правило, карбонат натрия кристаллизуется с десятью молекулами воды, поэтому его и обжигают, чтобы удалить кристаллизационную воду. Оба вещества, несмотря на категорию "что есть", вполне пригодны для многих применений. Только стоит учитывать, что NaOH - едкое вещество и потому непригоден для приготовления аттестованных смесей, к тому же сильно притягивает влагу и расплывается, а карбонат Na2CO3 со временем притягивает из воздуха влагу и углекислый газ, в результате чего с поверхности превращается в гидрокарбонат. Поэтому зачастую лучше использовать соду пищевую NaHCO3 - натрий углекислый кислый, он же натрий двууглекислый, он же гидрокарбонат или бикарбонат - в зависимости от фантазии производителя. И, наконец, поваренная соль - хлорид натрия NaCl. Лучше всего брать сорт "Экстра", неиодированную. Чем меньше примесей, тем менее гигроскопична (чистый NaCl вообще устойчив, даже во влажном воздухе). Очистить соль можно долгим стоянием в горячем насыщенном водном растворе - за счет процессов рекристаллизации примеси (в особенности KCl) уйдут в раствор.
Магний. Про магний из анодов для бойлеров и т.п. сказано уже много [3]. Я же упомяну аптечные препараты - сульфат магния ("горькая соль") MgSO4·7H2O, жженая магнезия MgO, белая магнезия (иногда просто "магнезия"), представляющая собой основной карбонат магния нестехиометрического состава, иногда можно встретить нормальный карбонат состава MgCO3·3H2O (теряет карбонат-ион при нагревании выше 100°С и при кипячении с водой). Безводный магнезит MgCO3 применяется при изготовлении специальной керамики и для футеровки печей. В стекловарении используют природный или синтетический доломит nMgCO3·mCaCO3. |
Магний |
Оксид магния |

Магний карбонат, магний сульфат фармакопейный |
|
Алюминий. Трудно, пожалуй, найти более распространенный и при этом менее пригодный для аналитических целей продукт, чем алюминий и его окись в окружающих нас предметах. Металлический алюминий чаще всего идет в сплаве с магнием и/или кремнием, алюминиевая фольга зачастую содержит хорошую примесь (до 1%) железа, даже электротехнический алюминий далеко не всегда чист хотя бы на две-три "девятки". Гидрат окиси алюминия очень неохотно расстается с водой. Если верить справочникам, полностью весовую форму Al2O3 можно получить, лишь подвергнув длительному обжигу при 1200°С, а по некоторым источником - до 1500(!). При этом плохо прокаленный оксид снова жадно притягивает воду из воздуха, а хорошо прокаленный теряет способность растворяться в кислотах. Довольно чистый (и при том безводный) оксид алюминия представляет собой бесцветный корунд. Для многих целей годится даже синтетический рубин (как и упомянутый ниже фианит можно приобрести в магазинах для ювелиров или рукоделия), но дороговато выходит. В детской присыпке оксид алюминия идет вместе с тальком и отдушками. Чистая белая глина тоже может быть использована как исходный материал для получения соединений алюминия.
|
Алюминий гранулированный |
Оксид алюминия - почти раритет |
Необработанные гранаты - минералы состава M2+3M'3+2(SiO4)3; Существует два изоморфных ряда гранатов: M2+3Al2(SiO4)3 и Ca3M'3+2(SiO4)3 |
|
Кремний. Довольно чистый кремний можно наковырять с полупроводниковых радиодеталей - используемые для создания p-n переходов примеси вводятся в микроколичествах, несущественных для большинства применений в аналитике. К тому же, всегда можно аккуратно "изъять" места крепления токовводов (куда и вводятся обычно примеси) и останется чистейший кремний. Разумеется, нужно сначала узнать в справочниках, действительно ли данная радиодеталь "кремневая" - например, в старой маркировке это транзисторы серий КТ (2Т). Оксид кремния добываем, выщелачивая кварциты и продукты их разрушения - кварцевый песок. Наилучшие результаты дают чисто белые куски, которые можно найти по карьерам, на берегах рек, ручьев, по ущельям в горах (я именно такие в последнее время и использую). Тут главное - не перепутать их с кальцитом. У кальцита блеск мраморный, а кварцита - "сахарный". Еще лучше, если в найденных кусках кварцита будут кристаллы кварца - горного хрусталя. Если поблизости есть камнерезная мастерская, можно попробовать поискать там. Вообще, любые бесцветные разновидности кварца или скрытнокристаллических форм вроде опала или агата подойдут. Кварц легко измельчить, нагрев до красного каления и бросив в ведро с водой - за счет внутренних напряжений он рассыплется, в отличие от кварцевого стекла, которое подобные издевательства спокойно переносит. Кварцевое стекло, кстати, тоже можно найти - им, например, защищают ультрафиолетовые лампы и изготавливают некоторую лабораторную посуду. Кварцевый песок из плавких предохранителей на десятки ампер тоже вполне пригоден для многих целей после измельчения и выщелачивания царской водкой или хотя бы соляной кислотой (выщелачивать надо обязательно только в глазурованной керамике, иначе есть риск натянуть из стекла натрий и калий). Наконец, чистейшую двуокись кремния представляет собой так называемая белая сажа, иногда продаваемая под маркой "Аэросил". Перегонкой кремнефтористой кислоты с последующим гидролизом в воде можно также получить очень чистый продукт. На худой конец, можно прокалить органосилоксаны (известные в народе под названием "силикон") и получить мелкораздробленный SiO2. Еще один не совсем очевидный способ - подействовать кислотой на "жидкое стекло" - в осадке получим гель кремнекислоты, который можно использовать либо в таком виде, либо прокалить и получить силикагель. Последний можно взять и готовый, только надо выбирать прозрачный, как слеза - иначе там будет слишком много примесей. "Деактивировать" силикагель можно, если прокалить его после как можно более тонкого измельчения (чтобы разрушить пористые структуры). Тогда он перестанет притягивать влагу.
|
По часовой стрелке с левого нижнего угла: кремнекислота из жидкого стекла, кристаллы кварца, кварцевый песок, кварцит истертый и очищенный, оксид кремния (IV) по ГОСТ 9428-73, силикагель
|
Ферросилиций |
Кварц |
|
Фосфор. В литературе описано много способов добычи фосфора из намазки от спичечных коробков. В виде фосфатов он содержится во многих удобрениях - например, аммоний фосфат (или попросту "аммофос"). В виде фосфорной кислоты он содержится в жидкостях-ингибиторах коррозии (например, польское средство "Эвипасс").
Сера. В садовых магазинах продается черенковая сера и серный цвет. Перечистив ее перегонкой, можно получить довольно чистый продукт. |

Сера очищенная: кусок и порошок; сера черенковая: куски и порошок |
|
Хлор. Хлорид натрия можно использовать как источник хлорид-ионов (например, при осаждении хлорида серебра). Прочие хлоросодержащие (особенно в положительных степенях окисления) продукты меня не интересовали, однако, про них можно прочитать в соответствующей литературе [4].
Аргон. Да-да, вы не ослышались. Именно аргон. Дело в том, что его в воздухе содержится довольно много (около 1,288 % масс). И получаемый на рентгеновской спектрограмме пик не просто заметен, но и оказывает влияние на соседние пики. В библиотеках спектральных линий, поставляемых вместе с прибором, его, как правило, не бывает - считается, что он не нужен (как и прочие инертные элементы - которых действительно чрезвычайно мало). К тому же, для точных измерений все равно лучше использовать вакуумированные камеры, а для неточных - "и так сойдет". Однако, я счел за лучшее его снять и поместить в библиотеку для дальнейшего использования, так как характер измеряемых образцов зачастую препятствует применению вакуума (да и зачем лишний раз насос запускать?). И результаты, смею заверить, стали лучше. Снимал его очень просто - в отсутствие материала пробы экранировал от крышки прибора высоким пластиковым стаканом (тогда флуоресцентное излучение материала крышки не мешает) и запустил съемку. Калий. У меня имеется весовая форма - гидрокарбонат калия, поэтому я не сильно интересовался вопросом, где бы его раздобыть [5]. Сразу напрашивается на ум калийная селитра или другое калийное удобрение (например, "калийная соль"- технический хлорид калия) - но требуются определенные усилия для получения весовой формы. Дело в том, что используемые для аттестованных смесей весовые формы не должны содержать гигроскопичных, жадных до углекислого газа, летучих или легко окисляемых (или, наоборот, окисляющих) компонентов. В строительно-хозяйственных магазинах, по идее, должен продаваться поташ (карбонат калия), но мне не встречался. |
Гидрокарбонат калия (бикарбонат калия) |
|
Кальций. Как и в случае натрия, имеем широкий простор для фантазии. Первое, что приходит на ум с точки зрения чистого продукта - таблетки кальция глюконата (кальциевая соль глюконовой кислоты с брутто-формулой C12H22CaO14). Потом мел, гипс и т. д., и т. п. Глюконат кальция имеет смысл использовать, если важно отсутствие его аналогов - стронция и бария: бария не содержит вовсе, а стронция - лишь следы на уровне тысячной доли процента. С мелом, гипсом и т. п. все гораздо сложнее. Благодаря тому, что химические свойства магния значительно отличаются от химических свойств кальция, магний легко может быть отделен, но стронций и барий всегда присутствуют в технических продуктах и даже в продуктах категории "ч". Например, в "реахимовском" карбонате кальция я обнаружил до 0,8% BaCO3 (!) и до 0,15% SrCO3. Дело в том, что ГОСТ 4530-76 не нормирует содержание этих элементов, даже для препарата квалификации "хч"! А содержание "не менее 98%" (для хч и чда - 99%) самого карбоната кальция при этом легко выполняется. Поэтому чистый карбонат кальция я впоследствии добывал из... обычной жженой извести, продаваемой на рынке! Местная как раз была свободна от бария (по крайней мере, в пределах чувствительности моего прибора - т. е. на уровне 0,005%) и содержала лишь немного (около 0,01% по отношению к кальцию) стронция. Вот тут и пригодился карбонат аммония - я добавлял его после растворения извести в азотной кислоте, нейтрализации и фильтрования от примесей оксида кремния и полуторных оксидов, при этом возможные примеси образующегося основного карбоната магния растворимы в аммонийных солях, в отличие от карбоната кальция. Оставалось лишь хорошо просушить продукт. В зависимости от условий получения (температура, избыток осадителя) можно получить как крупнопорошковый, так и "пушистый" продукт. Полученный таким образом карбонат кальция весьма чист (три-четыре девятки) и его можно использовать как исходное вещество для получения окиси, гидроокиси и солей кальция. Ну или по прямому назначению - имитировать кальцит/мрамор/известняк или в смеси с оксидами алюминия и кремния - плагиоклазы группы анортита (присутствие карбонат-иона в большинстве случаев не мешает) или известковые скарны (а вот тут присутствие карбонат иона приветствуется), или же в смеси с карбонатом магния - доломиты. Сульфат кальция (гипс, алебастр) часто также содержит примеси Sr и Ba, поэтому его лучше синтезировать из чистого карбоната действием на него серной кислоты. Можно использовать и сульфаты щелочных металлов или аммония, но этот метод применим лишь после растворения карбоната в азотной кислоте (хлориды чрезвычайно трудно отмываются). Вообще, сульфат кальция не очень удобен как весовая форма ввиду способности поглощать произвольное количество влаги с образованием кристаллогидратов, содержащих от 0,5 до 2 молекул воды, причем стехиометрия устанавливается лишь по истечении достаточно продолжительного времени. Известный из литературы факт, что из водных растворов сульфат кальция кристаллизуется с двумя молекулами воды лишь отчасти отражает истину, на самом деле "область гомогенности" в данном случае довольна широка за счет элементарного удерживания влаги, а сушка легко может привести к потере кристаллизационной воды. Более пригоден так называемый "мертвый" гипс - обожженый при температурах выше 220°С, но ниже 1200°С. Зато полученный снежно-белый продукт представляет собой прекрасный наполнитель для красок.
|

Нижний ряд: порошок чистого природного кальцита, переосажденный карбонат кальция - крупные частицы, переосажденный карбонат кальция - мелкие частицы;
верхний ряд: кальцит - кусок и друза, ангидрит, синтетический сульфат кальция |
Кальций углекислый для люминофоров и кальций углекислый для спектрального анализа |
|
Титан. Здесь можно посоветовать пигмент - титановые белила PW6, представляющие собой оксид титана (IV). Еще я обнаружил, что некоторые виды корректоров-замазок содержат именно оксид титана. Тут основная проблема - выжечь связующее вещество. Поэтому лучше все же поднапрячься и найти сухой пигмент. Также титан содержится в составе так называемых "черных песков". Вообще, это один из самых распространенных элементов в земной коре.
|

Оксид титана осч |
|
Ванадий. В обычной жизни ни сам ванадий, ни его соединения встретить не получится. Максимум, что можно увидеть - это слесарные инструменты, на которых написано "vanadium", но там ванадия всего лишь около 0,2%, а зачастую недобросовестные изготовители наносят только надпись, "забыв" добавить ванадий в сплав. Существует пигмент PY184, представляющий собой ванадат висмута, но я его в художественных магазинах не встречал. Пятиокись ванадия используется как катализатор при производстве серной кислоты.
|

Восстановленный алюминием ванадий (содержание алюминия ок. 15%), оксид ванадия (V), ванадат аммония |
|
Хром. Металлический хром можно "добыть" со старых [6] хромированных деталей - кроватей, декора машин и т. п. А вот оксид хрома (III) можно добыть разными путями. Во-первых, и это самый оптимальный способ, можно взять пигмент PG17 (или его вариант PG17 Blk - может содержать примеси), известный под названием "окись хрома". [Следует отметить, что обычно банки с пигментами не очень-то герметично закрыты (обычно это видно по скатыванию порошка в комки), и перед использованием их лучше просушить при температуре 250-300°С]. Второй, менее удобный, но достаточно дешевый вариант - взять пасту ГОИ, которая содержит 72-73% окиси хрома, и выжечь из нее связующие вещества. Дело это сильно пахучее, поэтому жечь только на открытом воздухе или под вытяжкой, к тому же после сжигания можно получить примесь сульфата в количестве до 1%. И наконец, третий вариант - при наличии бихромата калия или аммония устроить химический вулкан, собрать "пепел" и тщательно промыть от оставшегося хромата. Ну и еще можно растворить нихромовую проволоку и провести химическое разделение солей никеля и хрома, пользуясь различной растворимостью в разных степенях окисления.
|

Слева - бихромат калия и полученный из него "сахаротермическим" методом оксид хрома; справа - пигментный оксид хрома (III)
|
Хромокалиевые квасцы |

Порошки металлов и их сплавов. По часовой стрелке с нижнего левого угла: хром, нихром, мельхиор, медь, латунь, в центре - цинк |
|
Марганец. В чистом виде марганец нигде не используется ввиду своей хрупкости. Если у вас есть знакомые металлурги, можете раздобыть у них кусок ферромарганца - сплава железа и марганца, используемого для раскисления сталей и внесения марганца в сплав. Хорошие сорта содержат 70-75% марганца. Фосфат марганца используют как замену более дорогому фосфату кобальта в качестве пигмента PV16 (марганец-аммоний фосфат, по некоторым данным - пирофосфат). Оксид марганца (IV) содержится в марганцево-цинковых элементах питания. К сожалению, их все сложнее и сложнее найти - постепенно вытесняются щелочными элементами в стаканах из "нержавейки". Правда, этот оксид марганца еще надо отмыть от электролита, и в использованном элементе он будет частично восстановлен до Mn3O4. Но его уже можно использовать для многих целей - например, получить алюмотермическим способом кусок металлического марганца (мне пришлось так добывать металлический марганец для целей поверки прибора - спасибо Госстандарту, заложившему в качестве источника эталонного пика гостированный марганец, тогда как годится любое его соединение). Добывать же оксид марганца из перманганата калия нецелесообразно, поэтому этот вариант мы рассматривать не будем. Очень много оксида марганца (до 80%) содержится в золе зеленого чая (в черном - гораздо меньше, видимо, теряется при сильном ферментировании).
|

Калий марганцевокислый и оксид марганца (IV) - обратите внимание на значок гербицида |
Ферромарганец (возраст скола около года) |
|
Железо. Казалось бы, что может быть проще? И вот тут мы попадаем прямо-таки в джунгли невероятного количество сортов стали. Для аналитических целей годится только чистое железо, тогда как обычное, которое нас окружает, часто содержит много примесей - либо внесенных туда специально, либо оставленных ввиду нецелесообразности от них избавляться. Самые вредные - это микропримеси кобальта и никеля, и далеко не "микро" примеси марганца, так как от них довольно тяжело избавиться химическими методами. Но для многих задач этого и не нужно. Например, моим первым источником оксида железа (III) был тридцатиграммовый гематитовый браслет, варварски истертый в мелкую пыль. Впоследствии мне удалось приобрести пигменты - английская красная PR101 и черный железоокисный PBk11. Первая представляет собой гематит Fe2O3, а вторая - магнетит Fe3O4. Из примесей обнаружены микроколичества олова, почему-то всегда присутствующего в техническом железе (тысячные доли процента) и еще меньше кадмия (скорее всего, фасовали недалеко от кадмиевых пигментов и произошло заражение). Другие железоокисные пигменты не очень годятся для аналитических целей, так как содержат глинозем. Довольно точный состав имеет карбид железа Fe3C, который можно добыть, растворив в кислоте чугун (лучше всего белый) - в осадке останутся серые чешуйки карбида. Магнетит также легко добыть самому из морского или озерного песка - нужен лишь магнит, причем ферритового вполне достаточно.
Fe3O4 содержится также в качестве черного пигмента в тонере копиров и принтеров в матрице из термоклея. В этом легко убедиться, если осторожно (не комкая) сжечь отпечатанный текст - в остатке будет серовато-белый озоленный лист (преимущественно CaO со следами углерода и TiO2, иногда BaSO4), на котором явственно проступят ярко-коричневые буквы из Fe2O3. Таким образом, неликвидные остатки порошка (со временем накапливается крупная фракция, которая плохо поднимается в контейнере и почти не пристает к валу принтера) вполне можно после окислительного обжига (для удаления клея) использовать как Fe2O3.
|

Реактивы железа и взятые для тех же целей пигменты |

Слева снизу по часовой стрелке: пигмент английская красная (Fe2O3); оксид железа (III), полученный из гидроокиси прокаливанием при 550°C; оксид железа (III), прокаленный при 800°С; пигмент черный железоокисный (Fe3O4); в центре - гидроокись железа Fe2O3·nH2O
|

Кристалл сульфата железа (II), выросший за ночь на железном стержне, помещенном в раствор железного купороса для восстановления железа (III) в железо (II). Черная взвесь - частички сульфида железа.
|

Этот же кристалл, вынутый из раствора. Диаметр магнита около 3 см. |
Хлорид железа (III) |

Ферросплавы. Слева - феррохром; справа - ферросилиций (на сколе видны пересекающиеся столбчатые кристаллы силицида); снизу - ферромарганец: темная оксидная пленка (на внешних сторонах кусков) была изначально, возраст оксидной пленки на сколах (внутренние стороны) - от 4 до 5 лет. Содержание легирующего элемента во всех показанных сплавах около 75%. |
|
Кобальт. Металлический кобальт мне в жизни не встречался. Однако, кобальт (точнее, его соединения) издревле использовался как краситель. Среди пигментов можно встретить кобальтовый синий PB28 [7] - алюминат кобальта, имеющий структуру шпинели, но о стехиометрии тут говорить не приходится. Состав можно выразить формулой CoO·nAl2O3. Причем n принимает значения от единицы и до жадности производителя - насыщенность самого пигмента мало страдает от избытка оксида алюминия, но вот цвет приготовляемых красок может в итоге сильно отличаться. Еще кобальт содержится в пигменте кобальтовый зеленый PG19 [8] , где часть оксида кобальта заменена на оксид цинка, причем это не механическая смесь, а цинк замещает собой кобальт в структуре кристаллической решетки. Еще интересны пигменты-фосфаты PV14 "кобальт фиолетовый темный" (Co3(PO4)2), PV49 "кобальт фиолетовый светлый" (NH4CoPO4) и его вариант - красно-фиолетовый PV47 (LiCoPO4), а также борат (Co,Mn)O·B2O3. Ну и самый легкий путь увидеть и потрогать соединение кобальта - бутылки синего стекла, в которых его содержание не превышает одной десятой доли процента (обычно даже около шести сотых). Стекольщики используют оксид кобальта Co3O4 как добавку для тех самых синих стекол.
|

Слева направо: осажденный фосфат кобальта, алюминат кобальта, оксид кобальта |
В звуковых динамиках чаще всего используют ферритовые магниты (они черные и хрупкие), но в динамиках советских телевизоров встречаются и магниты из сплава железа, кобальта, никеля, алюминия и меди (насколько мне память не изменяет - около 25% кобальта по массе в сплаве). Самый крупный из найденных мною магнитов весил около 100 граммов. Termoyad |
|
Никель. Самый простой способ добыть металлический никель - соскрести никелировку с любой ненужной детали - краны, смесители, элементы декора и даже с пластмассовых игрушек! Одно "но" - на всех этих деталях он нанесен на медную подложку, так как не очень любит "садиться" на другие металлы, а с медью образует очень прочное интерметаллическое соединение (медь, в свою очередь, можно куда угодно нанести гальванопластикой). Никель также входит в состав многих сплавов - в том числе монетных. Еще никель входит как изоморфная примесь в состав медного купороса (мне встречались образцы, содержащие до 1% сульфата никеля), откуда его можно извлечь дробной кристаллизацией. Содержится также в некоторых пигментах. Про растворение нихромовой проволоки с целью разделения составляющих ее элементов я уже упоминал. Из чистого никеля сделаны цифры-электроды в старых индикаторных лампах, а также управляющие сетки (вероятно, не во всех). Никелем покрыты также многие радиодетали старого производства, а также из него сделаны держатели для полупроводниковых кристаллов в некоторых транзисторах.
|
Цифры и управляющие сетки лампы-индикатора сделаны из никеля |

Никель сульфат гептагидрат |
|
Медь. Здесь, казалось бы, не должно быть особых проблем. Однако, наиболее распространенное соединение меди - медный купорос - представляет собой кристаллогидрат. Несмотря на то, что высушенный над 13% серной кислотой продукт пригоден для установки титра, в общем случае его нельзя считать весовой формой - он всегда частично выветривается, причем чем мельче кристаллы, тем больше степень выветривания. И потом, в породах медь (кроме самородной) встречается в основном в трех соединениях - оксид меди (как редкий минерал одновалентной меди куприт, так и двухвалентной - тенорит), сульфиды меди (собственно ковеллит, а также полисульфиды и различные соединения с попутными элементами, напр., халькопирит) и основные карбонаты (малахит и переходящий в него при выветривании азурит). Поэтому для добавок в аттестованные смеси соответствующие вещества надо приготовить. В частности, осаждать основной карбонат лучше всего карбонатом аммония (еще лучше, если исходный раствор меди был уксуснокислым - тогда нет необходимости отмывать продукт от посторонних катионов/анионов). При кипячении аморфный поначалу голубоватый осадок азурита превращается в хорошо фильтрующийся порошок зеленого малахита, почти точно соответствующего формуле Cu(OH)2·CuCO3. При прокаливании на обычной электрической плитке часа через два количественно переходит в оксид меди (II). Осаждая сульфид меди (II), нужно добиться гомогенного осаждения, иначе осадок может получиться нестехиометрического состава. Очень долгим (недели и даже месяцы) стоянием тиосульфата одновалентной меди можно получить сине-черный сульфид меди (I) - образует красивые псевдоморфы по игольчатым кристаллам тиосульфата, который начинает разлагаться уже через несколько дней, даже в сухом виде. При избытке тиосульфата возможно загрязнение продукта сульфидом CuS.
|

Разные цвета солей меди. Верхний ряд: тетрахлоркупрат аммония, сульфат меди пятиводный, медь углекислая основная; нижний ряд: медь уксуснокислая одноводная, оксихлорид меди, фосфат меди (II). Почти все эти соединения используются в качестве пигментов.
|

Кристаллы нитрата меди (II) |

Кристаллы нитрата меди (II) и с кристаллы сульфата меди (II) |
Хлорид меди (II) CuCl2·3H2O |
|
Цинк. Металлический цинк можно добыть из уже не раз упомянутых марганцево-цинковых элементов. Если присутствие железа некритично, а цинк нужен лишь как восстановитель, то вполне сгодится и лист оцинкованной жести. Но для приготовления аттестованных смесей и просто как реактив наилучший результат дает оксид или сульфид цинка - оба представляют собой вещества снежно-белого цвета и используются в качестве пигментов. Пигмент PW7, представляющий собой сульфид цинка ZnS, обладает фосфоресцентными и электролюминесцентными свойствами. Но чаще сульфид цинка можно встретить как часть литопона PW5 (соосажденная смесь сульфида цинка и сульфата бария) или пигмента "кадмиевый желтый" PY35 (смесь сульфидов цинка и сульфида кадмия в пропорции примерно 1:9). Оксид цинка ZnO продается в качестве пигмента PW4 "окись цинка". Последний для нас самый интересный. Во-первых, он отличается высокой чистотой, ведь для белого пигмента сотые, а иногда и тысячные доли примесей попросту смертельны - он уже не будет белым. Если же вам нужен именно сульфид, а пигмента PW7 найти не удалось - не расстраивайтесь. Хороший сульфид цинка получается гомогенным осаждением с помощью тиокарбамида из горячего щелочного раствора гидроксоцинката натрия (оксид цинка растворяется в сильнощелочной среде).
|
Почувствуйте разницу: оксид цинка реактивного "Ч" (слева) и пигментного (справа) качества. Изображение не редактировалось.
|

Осажденный тиокарбамидом из щелочного раствора сульфид цинка: справа - основная порция, слева - выпавшая при стоянии из маточного раствора |
|
Галлий. Чуть ли не единственный доступный источник микроколичеств галлия в быту - это светодиоды, в которых активным элементом чаще всего выступает арсенид галлия GaAs. Присутствует также и в других полупроводниковых элементах, но нужно знать, в каких. Если захотите добыть из светодиодов именно соединения галлия без мышьяка, имейте в виду, что при переработке получите также и крайне токсичные мышьяковую или мышьяковистую кислоты (или их соли) либо, что еще опаснее, летучий арсин AsH3, вдыхание микрограммовых количеств которого смертельно. Чтобы предотвратить образование арсина, все работы надо проводить либо в присутствии окислителей, либо отводить полученные газообразные продукты реакции в склянки, наполненные бромной водой или другим сильным окислителем. Хорошая вытяжка обязательна, на открытом воздухе такие работы проводить нельзя!
Германий. Как и в предыдущем случае, единственный источник германия в быту - полупроводниковые элементы: в старой номенклатуре это транзисторы серий ГТ (1Т) или, например, типа П210 (с очень большим по сравнению с другими моделями кристаллом), а также некоторые диоды. Как и в случае с кремнием, кристалл транзистора очень чист, микроколичества внедряемых для создания p-n переходов элементов не мешают (чаще всего вы их даже и не заметите). |

Кристаллы в транзисторах ГТ404 и П210 сделаны из германия, корпуса - из меди, покрытие корпусов и подложка-крепление кристалла - никель. |
|
Мышьяк. Входит в список СДЯВ ("сильнодействующих и ядовитых веществ" - причем союз "и" в последние годы был "компетентными органами" утерян), поэтому ни его самого, ни его соединения в свободном доступе не встретишь. Многие СЭС до сих пор в борьбе с грызунами используют зерна, протравленные оксидами мышьяка (или арсенитами/арсенатами натрия). Выше уже упоминался арсенид галлия. Но самое интересное - это зубоврачебный препарат с поэтическим названием Некразур (что можно вольно перевести как "лазурная смерть"), содержащий ровно 30% оксида мышьяка (III). Это паста густого синего цвета, которую во многих клиниках все еще используют для "лечения" зубов (точнее, для вызова некроза зубного нерва). Если повезет, то можно выпросить в зубном кабинете просроченный препарат, который они все равно выбрасывают. Еще раз напоминаю, что соединения мышьяка токсичны, смертельная доза составляет 3 грамма для взрослого человека, причем смерть весьма мучительна. Гораздо меньшие количества вызывают тяжелые отравления, и к тому же яд обладает кумулятивным действием - накапливается в организме. С другой стороны, многие элементы и их соединения, не внесенные в список СДЯВ, не менее токсичны, так что правила техники безопасности надо соблюдать при работе с любыми реактивами, особенно с солями тяжелых металлов (пусть вас не смущает название - все, что в таблице Менделеева лежит дальше кальция, уже считается "тяжелыми" элементами).
Селен. Когда я разыскивал для своей "библиотеки элементов" селен, первым делом пришел на ум селеновый выпрямитель. Как оказалось, там, помимо селена, содержится еще очень много элементов - медь, мышьяк, сурьма, может присутствовать олово, свинец и т. п. Выручили меня стекольщики, принесшие на анализ элементарный селен (используется в малых количествах для осветления стекла, а в больших - для придания ярко-красного цвета). При работе с селеном следует помнить, что его соединения гораздо токсичнее и опаснее соответствующих соединений серы. Если верить составу, указанному на средствах для депиляции, там также содержится селен (вероятно, именно его соединения придают такой нестерпимый запах этим средствам). А шампунь "Head&Shoulders" стал уже притчей. Бром. Содержится как fire retarder во многих пластиках. Бромид серебра внедрен в некоторые сорта стекол-"хамелеонов". Калий бромид используется в медицине (даже категория установлена соответствующая - "фармакопейный", судя по зеленой полоске, соответствует категории "ч"). Как и иод, встречается в торфяниках. Рубидий. В заметных количествах (до десятых долей процента) содержится в гранитах. Интересно, что природный рубидий всегда "фонит" (более четверти составляет изотоп 87Rb, который β- радиоактивен). В гражданской технике используется преимущественно как геттер в электровакуумных приборах, и иногда как фотоэмиссионный агент. В обоих случаях уступает цезию, но ввиду большей распространенности и дешевизны все же находит свое применение. Стронций. В чистом виде соли стронция используются как добавка к питанию пациентов, страдающих остеопорозом, а также при хронических отравлениях солями бария и свинца (что зачастую взаимосвязано). Используемый в медицинской рентгенографии сульфат бария часто содержит весьма заметные количества (до нескольких процентов) сульфата стронция. Та же картина и с техническим баритом, используемым как тяжелая суспензия при проведении буровых работ. Восстановив сульфаты до сульфидов путем прокаливания в смеси с углем, можно выделить соли стронция, пользуясь различной растворимостью солей бария и стронция. В качестве пигментов используются хромат стронция PY32 и титанат стронция, а также как фосфоресцентный PY8. Ни один из этих пигментов мне не попадался, однако, однажды на анализ попал алюминат стронция, активированный европием и диспрозием, и использующийся как фосфоресцентный краситель. Иттрий. Тут мы вплотную подошли к той части таблицы Менделеева, где начинается всяческая экзотика. В чистом виде иттрий или его соединения в обычной жизни не встретишь. Но в любом ювелирном магазине, или даже среди бижутерии, можно найти алмазоподобные кристаллы, очень часто неправильно называемые "цирконами". На самом деле это синтетический камень, по названию института [9], впервые его синтезировавшего, названный фианит [10] - оксид циркония, в котором кубическая алмазоподобная структура стабилизирована добавками оксида иттрия, причем его содержание колеблется на уровне 18-20%. В модных ныне керамических ножах используется практически тот же материал - циркониевая керамика, но там содержание оксида иттрия на уровне 5-7% (в тех, что мне попадались). Также содержится как заметная примесь в "кремнях" от зажигалок, сделанных из так называемого мишметалла (см. параграф про лантаноиды). |
Самоцветы. Чистый фианит - бесцветный (впоследствии был использован как источник оксида циркония с примесью 20% оксида иттрия и 1% оксида гафния), затем фианит, покрашенный кобальтом (розовый), фианит с окраской хром + неодим (болотный), рубин (красный), справа сзади два хрусталя - с хромовой окраской (зеленый) и "сапфировой"(синий) - железо + титан; правый верхний камень (сиреневый) - тоже хрусталь, подкрашен неодимом.
Видно, хрусталь имеет меньший коэффициент преломления, интересно также сравнить поведение хромофора - ионов хрома: в стекле и фианите зеленый, в корунде красный.
|

Скандий металлический, хорошо образованные кристаллы скандия, оксид скандия (Скандий - аналог иттрия) |
Кристаллы скандия, наросшие внутри чашки во время перегонки и принявшие ее форму (остаток от перегонки). |
|
Цирконий. Как писалось чуть выше, самый распространенный "источник" циркония (точнее, его оксида) в обычной жизни - это фианиты, в которых содержание ZrO2 составляет 79-81%. Долгое время я использовал истертые фианиты, которые в магазинах для ювелиров продаются, что называется, "пятачок за пучок", как добавку на цирконий и иттрий. Возвращаясь к названию "циркон", отмечу, что оно относится к минералу - силикату циркония, крупные образцы которого, действительно, используются как ювелирный камень. А в виде песка его легко добыть самому, если есть доступ к так называемым "черным пескам" - он в смеси с силикатным песком (оксидом кремния) остается в немагнитной фракции. Можно взять и обычный прибрежный песок, но там содержание циркона в немагнитной фракции будет не более 1%. Мне как-то попал в руки черный песок с индийских пляжей, так вот там содержание циркона было до 12 процентов! Именно поэтому пляжи Бразилии, Индии, Австралии и т. д. являются крупнейшими источниками промышленно добываемого циркония. Ну а металлический цирконий, если повезет, можно найти - в 90-х годах многие российские предприятия продавали сделанные из него браслеты: надо же было куда-то девать невостребованный более промышленностью цирконий!
|

"Черный песок", прошедший ручную магнитную сепарацию. Слева: сильномагнитная фракция снизу и слабомагнитная сверху (содержат титан и железо); справа: монацит сверху и циркон снизу. Черные вкрапления - захваченные механически всеми фракциями окрашенные железом частицы рутила.
|

"Черный песок", прошедший ручную магнитную сепарацию. Сильномагнитная фракция слева и слабомагнитная справа (содержат титан и железо)
|

Немагнитные фракции черного песка: весьма слабо магнитный монацит (справа) и совершенно немагнитный циркон (слева) |
|
Ниобий. В обычной жизни встретить ниобий тяжело - разве что вам "повезет" обзавестись ниобиевым имплантом для искуственных зубов. А так его можно встретить только как заместитель (или в смеси) тантала в танталовых (ниобиевых) керамических конденсаторах (там именно керамика на основе оксидов тантала и/или ниобия).
Молибден. В обычной жизни также весьма редкий металл, однако, применений ему на самом деле масса. Мне встречалась молибденовая проволока, используемая иногда вместо вольфрамовой в специальных печах. Дисульфид молибдена (соединение нестехиометрического состава, часто содержание серы больше, чем описывается формулой MoS2) используется как отличная антифрикционная добавка к маслам (возможно, вам знакомо название "Моликом"). Для "грубых" узлов (механическая КПП, цепные, планетарные передачи) однократная добавка может служить весь срок жизни механизма. Но, пожалуй, самый доступный "бытовой" источник молибдена - электрические лампочки. Нить накаливания электрической лампы сделана из вольфрама, а проволочки, которые ее поддерживают, - из молибдена [не перепутайте с электродами (токовые вводы) - они расположены по краям и более толстые; электроды сделаны из сплава железа и никеля]. На втором рисунке показаны результаты анализа этих проволочек ("усиков"). Как видите, материал проволочек, которые поддерживают спираль лампы, - молибден. Также присутствуют линии вольфрама, обусловленные испарением этого металла с поверхности спирали накаливания. |
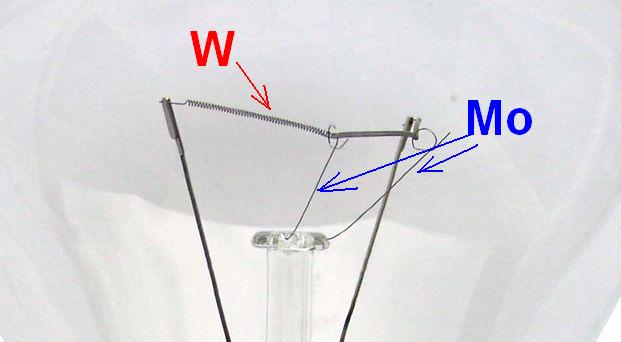
Вольфрам и молибден |
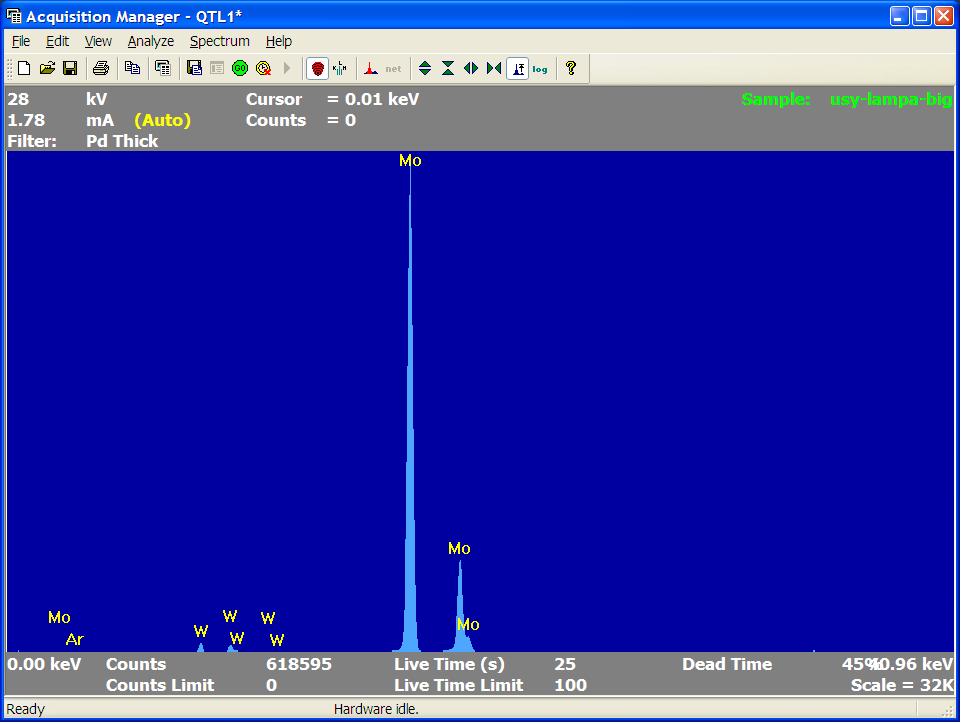
Результаты анализа проволочек, которые поддерживают спираль лампы накаливания |
Слева - молибденит MoS2, справа - халькопирит CuFeS2. В бумажных пакетах - эти же минералы, но истертые. |
|
Родий. Используется как напыление на катодах рентгеновских трубок, в платиново-родиевых термопарах, а также как компонент автомобильных катализаторов дожигания выхлопных газов. В последнем случае его содержание составляет 100-200 мг/кг, причем царской водкой в раствор можно перевести не более половины, далее необходимо жесткое хлорирование (причем зачастую керамика начинает растворяться быстрее). Так что добыть его из автомобильных катализаторов в принципе можно, но на деле будет спокойнее (и зачастую дешевле!) купить препарат в магазине химреактивов. Палладий. Однажды мне на анализ принесли медную пластину из какого-то аппарата, покрытую слоем палладия. Содержание палладия оказалось около 7%, что немало. Что это был за аппарат, узнать не удалось. Иногда попадался как примесь в свинце - до 300 мг/кг. Также он присутствует как основной компонент в платиново-палладиево-родиевых катализаторах (от 500 до 2000 мг/кг). В последнем случае в царско-водочный (растворение в азотной кислоте в данном случае малоэффективно) раствор довольно легко переходит до 90% палладия, далее справедливы замечания, сказанные выше про родий. Палладий входит в состав некоторых конденсаторов в количестве до 5%. |

Тетраэдрические кристаллы гексахлоропалладата аммония при 40-кратном увеличении |
|
Серебро. Вместе с пропущенным рутением, родием и палладием составляет первую четверку драгметаллов и на территории СНГ подлежит соответствующим нормам регулирования, по которым частным лицам все работы, связанные с очисткой драгметаллов, запрещены, при этом для предприятий разрешено этим заниматься с целью повторного использования [11]. Всем известно о серебряных контактах в пусковых реле, но следует иметь в виду, что в мощных цепях на контакты серебро всегда шло в сплаве с кадмием (10% кадмия). Очистить серебро в таком случае можно двух-трехкратным осаждением в виде хлорида. Столовое серебро практически всегда категории "sterling silver", то есть чистоты 92,5% (остальное - обычно медь). Иногда используется менее чистое - 825-й пробы. Ювелирное серебро бывает как 925, так и 975 или 985 пробы (мне встречались и та, и та). В микросхемах в качестве токовводов используется чистое серебро (там, где не используется золото). Но самое интересное из встречавшихся мне применение серебра - серебряные шарики для украшения тортов! Представляют собой шарик из желатина или другого съедобного вязкого вещества, покрытый тонким слоем серебра.
|

Серебро и его соединения. Слева направо: серебряные контакты реле (сплав, содержащий 10% кадмия); кристаллы хлорида серебра, выросшие из аммиачного раствора (металлический блеск из-за восстановленного на поверхности под действием света серебра); сульфид серебра; серебро, восстановленное из хлорида цинком
|
Хлорид серебра. Те же кристаллы, что и на предыдущей фотографии в пенициллиновом пузырьке, сразу после отделения от раствора. Обратите внимание: кристаллы росли на поверхности раствора сверху вниз. |
|
Кадмий. По существующим международным нормам использование кадмия в товарах народного потребления запрещено ввиду его токсичности (по некоторым источникам, токсичность его солей превышает токсичность солей мышьяка!). Однако, его можно встретить в сплавах - в уже упомянутых контактах, в зубном (!!!) золоте (вероятно, придает твердость). И, конечно же, сульфид кадмия остается непревзойденным пигментом желто-оранжевого ряда, но его применение на территории СНГ ограничивается художественными красками, а в некоторых странах кадмиевый желтый/оранжевый используют как антикоррозионную краску (для морских судов, поездов и т. п.). Однако, в пигментах он почти всегда в смеси с сульфидом цинка (светло-желтый) или селенидом кадмия (оранжево-красные оттенки). В обоих случаях такой продукт можно использовать в качестве источника кадмия, но дешевле будет купить оксид кадмия в магазине химреактивов. Еще раз напоминаю, что все растворимые соли кадмия чрезвычайно ядовиты! Не надейтесь на нерастворимость CdS - несмотря на то, что сульфид кадмия теоретически нерастворим в разбавленных кислотах и щелочах, принимать его внутрь крайне не рекомендуется!
|

В 1850 году английский философ и художник Джордж Фильд писал о сульфиде кадмия: "... Металл, из которого его приготовляют, редок, и его [на данный момент] мало используют, как пигмент, так что свойства еще не изучены". Сегодня сульфид, равно как и другие соединения кадмия (на фото представлен оксид - обратите внимание на массу упаковки), - крупнотоннажный продукт. |
|
Индий. Редкий металл. Используется в специальных легкоплавких припоях. Находит широкое применение в радиотехнике и электронике (в частности, в покрытии ЖК экранов), в покрытии зеркал и рефлекторов. В чистом виде используется для калибровки некоторых приборов (измеряется его точка плавления). Я совершенно случайно обнаружил заметные следы индия (сотые доли процента) в элементе "Duracell" - в центральном стержне.
Олово. Чистое олово можно найти в радиомагазинах. От продающегося там свинцово-оловянного припоя (которые не только неправильно называют "олово", но и иногда сознательно за него выдают) легко отличить по блеску - олово яркое, белого оттенка, а свинцовые припои гораздо более тусклые (за исключением среза) и серые. Оксид олова легко приготовить окислением олова концентрированной азотной кислотой и последующим прокаливанием получившегося порошка β-оловянной кислоты (с переменным количеством воды) до оксида при температуре 600-800°С. В воде и кислотах оксид олова нерастворим. |

Палочка олова, выплавленная в пробирке и полученный из нее окислением азотной кислотой с последующей прокалкой в муфельной печи оксид олова (IV). Желтоватый оттенок оксида - из-за присутствия микропримесей. |
|
Сурьма. Теоретически ее можно добыть в небольших количествах из намазки спичечных коробков. Практически разумнее поискать среди восточной косметики, где она еще изредка встречается в тонкорастертом виде (хотя чаще там будет антимонит - природный сульфид сурьмы Sb2S3).
|

По часовой стрелке с нижнего левого угла: хорошо образованные кристаллы сурьмяного блеска (сульфида сурьмы) - основной руды, из которой добывают сурьму; обычный кусок сурьмяной руды; оксид сурьмы (V) четырехводный, синтезированный окислением азотной кислотой; металлическая сурьма.
|
Металлическая сурьма |

Кристаллическая масса селенида сурьмы (III), синтезированного в пробирке из элементов. |
|
Теллур. Один из самых редких в земной коре элементов (его содержание чуть выше, чем благородных металлов). В некоторых образцах селена присутствует в виде примеси (до 700 мг/кг). Используется в некоторых фотоэлектрических элементах. Мне встречались упоминания, что теллур содержится в перезаписываемом слое компакт-дисков, но в имевшихся образцах обнаружить его не удалось.
Иод. Существует много рецептов, как достать иод из аптечной настойки. Однако гораздо интереснее добыть его из растений, где тот хорошо концентрируется. Например, морских водорослей или зеленой кожуры ("мякоти") грецких орехов. Однажды мы решили сварить варенье из зеленых грецких орехов, так пока вымачивали, запах иода стоял по всему дому, а вода окрашивалась в густой черно-коричневый цвет (видимо, за счет экстракции каких-то комплексов, ведь просто так иод в воде малорастворим). И даже после двухнедельного вымачивания варенье было почти черного цвета и явственно отдавало иодом. Коричневый цвет варенья обусловлен окислением органических соединений, а не присутствием иода. Цезий. Используется как геттер (благодаря способности поглощать остаточные количества газов) и как активный слой в фотоумножителях (благодаря наилучшей из известных работе выхода электронов). Добывать из упомянутых вакуумных приборов не очень целесообразно, но как вариант рассмотреть можно. Только следует помнить, что на воздухе цезий моментально сгорит, поэтому в металлическом виде его выделить вряд ли удастся (да и ни к чему - слишком опасно). То же справедливо и для рубидия. Барий. В параграфе про стронций я упомянул два основных источника бария - барит для утяжеления буровой жидкости и синтетический барит, используемый как контрастный агент при рентгеноскопии. Растворимые соли бария легко очищаются кристаллизацией от его аналогов. Так, из нитрата бария с содержанием стронция около 0,06% однократной кристаллизацией удалось получить 2/3 всего материала с содержанием Sr менее 0,003% и, соответственно, в оставшейся трети содержание Sr возросло до 0,2%. При медленном охлаждении (для этого почти насыщенный раствор надо оставить на еще горячей плитке) нитрат бария образует "египетские пирамиды". Лантаноиды. Помимо широко известного факта, что лантаноиды содержатся в "кремнях" от зажигалок, обычно представляющих собой мишметалл - сплав примерно 50% железа и 50% лантаноидов (преимущественно легких), или же ферроцерий (где лантаноиды представлены в основном церием с небольшими примесями остальных легких лантаноидов), некоторые лантаноиды можно встретить в значимых количествах и в других предметах. Так, лантан и церий (в виде окисей до 1%) содержатся в катализаторах - соответственно для химического крекинга нефти и в автомобильных. Неодим входит в состав "неодимовых" магнитов (неодим-железо-бор). Самарий входит в состав кобальто-самариевых магнитов, которые более дороги, чем "неодимовые", но имеют несколько большую коэрцитивную силу и значительно более термостойки. И те, и другие можно встретить в жестких дисках компьютеров и в дорогой автомобильной акустике. В недорогой акустике используются магниты на основе феррита бария. Празеодим ввиду меньшего кларка и большей стоимости добычи долгое время накапливался в виде концентратов, но в настоящее время он стал востребован и иногда заменяет собой неодим. Тяжелые лантаноиды используются в электронике в микроколичествах. Европий имел ведущее значение в создании красных пикселей в электронно-лучевых трубках, но с развитием жидкокристаллических экранов его применение сдвигается в другие области. |
Кусок лантана весом 69 граммов (в масле) |
Диоксид церия |
Скандий, иттрий, тулий, лютеций, европий и лантан (справа снизу, металл сильно пострадал от коррозии; сами продукты коррозии - в пакетике чуть выше)
|
Коллекция редкоземельных элементов |
Полупродукты, по всей видимости - смесь основных карбонатов РЗЭ (состав варьируется в широких пределах):
желтый - отсутствие либо следы лантана и иттрия, много церия, чуть меньше празеодима и совсем мало неодима; зеленый - чуть-чуть лантана и иттрия, немного церия, много празеодима, немного неодима; розовый - примерно поровну (по 8-10%) Dy-Er-Yb, первые проценты остальных от Gd до Lu и Y (Sm и Eu нет либо следы); белый - половина иттрий, много иттербий, плюс остальные тяжелые и (в другом пакете) средние РЗЭ; для контраста положил осыпавшийся с металлического неодима порошок основного карбоната (сизовато-серый). |
|
Гафний. Входит как изоморфная примесь во все соединения циркония, и если продукт не подвергался специальной очистке, остается и в циркониевых реактивах. Содержание обычно составляет 1% по отношению к цирконию. Так, в фианитах содержания гафния равно 0,8-1,0%. Обычными химическими методами (осаждение, кристаллизация) разделить практически невозможно из-за так называемого "лантаноидного сжатия", когда элементы после лантаноидов имеют практически такой же размер атомов, как и их аналоги до лантаноидов. Необходимо использовать методы экстракции, ионного обмена или фракционной сублимации хлоридов. В условиях скромно оснащенной лаборатории наиболее реально воспользоваться экстракцией. Дело также осложняется плохой растворимостью минералов и оксидов циркония и гафния в кислотах (кроме плавиковой).
Тантал. Всегда сопутствует ниобию в минералах, но, в отличие от гафния с цирконием, соотношение тантала и ниобия может варьироваться в широких пределах, с избытком как тантала, так и ниобия. Поэтому в технических продуктах всегда находится в изоморфной смеси с ниобием. Извлечь чистое соединение тантала из танталовых конденсаторов по этой причине довольно сложно, и все вышесказанное про гафний и цирконий равно применимо к разделению ниобия и тантала. Вольфрам. Пожалуй, самый распространенный из "экзотических" элементов. Спираль лампы накаливания сделана из чистого вольфрама - встречающиеся иногда в литературе сведения, что туда также входит до 2% тория (для улучшения тугоплавкости) мне подтвердить не удалось - РФА-спектрограмма чистая, кроме вольфрама ничего не видно (по торию порог в районе 0,002%). Иногда можно встретить в виде стержней примерно 5 мм в диаметре и 150 мм длиной - их используют как нагревательные элементы, предварительно проволочив до нужной толщины. Впрочем, в лампах вольфрам содержится в количестве от одной десятой до полуграмма, так что для многих опытов хватит десятка-другого перегоревших лампочек. Иридий. Если повезет, можно найти перьевую ручку с "вечным" пером, у которого либо самый кончик-шарик сделан из иридия, либо даже все перо целиком (в еще довоенных). Платина. Помимо очевидного использования в качестве специальной химической посуды, платина также используется в микроэлектронике. Впрочем, все очевидные запасы "неликвидных" радиодеталей, содержащих платину, были утилизированы еще в 90-е годы, так что теперь платину можно добыть преимущественно из автомобильных катализаторов, где ее содержание колеблется от 300 до 800 мг/кг. Царской водкой довольно легко растворяется около 85% платины из катализаторов, но дальнейшее растворение идет гораздо хуже, и при более жестких способах разложения в раствор начинает переходить уже сама керамика. В целом, справедливы те же замечания про катализаторы, что я сделал выше в параграфах про родий и палладий. Не забываем также про правовые последствия! Вряд ли кто что-то вам скажет, если вы добыли грамм-другой хлороплатината аммония для опытов, но при попытке реализации ждите гостей из компетентных органов. Золото. Наверное, нет другого такого металла, нахождение и способы добычи которого из "бытовых" предметов были бы так хорошо известны. Самое интересное, кроме радиодеталей, конечно, - это добыть микроколичества золота из золотых каёмочек на посуде. Если вы сомневаетесь, действительно ли каёмочка золотая, или это просто имитация - поставьте такой предмет посуды в микроволновку и запустите на полную мощность - чаще всего золотой ободок начнет искрить (долго не держите, чтобы не вызвать пожар!). Толщина слоя составляет первые микроны, иногда даже доли микрона - такие ободки полупрозрачны, и вплоть до 4-х - 5-ти микрон (хороший плотный слой). Очень часто тончайшим слоем золота покрывают бижутерию, сделанную из медно-цинкового сплава, точно так же все "золотые" часы на самом деле имеют лишь позолоту (до 1-го - 2-х грамм на корпус), а также "золотые" ручки, настольные часы и т. п. (естественно, далеко не все). |
![При десятикратном недостатке осадителя [сульфат железа (II)] из достаточно концентрированного раствора (10 г/л) золото может выпасть в виде вот такой фольги.](http://chemistry-chemists.com/N1_2014/P8/Au-foil.jpg)
При десятикратном недостатке осадителя [сульфат железа (II)] из достаточно концентрированного раствора (10 г/л) золото может выпасть в виде вот такой фольги. |
|
Ртуть. Странно, что настолько ядовитый металл до сих применяется в быту, но ртутные термометры еще не канули в Лету. При работе со ртутью и ее соединениями всегда следует помнить, что ртуть постепенно улетучивается даже из-под слоя воды, а ее соединения склонны к восстановлению до элементарной ртути (заметно по потемнению препарата), особенно на свету. И уже эта ртуть точно так же начинает проникать во все предметы вокруг. На крышке банки реактива, стоявшего в непосредственно близости к пенициллиновому пузырьку со ртутью (запечатанному резиновой пробкой и обмотанному скотчем), я обнаружил около 0,01% ртути (по отношению к массе крышки). А аттестованная смесь, содержавшая первые проценты оксида ртути, точно так же "заразила" лежавшие вплотную к ней аттестованные смеси - на уровне сотых долей процента (что, вообще-то говоря, очень много), причем это произошло в темноте и через двойной слой бумаги и полиэтилена!
|

Две формы сульфида ртути - красная и черная. Коричневый оттенок красной формы обусловлен перегревом (если верить практикуму Карякина). |
|
Свинец. Один из наиболее распространенных в обычной жизни тяжелых металлов. В основном, конечно, это свинцовые аккумуляторы и свинцово-оловянные припои. Но также это и ортоплюмбат свинца (сурик свинцовый), употребляемый в качестве коррозионной защиты корпусов морских судов (а также исторически в качестве оранжевого пигмента), и все еще кое-где применяемый в медицине ацетат свинца ("свинцовый сахар"), и применяемый в пробирном анализе глет и массикот - две формы оксида свинца (II). Свинцовый сурик легко разделить на два оксида свинца - (II) и (IV). Дело в том, что PbO2 в уксусной кислоте при обычных условиях не растворяется, поэтому при действии уксусной кислоты на сурик Pb3O4 получим раствор двухвалентной соли свинца, а в осадке останется оксид четырехвалентного свинца. С помощью щелочи затем осаждаем при кипячении оксид свинца (II), причем выпадающий сначала белый гидроксид потом частично переходит в раствор в виде гидроксоплюмбита (при высокой щелочности), а частично переходит в PbO. Наилучшей чистоты препарата можно добиться, если сначала по максимуму перевести свинец в сильнощелочной раствор, который затем нейтрализовать кислотой. В качестве побочного продукта получим ацетат щелочного металла, немного загрязненный следами свинца (все зависит от аккуратности исполнения). Еще один интересный опыт, который можно провести с щелочным раствором гидроксоплюмбита - осадить из горячего раствора при помощи тиокарбамида мелкокристаллический сульфид свинца точно стехиометрического состава (при осаждении сероводородом и при "сухом" методе продукт обычно содержит избыток серы).
|

Оксиды и сульфид свинца. С левого нижнего угла по часовой стрелке: желтый оксид свинца (массикот, β-PbO); оранжевый сурик (ортоплюмбат свинца PbII2PbOIV4, чаще эту формулу записывают как Pb3O4); оксид свинца (IV), иногда ошибочно называемый "перекисью" свинца (получен как остаток от растворения сурика в уксусной кислоте в отсутствие окислителей); мелкокристаллический сульфид свинца, полученный гомогенным осаждением тиомочевиной из кипящего щелочного раствора гидроксоплюмбита натрия (блестящие частицы - кусочки "сульфидного зеркала", осевшего на стенках реакционного сосуда); оксид свинца (II), выпавший и недорастворившийся при реакции уксуснокислого свинца с NaOH (в основном желтые пластинчатый кристаллы с небольшой примесью красных, более мелких и плотных, частиц).
|
Галенит - минерал, сульфид свинца (II), PbS |
Галенит вместе с породой (в основном кварц) |
|
Висмут. Единственный из тяжелый металлов, который считается неопасным для здоровья людей и соли которого используются при изготовлении косметики и в медицине. Также это единственный из диамагнетиков, "нелюбовь" которого к магнитному полю можно увидеть воочию, подвесив маленький кусочек висмута на нитке, дождаться успокоения колебаний и затем поднести к нему магнит. Долгое время использовался как часть типографского сплава ввиду того, что в отличие от большинства металлов висмут расширяется при застывании. Существуют специальные сплавы с нулевой расширяемостью, идеальные для заполнения шрифтовых форм. Также является компонентом известного в среде химиков-шутников сплава Вуда.
|
Висмут гранулированный - почти раритет |
Цитрат висмута |
|
Радон. При наличии заметных количеств монацита (см. ниже) можно поместить монацитовый песок в баночку и неплотно закрыть крышкой. Через некоторое (довольно продолжительное) время выделяющийся радон насытит воздух. Не забываем о его радиоактивности!
Торий. Ранее использовался в калильных сетках газосветных фонарей, но сейчас такие можно встретить разве что в музее. Также до середины 20-го века препарат "Торотраст" (оксид тория) использовался как контрастный агент при рентгеноскопии (сейчас заменен сульфатом бария), но после того, как большинство пациентов так или иначе пострадали от последствий внутреннего облучения альфа-частицами, был изъят из применения. Также можно встретить в музеях. Выше уже упоминался в связи с вольфрамовыми спиралями, но ни в отечественных лампах, ни в польских "Филлипсах" мне его обнаружить не удалось. Наиболее реально его добыть из прибрежного морского песка, который часто содержит заметные количества минерала монацита - фосфата тория и редких земель, условно выражаемого формулой (Y,Th)PO4. Содержит значительные количества лантаноидов (преимущественно легкой группы) и урана (до 10% по отношению к содержанию тория). При разделении песка с помощью магнита монацит уходит в едва-едва магнитную фракцию, причем для этого нужно достаточно сильное магнитное поле. Так, неодимовый магнит притягивает монацит только при непосредственном контакте, а ферритовый не действует вообще. С другой стороны, такие его магнитные свойства позволяют легко выделить монацит из песка (отделяем магнитную фракцию с расстояния в несколько миллиметров, затем двигаем магнит по поверхности песка). Обычно это прозрачные песчинки цвета от медового до красновато-янтарного (за счет микропримесей хромофоров). Не забываем о альфа-радиоактивности тория! Уран. В девятнадцатом - начале двадцатого века довольно много использовался как краситель для стекла, из которого изготавливали пуговицы и посуду желто-зеленого флуоресцирующего цвета (особенно ярко эффект флуоресценции проявлялся при облучении ультрафиолетом). Во время ряда военых конфликтов стороны использовали боеприпасы с сердечниками из обедненного урана. Содержание урана 235 в таком материале в несколько десятков раз меньше, чем в природном, но все же не нулевое, к тому же альфа-излучение от самого урана-238 никуда не делось. Поэтому застрявшие в элементах конструкций (стенах домой и т. п.) и разбросанные по большой территории остатки боеприпасов до сих представляют серьезную угрозу населению. Выше уже упоминался монацит, в котором также содержится некоторое количество урана. Не забываем о радиационной безопасности! ***
В этом месте я закончу мой небольшой рассказ о доступных в обычной жизни элементах и их соединениях. Конечно, он далеко не полон - я опустил многие источники микроколичеств веществ, если их можно добыть более простым способом. Также я совершенно не коснулся трансурановых элементов и радиоактивных изотопов - по понятным причинам. По разным причинам опущены некоторые экзотические элементы (хотя другие не менее экзотические я упомянул). Тем не менее, надеюсь, что мой рассказ поможет в некоторой степени ответить на вопрос, заданный в самом начале - из чего состоят вещи, нас окружающие?
__________________________________________________ 1 Например, подобный вопрос был задан однажды на форуме - в теме Бытовые источники химических элементов [ссылка] 2 Pigment Black, Pigment Yellow, Pigment Blue и т. п. с последующим числом представляет собой цветовой индекс (C.I., Colour Index), принятый среди производителей пигментов, для расшифровки см., например, http://www.artiscreation.com. 3 Про магниевые аноды для бойлеров и другие источники металлического магния - см., например, статью Магний - фотографии [ссылка], а также тему Где взять магний [ссылка] на форуме Химия и Химики. 4 См. например, Б.В. Некрасов Основы общей химии , Н.Н. Гринвуд, А. Эрншо Химия элементов [ссылка] 5 См. например, статью Черный порох. Компоненты пороха [ссылка] 6 Сейчас используется по большей части никелировка. 7 Не путать с PB15, называемый Cobalt Blue (Hue), то есть имеющий лишь оттенок кобальтовой сини, а на самом деле представляющий собой фталоцианин меди. 8 А также в пигментах кобальт хромит PG26 и кобальт титанат PG50, но это уже экзотика. 9 Физический Институт Академии Наук 10 За рубежом применялись названия cubic zirconia, brillianite и т. п. - в зависимости от фантазии производителя. 11 Федеральный закон о драгоценных металлах и драгоценных камнях. Статья 22, п.4. |
С левого нижнего угла по часовой стрелке: сера, ацетат меди, перманганат калия, сульфат меди, хлорид железа (III), хлорид кобальта (в центре)
|
Верхний ряд (слева на право): нитропруссид натрия, хлорид кобальта; нижний ряд: сера, сульфат меди, хлорид хрома (III) |