Химия и Химики № 1 2018
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2018 Журнал Химиков-Энтузиастов |
 |
Ртуть Mercury В.Н. Витер |  |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
№ 8 (2009) Ртуть известна с глубокой древности. Имя человека, открывшего ртуть, затерялось в глубине веков – это произошло слишком давно, задолго до нашей эры. Известно только, что в Древнем Египте металлическую ртуть и ее основной минерал, - киноварь, использовали еще в III тысячелетии до н.э. Индусы узнали ртуть во II - I вв. до н.э. Позднее ртуть заняла исключительно важное место в древнеиндийской алхимии и медицине. В древнем Китае киноварь применяли не только как краску, но и как лекарство. По свидетельству Плиния Старшего римляне умели превращать киноварь в ртуть. Во времена античности и средневековья алхимики были уверены, что все металлы происходят от ртути. Разницу в свойствах металлов они объясняли присутствием в металле одного из четырех элементов Аристотеля (огонь, воздух, вода и земля). Неудивительно, что подобных взглядов придерживались и многие видные ученые далекого прошлого. Так, великий таджикский врач и химик Авиценна (980...1037 гг. н.э.) считал, что все металлы произошли от ртути и серы. К такому заключению он мог прийти, наблюдая как взаимодействует ртуть и сера при комнатной температуре. |


|
|
Со временем взгляды на природу металлов сильно изменились, но ртуть продолжает удивлять нас своими уникальными свойствами. Это единственный металл, жидкий при комнатной температуре [3]. При атмосферном давлении ртуть способна находиться в жидком состоянии в широком интервале температур: от – 38.9 до 357.2°С. Последнее обстоятельство очень важно для техники. Ртуть имеет высокую плотность 13,6 г/см3 – это очень тяжелая жидкость. На поверхности ртути свободно плавают железные предметы. Найдется не так много металлов, способных тонуть в ртути. Один литр ртути весит больше, чем десятилитровое ведро воды. По сравнению с другими металлами ртуть имеет высокий коэффициент термического расширения. Электропроводность ртути ниже, чем у большинства металлов, но она значительно выше, чем у многих жидкостей. По сравнению со многими жидкостями при комнатной температуре ртуть имеет низкое давление паров. Ртуть способна образовывать сплавы со многими металлами – амальгамы. В зависимости от состава, амальгамы могут быть твердыми и жидкими. [3] При комнатной температуре в жидком состоянии находятся также некоторые сплавы (не содержащие ртуть), например, сплав натрия и калия |


Железные предметы тонут в воде, но свободно плавают на поверхности ртути |
|
При невысокой температуре ртуть устойчива к действию кислорода, щелочей, многих кислот и агрессивных газов. Она незаменима в химических и физических лабораториях. Благодаря уникальным свойствам ртуть применяется в металлургии, химической промышленности, гальванических элементах, гальванотехнике, медицине, сельском хозяйстве и многих других отраслях. Особенно большое значение имеет ртуть в лабораторной практике. Она применяется в термометрах, манометрах, всевозможных регулирующих устройствах и затворах. В лаборатории используется электролиз с ртутным катодом, колонки с амальгамированными металлами, каломельный электрод сравнения и ртутно-кадмиевый элемент Вестона. |

Ртутные реле |

Ртутный термометр |
|
Благодаря ртути возник одни из самых удобных и чувствительных методов химического анализа – полярография. Ртуть применяют для исследования пористой структуры углей, силикагелей и других материалов. Ртуть широко используют в вакуумной технике. Ртутный диффузионный насос незаменим для создания глубокого вакуума (10-13 мм. рт. ст.). Он применяется в масс-спектрометрах, ускорителях частиц, установках, которые используют фотоэмиссию или имитируют условия космического вакуума. Широкое применение ртути в науке отразилось на выборе размерностей физических величин: долгое время давление измеряли в миллиметрах ртутного столба. Согласно одному из определений Ом – это электрическое сопротивление столбика ртути длиной 106,3 см и сечением 1 мм2. Ртутные выпрямители электрического тока долгое время были наиболее важным, мощным и широко применяемым в промышленности типом выпрямителей. Со временем их заменили на более безопасные и экономичные полупроводниковые приборы. Зато люминесцентные лампы, которые заполнены парами ртути, находят все более широкое применение. Люминесцентные лампы значительно более долговечны, экономичны и универсальны по сравнению с лампами накаливания. |

Полярограф Я. Гейровского - первооткрывателя метода полярографии |

Ртутный манометр |
|
В свое время металлическую ртуть применялась во взрывателях снарядов. Одной из главных деталей взрывателя было пористое кольцо из железа или никеля. Поры заполняли ртутью. В полете снаряд все быстрее вращался вокруг своей оси, в результате ртуть выступала из пор и замыкала электрическую цепь. Фульминат ртути Hg(CNO)2 (гремучая ртуть) активно использовали в капсулях-детонаторах. Это первое известное человеку инициирующее взрывчатое вещество. Широкое применение находят амальгамы. Некоторые из них, например амальгамы серебра и кадмия, химически инертны и тверды при температуре человеческого тела, но легко размягчаются при нагревании. Из них до сих пор делают зубные пломбы. |
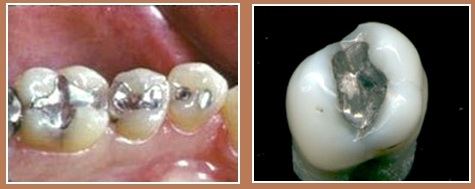
Зубные пломбы из амальгамы |
|
Амальгама таллия затвердевает только при –60°C, ее применяют в специальных низкотемпературных термометрах. Старинные зеркала были покрыты не тонким слоем серебра или алюминия, как это делается сейчас, а амальгамой, в состав которой входило 70% олова и 30% ртути. В прошлом амальгамация была важнейшим технологическим процессом при извлечении золота из руд. В XX столетии она не выдержала конкуренции и уступила более совершенному процессу – цианированию. Однако этот процесс находит применение и сейчас, главным образом при извлечении золота, тонко вкрапленного в руду. Для выделения золота из амальгамы ртуть отгоняют при высоких температурах, конденсируют и возвращают в производство. Некоторые металлы, в частности железо, кобальт, никель практически не образуют амальгам. Это позволяет транспортировать жидкий металл в емкостях из обыкновенной стали. (Особо чистую ртуть перевозят в таре из стекла, керамики или пластмассы). Кроме железа и его аналогов, не амальгамируются тантал, кремний, рений, вольфрам, ванадий, бериллий, титан, марганец и молибден, то есть почти все металлы, применяемые для легирования стали. Это значит, что и легированной сталь устойчива к действию ртути. Щелочные металлы способны легко образовывать амальгамы. В промышленности для получения едкого натра и хлора применяют электролиз поваренной соли с ртутным катодом. Первоначально на таком катоде образуется амальгама натрия, которую потом разлагают водой, при этом образуется едкий натр, водород и ртуть. Теоретически вся ртуть возвращается в производство, но на практике потери неизбежны, поэтому для получения тонны едкого натра нужно несколько сот грамм ртути, иногда эта цифра превышала 5000 грамм ртути. Амальгамы щелочных и щелочноземельных металлов, алюминия, цинка, кадмия и других металлов используют в качестве восстановителей в химическом синтезе. Особенно сильными восстановительными свойствами обладают амальгамы щелочных металлов. Долгое время в промышленности применялась реакция Кучерова - гидратация ацетилена и его гомологов под действием солей ртути (II). При гидратации ацетилена образуется ацетальдегид, в случае замещенных ацетиленов — главным образом кетоны: 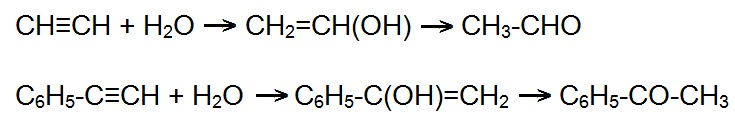 В наше время эта реакция почти не используется - из-за токсичности катализатора. Зато сулема HgCl2, нанесенная на активированный уголь, до сих пор служит катализатором присоединения HCl к ацетилену с целью получения хлорвинила, который производят в очень больших количествах (миллионы тонн в год). Применение ртути в медицине не ограничивается амальгамами. Ртуть – один из самых сильных антисептиков. Раньше врачи часто пользовались полотенцами, смоченными раствором сулемы HgCl2 - с целью дезинфекции. Применяются также мази на основе соединений ртути. У Ярослава Гашека описан эпизод, когда его любимый поручик Лукаш заразился лишаем, и Гашек вылечил поручика ртутной мазью, в результате чего получил медаль «За храбрость». В ряде стран каломель Hg2Cl2 до сих пор используют в качестве слабительного. Сулема используется для консервации дерева, нитрат ртути – для обработки меха. Каломель служит в качестве эффективного фунгицида. Некоторые органические соединения ртути используются как пестициды и средства для протравки семян. Красный оксид ртути и киноварь являются пигментами. Киноварь люди использовали еще в глубокой древности. Раньше в качестве пигмента для художественных красок применяли гидрофосфат ртути HgHPO4. Соединения ртути добавляют в краску, которой покрывают корпуса морских судов, это позволяет бороться с обрастанием подводных частей кораблей водорослями и моллюсками. В промышленности ртуть получают из сульфидов. Концентраты, содержащие ртуть в виде киновари HgS, подвергают окислительному обжигу: HgS + О2 = Hg + SO2 Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая ртуть стекает в железные приемники. Для очистки сырую ртуть пропускают тонкой струйкой через высокий (1-1,5 м) сосуд с 10%-ной НNО3, промывают водой, высушивают и перегоняют в вакууме. |

Киноварь HgS |

Киноварь с вкраплениями металлической ртути |

Кристаллы киновари на доломите |
|
Возможно также гидрометаллургическое извлечение ртути из руд и концентратов растворением HgS в сульфиде натрия с последующим вытеснением ртути алюминием. Разработаны способы извлечения ртуть электролизом сульфидных растворов. Ртуть и ее соединения нашли широкое и разнообразное применение в науке и технике. С другой стороны, ртуть и почти все ее соединения токсичны, поэтому использование ртути часто является нежелательным, а в некоторых случаях – просто недопустимым. Ртуть не только ядовита, но и очень коварна. Особенно опасны ее пары. Они не имеет цвета и запаха, пары ртути никак не ощущаются организмом. Даже при небольшом количестве ртути ее пары способны быстро насытить невентилируемое помещение и проявить свое токсическое действие. При постоянном воздействии пары ртути поражают, прежде всего, на центральную нервную систему. Как правило, это происходит до того, как удается распознать факт отравления ртутью. Каждый уважающий себя химик должен знать, как действует ртуть на организм, как избежать этого губительного влияния, как обнаружить и вовремя обезвредить ртутные загрязнения. Этим вопросам посвящены несколько следующих статей. ***
Дополнение (01.2018 г). |
 |
Действие ртути на организм человека Effects of mercury on human body В.Н. Витер |  |
|
№ 8 (2009) Токсическое действие ртути и ее соединений было известно еще в античные времена. Уже тогда ртуть относили к ядовитым веществам, описали примеры ртутных отравлений и указывали способы их лечения. Более того, именно из-за токсичности ртуть в те времена находила ограниченное применение в медицине. Позже на ядовитые свойства ртути неоднократно обращали внимание арабские алхимики и врачи, которые заметили, что змеи и скорпионы покидают жилища, где была разлита ртуть. О вредном влиянии ртути люди знали и в средние века, и значительно позже, однако эти сведения не имели широкого распространения. Такое положение вещей сохранялось вплоть до 50-х годов ХХ века. |
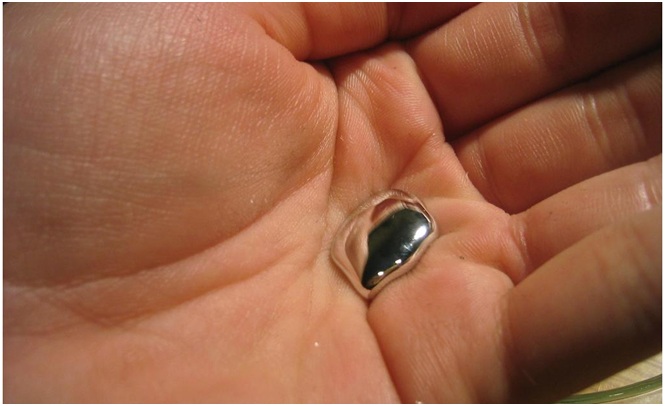
|
|
Алхимики часто использовали ртуть в своих экспериментах. Например, некоторые алхимики демонстрировали «получение» золота из ртути. В одном из вариантов вместо чистой ртути брали амальгаму золота (которая внешне похожа на ртуть). Амальгаму упаривали на глазах у зрителей, и на дне сосуда оставалось золото. Правда, вместе с золотом образовывалось большое количество паров ртути. Алхимики не уделяли внимания токсичности ртути, в результате много искателей «философского камня» пострадало от отравлений. Например, английский король Карл II Стюарт (сын казненного во время революции Карла I) умер в результате неустановленной болезни. Карл II покровительствовал наукам: им была издана хартия об основании Лондонского королевского общества, он сам был страстным алхимиком. Во дворце Уайтхолл была химическая лаборатория, где Карл вместе с алхимиками, приглашенными им из Европы, проводил много времени, в частности создавая различные противоядия. Когда проявились симптомы болезни, медики оказались бессильны. Короля лечили 13 лучших врачей Лондона. За 6 дней болезни король получил 58 разных лекарств и противоядий. Только в наше время было установлено, что Карл II умер в результате хронического отравления ртутью. Нет оснований думать, что это было умышленное отравление. Вероятно, король поплатился за свою приверженность к алхимии и за надежды на алхимическое золото, в котором он всю жизнь очень нуждался. |

|
|
Работа со ртутью нанесла непоправимый вред здоровью многих ученых. Паскаль, Фарадей и Ньютон стали жертвами тяжелого ртутного отравления. У Фарадея в результате систематической работы со ртутным катодом наблюдались тяжелые нарушения нервной системы и он вынужден был прекратить научную работу. Действие металлической ртути отличается от действия ртутных паров, являющихся основным источником ртутных отравлений, и от влияния на организм ртутных соединений. Следует отметить, что мнения о влиянии металлической ртути на организм довольно противоречивы. Например, в литературе указывается, что при приеме внутрь даже значительных количеств металлической ртути не возникает каких-либо вредных последствий. Это послужило поводом для использования ртути при лечении запоров, подагры, почечных камней и других болезней. Врачи обычно прописывали больному ежедневно внутрь по 8—12 г ртути. Более того, оказалось, что ртуть может быть принята внутрь в очень больших дозах без каких-либо признаков отравления. |

|
|
В одной из работ сообщается о попытке самоубийства, предпринятой часовым мастером, который выпил для этой цели около 1500 г металлической ртути. Ртуть, проходя по желудочно-кишечному тракту, вызвала сильные болевые ощущения, но они в дальнейшем затихли и не оставили в организме каких-либо клинических изменений. Спустя 10 дней пострадавший выписался из больницы, причем никаких признаков отравления (стоматит, понос, тремор, изменение формулы крови и пр.) у него не наблюдалось. Однако ряд фактов свидетельствует, что воздействие металлической ртути на организм нельзя считать безвредным. Основными источниками ртутных отравлений являются пары ртути, а также ее соединения, среди которых наибольшую опасность представляют ртутьорганические производные. Давление паров ртути над ее поверхностью невелико, однако с поверхности разлитой ртути происходит непрерывное испарение. При вдыхании загрязненного воздуха пары ртути почти целиком остаются в легких. Ртуть относится к ферментным ядам, которые проявляют свое действие даже в ничтожных количествах. Попадая в организм, ртуть, прежде всего, связывается с сульфогидрильными группами белков -SH, в результате чего нарушается работа ферментов. При достаточно высокой концентрации ртуть связывается также с амино- и карбоксильными группами, образуя прочные ртутьпротеиновые комплексы. Ионы ртути блокируют многочисленные ферменты, прежде всего – тиоловые энзимы. Это приводит к нарушению тканевого обмена, от чего в первую очередь страдает центральная нервная система. Нарушение деятельности нервной системы является первым признаком отравления ртутью. В дальнейшем происходит поражение многих органов и систем. Действие ртути на организм в значительной мере индивидуально, но сильнее всего от него страдают женщины и дети. Острые отравления ртутью Отравления ртутью могут быть острыми и хроническими. Острые отравления наступают при быстром поступлении в организм больших доз яда. Острые отравления возможны при авариях, несчастных случаях или грубом нарушении техники безопасности, например, при разрушении ртутных термометров от перегрева, нагревании ртути без мер предосторожности, попадании внутрь солей ртути, а также при пожарах. При острых отравлениях ощущается металлический вкус во рту, происходит повышение температуры, наблюдается общая слабость. У пострадавших пропадает аппетит, наблюдается рвота, понос и острые боли в животе, набухают и кровоточат десна, расшатываются зубы. При действии паров происходит поражение верхних дыхательных путей, воспаление и отек легких. При острых отравлениях ртутью обычно не наблюдается изменений нервной системы, которые характерны для хронических отравлений. Острые отравления солями ртути во многом напоминают отравление ее парами. Соли ртути (II) более токсичны, чем соли ртути (I). Смертельная доза сулемы HgCl2 составляет 0.1-0.4 гр. Попадая в организм, соли ртути быстро всасываются через желудочно-кишечный тракт. Наименее опасны малорастворимые нелетучие соединения ртути. В некоторых случаях летальный исход наступал через 10-30 и даже 50 и более дней после отравления. При действии больших доз солей ртути смерть наступает через 1-1.5 суток. Органические соединения ртути во много раз токсичнее паров ртути, сулемы, цианида ртути и других неорганических производных. Примером может служить хлористая метилртуть CH3HgCl. К счастью, острые отравления парами ртути, ее солями и ртутьорганическими соединениями встречаются довольно редко. Хронические отравления ртутью Гораздо чаще случаются хронические отравления, которые происходят при продолжительной (месяцы и годы) работе в помещениях, воздух которых содержит небольшие количества паров ртути. Хроническое отравление возможно также при работе с солями ртути или использовании лекарств, содержащих соединения ртути. При хроническом отравлении, прежде всего, происходят изменения в нервной системе. Отрицательное влияние ртути на нервную систему было известно еще средневековым алхимикам. Типичными признаками хронических отравлений ртутью являются апатия, сонливость, головные боли и головокружения. Появляется дрожание пальцев, позднее – век, губ и даже всего тела. Наблюдается ослабление мышц, уменьшение чувствительности, ослабление вкусовых ощущений, резко снижается острота обоняния. При хроническом отравлении может наступать органическое поражение подкорковых узлов, это приводит к появлению раздражительности, бессонницы, или сон становится беспокойным, наполненным кошмарами. Память у человека слабеет, появляется беспричинный страх и депрессия. При более тяжелых отравлениях происходит нарушение психики и интеллекта, человек впадает в бредовое состояние, в тяжелых случаях наступает резкое ухудшение здоровья и смерть. Кроме нервной системы поражаются и другие органы человека. |

|
|
Воздействие солей ртути может проявляться косвенно и довольно неожиданно. Например, растворы нитрата ртути (I) Hg2(NO3)2 выделяют в окружающее пространство пары ртути. При упаривании растворов хлоридов ртути последние в значительной мере испаряются (потери достигают 50% и выше). Поэтому нагревание растворов хлоридов ртути без тяги может закончиться отравлением. Действие очень малых количеств ртути При продолжительном действии паров ртути в очень малых концентрациях (которые в десятки и даже сотни раз ниже ПДК - 0.01 мг/м3), могут возникать хронические ртутные отравления. Обычно различают три степени интоксикации под действием малых количеств ртути (микромеркурализм). Первая степень характеризуется снижением работоспособности, быстрой утомляемостью и повышенной возбудимостью. При второй степени также появляются головные боли, необоснованное беспокойство, повышенная раздражительность, ослабевает память. Наконец при третьей степени микромеркурализма возникают симптомы, типичные для хронического отравления. Часто симптомы отравления очень малыми дозами ртути выражены нечетко, что приводит к неправильным диагнозам, когда врачи вместо отравления ртутью констатируют расстройство нервной системы, заболевание желудочно-кишечного тракта, дыхательных путей и т.д. Накопление ртути в организме и ее выведение В большинстве случаев ртуть попадает в организм в виде пара или пыли через легкие или в виде соединений через желудочно-кишечный тракт. Соединения ртути хорошо растворяются в липидах, поэтому легко проникают через альвеолярную мембрану, стенку кишечника, кожу, плацентарный барьер. В результате постоянного поступления ртути в организм происходит ее накопление во всех органах и тканях, особенно в мозге, почках, легких, печени и сердце. Обратный процесс – выведение ртути из организма происходит медленно и неравномерно. В основном ртуть выводится из организма через почки. |

|
 |
Ртуть в окружающей среде Mercury in environment |  |
|
№ 8 (2009) Распространение и миграция ртути довольно хорошо изучены – в отличие от многих других микроэлементов. Это обусловлено доступностью очень чувствительного метода анализа — непламенной атомной абсорбции, с помощью которой были получены результаты, вызвавшие серьезное беспокойство. До того, как метод непламенной атомной абсорбции получил широкое распространение, сведений о влиянии ртути на окружающую среду было мало. Содержание ртути находилось ниже пределов обнаружения существующих в то время методов анализа. Еще в древности было известно, что ртуть токсична для животных и человека, но только в 1950-х годах люди осознали, насколько опасно ядовитое действие ртути. В 1952-53 г.г. люди, живущие в рыбацких деревушках вдоль залива Минамата в Японии, умирали от таинственной болезни. Лишь некоторое время спустя болезнь была идентифицирована как результат отравления ртутью. Исследования показали, что жертвы употребляли в пищу моллюски, содержащие ртуть. Ртуть попала в залив со сточными водами фабрики, расположенной на берегу залива. Впоследствии эта болезнь стала известна под названием болезнь «Минамата». Та же болезнь вызвала смерть десяти человек в Ниигата в 1969 г. Открытие болезни «Минамата» привело к резкому увеличению числа работ, посвященных исследованию ртути как загрязняющего вещества. Этому способствовало не только появление простых и чувствительных методов анализа, но и периодические случаи отравлений, например, смерть 450 иракских крестьян в 1972 г. после употребления в пищу зерна, обработанного содержащими ртуть пестицидами. Формы нахождения ртути в окружающей среде Ртуть мало распространена в земной коре (~10-5 %), однако она концентрируется в сульфидных минералах, главным образом, в виде киновари HgS, что значительно облегчает добычу ртути. В виде сульфидов ртуть относительно безвредна, но атмосферные процессы, подводная вулканическая активность и деятельность человека привели к тому, что в мировом океане накопилось около 50 млн. т этого металла. Естественный вынос ртути в океан в результате эрозии составляет примерно 5000 т/год, вследствие деятельности человека в океан попадает еще 5000 т/год. Первоначально ртуть попадает в океан в виде иона Нg2+, затем она быстро взаимодействует c органическими веществами и c помощью анаэробных организмов переходит в сильно токсичные формы: метилртуть (СН3Нg)+ и диметилртуть (СН3)2Hg. Диметилртуть стабильна при высоких рН, но превращается в (СН3Нg)+ при низких значениях рН. Такие условия могут возникать в придонных илистых слоях рек или озер. Так как метилртуть растворима, она быстро внедряется в организмы, живущие в водной среде, и, в конце концов, попадает в организм человека, как высшего звена пищевой цепочки. |
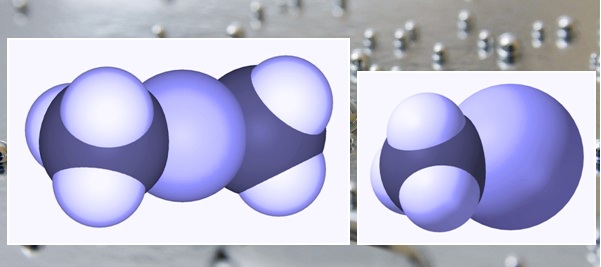
Диметилртуть (СН3)2Hg и метилртуть (СН3Нg)+ |
|
Хотя загрязнение ртутью в гидросферы является основной проблемой, ртуть присутствует и в атмосфере, так как имеет относительно высокое давление паров. Природное содержание ртути составляет примерно 0,003—0,009 мкг/м3, но в районах добычи сульфидных руд ее содержание увеличивается на несколько порядков. Так, воздух над рудником Мазатзал Маунти в Аризоне содержит 20 мкг/м3 ртути. Этот факт может быть использован для поисков месторождений ртути при помощи измерения содержания ртути в воздухе около земли. Источники загрязнения ртутью Природные источники вносят основной вклад в загрязнение окружающей среды, однако доля ртути, попадающая в окружающую среду в результате деятельности людей, сильно увеличивается. К природным источникам относятся процессы выветривания горных пород, а также земная и подводная вулканическая деятельность. Хочинс и Брук изучили природное рассеяние ртути из сульфидных осадков в Пухипухи на Северном острове в Новой Зеландии. Данные, приведенные на рисунке, показывают содержание ртути в воде и речных отложениях на различном расстоянии вдоль течения реки Вэйруа. Последняя проходит через отложения ртутьсодержащих ископаемых в Пухипухи и впадает в море в 100 км от них. Влияние этого источника ртути отмечено на расстояниях до 50 км в речных отложениях и только на расстоянии 5 км в воде, что является результатом нестабильности иона ртути. |
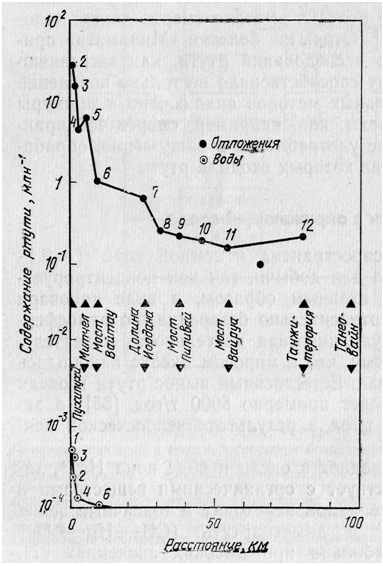
Рис. Зависимость содержания ртути в воде и осадочных веществах реки Вэйруя от расстояния до ртутных осадочных пород в Пухипухи |
|
Ртуть характеризуется малым временем пребывания в воде и быстро переходит в отложения в виде соединений с органическими веществами. Поскольку ртуть адсорбируется отложениями, она может медленно освобождаться и растворяться в воде, что приводит к образованию источника хронического загрязнения, действующего длительное время после того, как исчезнет первоначальный источник загрязнения. Висберг и Зобель исследовали вулканическую деятельность Вэйракейского геотермического района в Новой Зеландии как источника природного загрязнения ртутью. Позже это предположение было подтверждено Уайтом с сотр., которые сообщили о содержании ртути (0.05—0.31)·10-7% в термальных водах Йелоустонского национального парка. Мировое производство ртути в настоящее время (1982 год) составляет 100 тыс. т, около половины этого количества используют в производстве хлора. Ниже указаны процессы, в которых использовалась ртуть в Великобритании в 1969 г.:
При производстве хлора ртутным методом возможны значительные потери ртути в окружающую среду. Оценено, что общемировые потери составляют 1 млн. т ртути. Одним из первых таких примеров является электрохимическое производство хлора в Онтарио, где потери ртути составляли 15 кг/сут в течение по крайней мере 20 лет (т.е. более 100 т). Речные отложения, расположенные около сбросов сточных вод этого завода, содержали больше 0.17% ртути, столько же содержится в ртутьсодержащих породах, разработка которых экономически выгодна. Кроме очевидных источников загрязнения, упомянутых выше, ртуть может попадать в воздух в результате сжигания ископаемого топлива. Хотя в бурых углях относительно мало ртути (1—25)·10-7%, многие антрациты содержат (1.1—2,7)·10-4% и могут представлять серьезный источник загрязнения. Содержание ртути в сырой нефти и в нефтепродуктах еще выше (1.9—21.0)·10-4%. Остаточные фракции, из которых извлекают большинство легколетучих углеводородов, могут содержать более 0.05% ртути. Анализы образцов льда Гренландского ледяного купола, оказались очень полезными для оценки роста загрязнений ртутью в результате бурного роста промышленности. Было установлено, что содержание ртути оставалось постоянным, начиная с 800 г. н.э. и до 1950-х годов, но уже с этих пор количество ртути удвоилось. Направление миграции ртути в окружающей среде показано на рисунке. Физиологические признаки ртутного отравления детально освещены в работе, проведенной по заказу правительства Швеции. Метилртуть особенно опасна для животных, так как она быстро переходит из крови в мозговую ткань, разрушая мозжечок и кору головного мозга. Клинические симптомы такого поражения — оцепенение, потеря ориентировки в пространстве, частичная потеря зрения. Следует учесть, что симптомы ртутного отравления проявляются не сразу. Так как головной мозг содержит избыток клеток, выполняющих какую-либо определенную функцию, то клинические симптомы обычно не проявляются до тех пор, пока эта избыточность не исчезнет. |
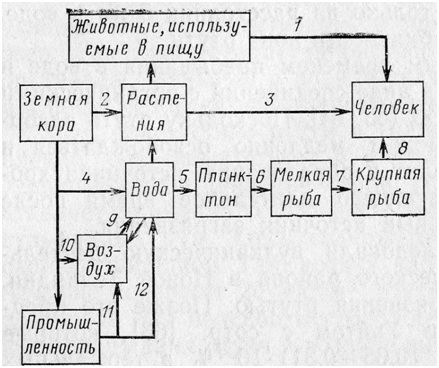
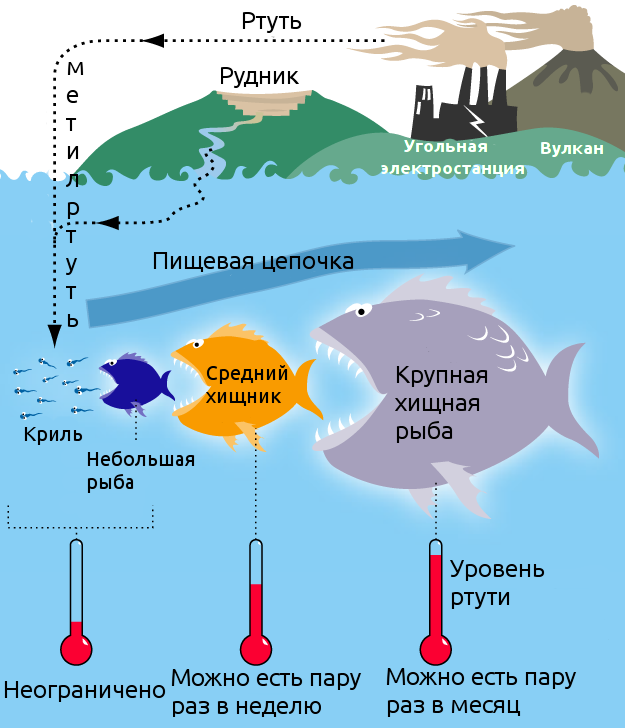
Рис. Круговорот ртути в окружающей среде
1 - животные, используемые в пищу; 2 - адсорбция ртути корневой системой растений; 3 - употребление человеком загрязненных растительных пищевых продуктов; 4 - проникновение ртути в воду в результате вулканической деятельности; 5 - поглощение ртути планктоном; 6 - поглощение планктона мелкой рыбой; 7 - поглощение крупной рыбой мелкой рыбы (концентрация ртути увеличивается); 8 - употребление в пищу крупной рыбы, содержащей ртуть; 9 - равновесие между содержанием ртути в воде и в воздухе; 10 - проникновение ртути в воздух в результате вулканической деятельности; 11 - проникновение в воздух ртутьсодержащих отходов промышленных предприятий; 12 - проникновение в природные воды ртутьсодержащих отходов промышленных предприятий.
|
|
Другим неприятным последствием отравления метилртутью является проникание ртути в плаценту и накапливание ее в плоде, причем мать не испытывает при этом болезненных ощущений. Клиническая проверка ртутного отравления основана на определении содержания ртути в крови. Бергланд и Берлин, Бергланд с сотр. и Хамонд показали, что идентифицируемые симптомы ртутного отравления наступают при ее содержании (0.2—0.6)·10-4%. Такой уровень может быть достигнут при ежедневном поглощении здоровым человеком 0.3—1 мг ртути. Человеческие волосы также могут быть использованы в диагностических целях, нейрологические симптомы могут появиться при содержании ртути в волосах около 5·10-6%. По предложению Международной Организации Здравоохранения, максимальное количество ртути, поглощаемое человеком в день, не должно превышать 0.3 мг, причем не более 0.2 мг должно быть в виде метилртути. Уровень безопасности рассчитывается путем деления наименьшего содержания ртути, которое еще может вызвать отравление, на некоторый фактор. В Швеции рекомендован фактор, равный 10. Дж. О. М. Бокрис (ред.) Химия окружающей среды. М. Химия, 1982. [ссылка] |

|
 |
Техника безопасности при работе со ртутью. Демеркуризация Working with mercury: safety. Demercurization |  |
|
№ 8 (2009) При работе со ртутью следует учитывать, что собрать разлитый металл очень сложно. Ртуть образует мельчайшие капельки, которые разлетаются во все стороны, прилипают к предметам, закатываются в трещины и щели. Поэтому все работы с металлической ртутью необходимо проводить в большом эмалированном лотке. Ртутные загрязнения удаляют двумя способами – механическим и химическим. Для сбора небольших количеств ртути используют так называемую ртутную пипетку - резиновую грушу с присоединенной ловушкой. В случае больших количеств ртути следует применять водоструйный насос, который подключен через пустую промежуточную емкость и емкость с водой (рис.). |
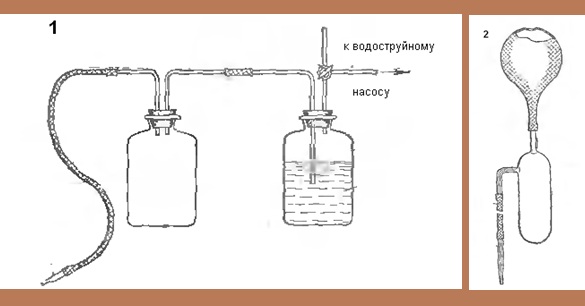
Приспособления для сбора разлитой ртути: 1 - на основе водоструйного насоса, 2 - "ртутная пипетка" |
|
Мелкие капели ртути удобно собирать с помощью полоски цинка (предварительно обработанного 5-10 сек в разбавленной серной кислоте) или медной проволоки. Совсем мелкие капли собирают мокрой салфеткой или бумажкой, смазанной клейстером (или клеем для обоев). Если ртутные загрязнения очень сложно (или невозможно) устранить механически, применяют химическую демеркуризацию. Таких методов известно много, но далеко не все из них эффективны. |

Видимо, этот офицер МЧС собирает ртуть впервые в жизни ("для камеры") |
|
Прежде всего, рекомендуют применять раствор, 1 л которого содержит 1 гр. перманганата калия и 5 мл концентрированной HCl. При реакции перманганата и соляной кислоты образуется хлор, который переводит ртуть в малорастворимую каломель Hg2Cl2. Пылевидные и очень мелкие капельки ртути переходят в каломель, а более крупные покрываются пленкой хлорида ртути (I). Загрязненную поверхность обрабатывают раствором с помощью пульверизатора, а через 1 ч протирают тряпкой. Таким способом можно уменьшить количество паров ртути на 40-50%, однако этот эффект временный и обработку необходимо периодически повторять. Загрязненные ртутью поверхности можно также обрабатывать 5-10% раствором сульфида натрия. Желательно, чтобы раствор содержал полисульфиды. Это достигается добавкой мелкодисперсной серы (или частичным окислением сульфида натрия на воздухе при неправильном его хранении). Для демеркуризации эффективно также применение 20% раствора хлорида железа (III) FeCl3. Расход раствора составляет 1 ведро на 25 м2 помещения. Через 1-2 суток обработанные поверхности тщательно промывают мыльной водой, чтобы удалить хлориды и оксохлориды ртути, которые могут со временем разлагаться. Следует учитывать, что растворы перманганата калия, и особенно – хлорида железа (III) постепенно разрушают поверхность мебели, паркет, а сильнее всего - металлические предметы. Некоторые авторы рекомендуют применять для демеркуризации 4-5% раствор моно- и дихлорамина в CCl4, однако следует учитывать, что тетрахлорид углерода сам довольно токсичен. Применение порошка серы для обработки помещений, загрязненных ртутью неэффективно. Оно почти не приводит к уменьшению концентрации паров ртути. Сера способна реагировать с каплями ртути при комнатной температуре, но реакция протекает медленно, как правило, взаимодействие проходит далеко не полностью [4]. Для удаления ртути с поверхности стеклянной и фарфоровой посуды ее промывают подогретой разбавленной HNO3, а потом небольшим количеством концентрированной HNO3. Пары ртути с открытых поверхностей приборов улавливают с помощью хлоркальциевых трубок, которые заполнены активированным углем, насыщенным иодом или силикагелем, пропитанным водным раствором KMnO4. Первый поглотитель готовят, перемешивая 50 гр. активированного угля с раствором 5 гр иода и 10 гр KI в 100 мл воды. После обесцвечивания раствора уголь фильтруют и сушат. Второй поглотитель готовят насыщая предварительно прокаленный до 750°С силикагель концентрированным водным раствором KMnO4, нагретым до 80°С. Потом силикагель фильтруют и сушат. Индикатором наличия паров ртути является иодид меди CuI. Суспензию иодида меди в спирте смешивают с силикагелем, фильтруют, сушат. Под действием паров ртути такой индикатор окрашивается в розовый цвет. Получение иодида меди (I) описано в статье: [5]. Следует учитывать, что при работе со ртутью в неприспособленных помещениях штукатурка, кирпич, бетон (и другие строительные материалы) насыщаются ртутью на довольно большую глубину. В таких помещениях поддерживается высокая концентрация паров ртути, даже если все работы с этим металлом прекращены. Исключительно важную роль играет личная гигиена. После работы, а также перед едой руки и лицо следует мыть теплой водой с мылом. Почаще принимайте душ. При работе со ртутью уделяйте особое внимание состоянию полости рта. Следует ежедневно чистить зубы, а больные зубы вовремя лечить. В случае появления признаков ртутного отравления (кровотечение десен, бессонница, слабость, раздражительность) следует обратиться к врачу. Перед едой и после окончания работы нужно прополоскать рот слабым раствором перманганата калия. Во время перерывов в работе нужно почаще находиться на свежем воздухе. При попадании солей ртути внутрь необходимо вызвать у больного рвоту. Затем дать ему молока и яичных белков. Противоядием при отравлениях ртутью служат тиоловые соединения, из которых наиболее эффективен унитиол (2,3-димеркаптопропансульфонат натрия).
Унитиол также является эффективным антидотом при отравлении другими тяжелыми металлами. Составил В.Н. Витер |
 |
Интересные факты и поучительные истории связанные со ртутью Interesting facts and instructive stories about mercury В.Н. Витер |  |
|
№ 8 (2009) Ртуть за ее подвижность и серебристый цвет издавна называли «живым серебром». Впервые это название стал употреблять Аристотель. Современное немецкое название ртути Quecksilber означает то же самое – «подвижное (живое) серебро». Другой древнегреческий ученый и врач Диоскорид называл ртуть «гидраргирос» - «серебрянная вода». Отсюда и возникло латинское название этого металла – Hydrargentum или Hydrargyrum. В английском и других европейских языках название ртути произошло от слова Меркурий. Жидкая ртуть, которая быстро бегала по поверхности, ассоциировалась с быстрым и энергичным богом торговли Меркурием (Гермесом). Некоторые комплексные соединения ртути по-русски называются меркуратами, например, K2[HgI4] – тетраиодомеркурат (II) калия. Само же слово «ртуть» тюркского происхождения. |

Меркурий (Гермес) и его жезл |
|
Как из медной монеты сделать серебряную Про токсичность ртути было известно еще в глубокой древности, однако даже в средине ХХ столетия многие не осознавали, что ртуть опасна. Дети любили делать из медных монет «серебряные». Для этого монету натирали ртутью, и она становилась серебристой. Объясняется это тем, что поверхность монеты покрывалась амальгамой меди, которая имеет серебристый цвет. Советские пять копеек становились похожими на пятьдесят, - для некоторых ребят тогда это был серьезный соблазн. Есть более легкий и безопасный способ покрыть медные монеты серебристой амальгамой. Для этого монеты опускают в раствор соли ртути. Через некоторое время их вынимают, промывают, натирают плотной тканью или содой для того, чтобы удалить матовый налет. Потемневшие монеты желательно предварительно обработать в азотной кислоте. На одном крупном заводе был случай, когда рабочие натерли пять копеек ртутью, просверлили в монете дырку и прибили ее гвоздем к асфальту. Шел первый заместитель директора, смотрит – на асфальте лежит пятьдесят копеек. На пять копеек он бы не обратил внимания, но за «полтинником» начальник наклонился. Пробует поднять, – а не получается. После нескольких неудачных попыток зам. директора опасливо оглянулся по сторонам и поспешно ушел. Образование амальгамы меди использовали и рыбаки. Рассказывают, что некоторые брали с собой на рыбалку раствор нитрата ртути, который сами же и получали (растворяя ртуть в азотной кислоте). Если рыба не ловилась на медную или латунную блесну, рыбаки тут же ее «перекрашивали» раствором Hg(NO3)2 в серебристый цвет. В случае необходимости блесне можно было вернуть прежний вид. Для этого ее нагревали, чтобы испарилась ртуть, а потом полировали резинкой. |

Монету из медного сплава следует подержать в растворе соли ртути, потом промыть водой и натереть войлоком (или содой) для удаления матового налета. Монетка будет блестеть как серебряная.
Для наглядности монета в 1 гривну была опущена в раствор нитрата ртути только наполовину. Не следует забывать, что ртуть и ее соединения токсичны  |
|
Прием металлической ртути во внутрь В журнале уже упоминался случай, когда часовой мастер выпил с целью самоубийства около 1500 гр. металлической ртути. Ртуть, проходя по желудочно-кишечному тракту, вызвала острые боли, которые со временем прошли. Пострадавший был выписан из больницы через десять дней без каких-либо последствий. Признаки, характерные для ртутных отравлений, не наблюдались. Описан еще более драматический случай, когда рентгенолог ввела себе в вену несколько миллилитров металлической ртути (также с целью самоубийства). На протяжении девяти лет наблюдения больная чувствовала себя удовлетворительно. У пострадавшей признаки ртутного отравления полностью отсутствовали, хотя на рентгеновских снимках четко наблюдалось присутствие ртути в желудочках сердца и на поверхности легких. Но не следует думать, что прием во внутрь металлической ртути безвреден для здоровья. Отмечен случай смерти грудного младенца, которому родители несколько дней давали по 0.5 мл ртути для «укрепления здоровья». *** «Целебная» ртуть В свое время металлическую ртуть применяли при лечении заворота кишок. Больному давали выпить 1/2 фунта (около одной рюмки) ртути. Врачи надеялись, что благодаря своей высокой плотности ртуть будет способствовать распрямлению и распутыванию кишечника. Однако от такого применения ртути пришлось отказаться, и вовсе не из-за ее токсичности: употребление тяжелой ртути могло привести к разрыву оболочки желудка с очень неприятными последствиями. Кроме того, ртуть распадалась в желудке на мелкие шарики и не оказывала ожидаемого действия на больной кишечник. |

На поверхности металлической ртути плавают железные предметы - ничего особенного: закон Архимеда в действии |
|
*** Раньше с целью профилактики, работающим со ртутью рекомендовалось каждый день полоскать рот раствором хлората калия KClO3. Теперь для этого применяют перманганат калия (текст писался в 2009 г - прим. ред.). *** Классический случай острого ртутного отравления произошел с известным химиком Луи Жаком Тенаром. Во время лекции он по ошибке выпил раствор сулемы HgCl2, думая, что в стакане питьевая вода. Поняв, что произошло, химик спокойно поставил стакан на место и хладнокровно объяснил: «Господа я отравился. Мне могут помочь сырые яйца, принесите мне их, пожалуйста». Перепуганные студенты бросились по соседним лавкам и домам в поисках спасительного противоядия. Тенар принял внутрь несколько сырых яиц, разболтанных с водой. Это и спасло ему жизнь, сырой яичный белок – прекрасный антидот при отравлении солями ртути. *** Ртуть в древней медицине В индийской медицине ртуть применялась, начиная с глубокой древности. До нас дошла старинная поговорка: «Врач, знакомый с целебными свойствами кореньев — человек, знающий силу молитв — пророк, знающий же свойства ртути — бог». Уже в ведических текстах был приведен рецепт ртутной мази, которая готовилась из металлической ртути, серы и животного жира. Широкое применение ртути в древнеиндийской медицине было связано с высоким уровнем развития алхимии. О роли ртути и ее соединений в алхимических превращениях говорит средневековое название индийской алхимии — «расаяна» («путь ртути»). Алхимические сведения содержались преимущественно в медицинских текстах, где подробно описывалась «расашала» — помещение для химических экспериментов. Просторную лабораторию, снабженную раковинами, разнообразной стеклянной посудой, сушильнями, приспособлениями для промывания составов, надувными мехами для горна и многим другим, украшали многочисленные изображения богов и религиозные символы. Ртуть, предназначенную для получения лекарств и алхимических соединений, освобождали от примесей, «лечили» с помощью лекарственных трав — алоэ, лимона и красной горчицы. Использование препаратов ртути для лечения многих заболеваний пришло впоследствии из индийской медицины в греческую и тибетскую. Алхимическая традиция индусов получила самостоятельное развитие в средневековом арабском искусстве врачевания, которое оказало большое влияние на медицину и алхимию средневековой Европы. Об употреблении мышьяка и ртути в восточном искусстве врачевания сообщал европейцам Марко Поло в XIII в. Он писал о том, что жители Индии считают полезным для себя ежедневное внутреннее употребление в небольших дозах ртути с серой. Лечение эпидемических заболеваний соединениями ртути пришло из Индии в Русь: «ртутными мазунями» лечили кожные болезни и изгоняли нательных паразитов. Применение лекарств на основе ртути в Европе связано с развитием алхимии в эпоху Возрождения. Мази, содержащие ртутные препараты, обладают противомикробным и противовоспалительным действием. Они широко используются в современной медицине. |

|
|
*** Каломель в качестве слабительного Раньше каломель в значительном количестве применяли как слабительное. В некоторых странах это делают до сих пор. Проблема в том, что если не «пронесет» - будет ртутное отравление. Другими словами, если слабительное не подействовало и осталось в кишечнике, хлорид ртути всасывался в кровь и приводил к отравлению. *** Ртутьорганические соединения очень удобны в органическом синтезе. Их применение не только упрощает ход синтеза, но и сильно облегчает разделение продуктов реакции. Проблема в том, что ртутьорганические соединения очень ядовиты. *** Ртуть и нефть В 1936 г. появилось сообщение о том, что одна из зарубежных нефтяных фирм приобрела ртутный рудник. Оказалось, что ртуть нужна этой фирме для организации парортутной установки, предназначенной для очистки нефти. В наше время ртутные пары все шире используются в нефтеперерабатывающей промышленности: они помогают очень точно регулировать температуру процессов, что крайне важно для нефтепереработки. *** Паровые машины на ртути В начале XX в., внимание теплотехников привлекало сообщение о работах доктора Эммета из США. Эммет первым попытался использовать в паровых котлах не воду, а ртуть. Его опытная установка мощностью 2000 л.с. работала и потребляла на 45% меньше топлива, чем обычный паровой котел с генератором. Конечно, не обошлось без дискуссий: ртуть не вода, из реки ее не зачерпнешь! Возражений против использования ртути в паровых котлах было больше чем достаточно. Исследования, однако, продолжались. Довольно успешной была работа советских научно-исследовательских институтов по проблеме использования ртутного котла и турбины. Были доказаны экономичность ртутно-паровых турбин и возможность создания так называемого ртутно-водяного бинарного цикла, в котором тепло конденсирующегося ртутного пара используется в специальном конденсаторе-испарителе для получения водяного пара. А до этого ртутный пар успевает покрутить вал генератора. Полученный водяной пар приводит в движение второй электротурбогенератор... В подобной системе, работающей только на водяном паре, удается в лучшем случае достигнуть КПД 30%. Теоретический же КПД ртутно-парового цикла (45%) намного выше, чем у газовой турбины (18-20%) и дизеля (35-39%). В 50-х годах в мире существовало уже несколько таких энергетических установок мощностью до 20 тыс. киловатт. Дальше дело, к счастью, не пошло, главным образом из-за нехватки ртути. |

|
|
*** Ртутные насосы Вакуумные установки в наше время очень важны для науки и промышленности. В них активно используется ртуть, причем не только для заполнения трубок вакуумметра. Еще в 1916 г. Ирвинг Ленгмюр создал вакуум-насос, в котором испарялась и конденсировалась ртуть. При этом в системе, связанной с насосом, создавалось остаточное давление в сотни миллионов раз меньше атмосферного. Современные ртутные диффузионные насосы дают еще большее разрежение: стомиллионные доли миллиметра ртутного столба. К сожалению, такие насосы очень часто становятся источниками ртутных загрязнений. Например, достаточно выключить ртутный насос, но не перекрыть кран – и ртуть засосет в вакуумную линию. Один из коллег рассказывал, что ему выделили помещение, где стоял старый вакуумный насос, на полу возле которого было разлито около 16 кг ртути (больше литра). После того, как большую часть ртути собрали механически, еще долго приходилось делать демеркуризацию. Каждый рабочий день начинался с того, что сотрудник поливал пол раствором хлоридом железа (III), в обед аспирантка мыла пол, после чего его опять заливали хлоридом железа. На следующий день все повторялось. *** На исследовательском судне «Витязь» во время качки опрокинулся контейнер со ртутью. Вылилось около пяти килограмм жидкого металла. По счастливому стечению обстоятельств на корабле было большое количество образцов железомарганцевых конкреций – минеральных образований, поднятых со дна океана. Конкреции содержат много ценных металлов, но основные их компоненты – гидроксиды железа и марганца. Гидроксиды железа и марганца активно сорбируют пары ртути, это и спасло экипаж «Витязя» - после инцидента на корабле не было зафиксировано ни одного случая ртутного отравления. *** |

Замораживание ртути жидким азотом |
|
Ртуть - первый сверхпроводник В 1911 г. голландский ученый Гейке Камерлинг-Оннес исследовал электропроводность ртути при низкой температуре. С каждым опытом он уменьшал температуру, и когда она достигла 4.12 K, сопротивление ртути, до этого последовательно уменьшавшееся, вдруг исчезло совсем: электрический ток проходил по ртутному кольцу, не затухая. Так было открыто явление сверхпроводимости, и ртуть стала первым сверхпроводником. Сейчас известны десятки металлов и сплавов, много сложных оксидов и других материалов, которые становятся сверхпроводниками при низких температурах. *** Реактив Несслера Реактив Несслера представляет собой 0.09 М раствор тетраиодомеркурата (II) калия K2[HgI4] в 2.5 М KOH. Он позволяет обнаружить даже очень небольшие количества аммония или гуанидиновых соединений. Если аммония мало, раствор окрашивается в желтый цвет, в присутствии значительных количеств аммония образуется коричневый осадок: NH4+ + 2[HgI4]2- + 4OH- => HgO·Hg(NH2)I + 7I- + 3H2O *** Нормальный элемент Вестона (ртутно-кадмиевый) Нормальный элемент Вестона - гальванический элемент, который отличается высокой стабильностью напряжения и хорошей воспроизводимостью. Применяется как источник опорного напряжения или эталон напряжения в метрологии. Элемент был предложен в 1892 г. Эдуардом Вестоном и официально принят для метрологических целей в 1908 г. До 1970-х гг. нормальные элементы Вестона были основой национальных эталонов Вольта и широко использовались в лабораторной и промышленной практике для точных измерений. 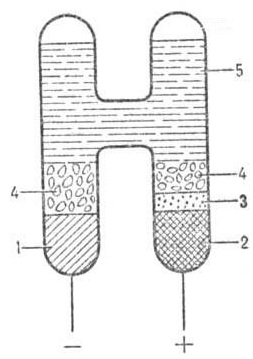 Элемент Вестона имеет следующее строение (см. рисунок). Положительный электрод — ртуть (2), которая контактирует с пастой из кристаллов сульфата ртути (I) Hg2SO4 (3) и гидрата сульфата кадмия CdSO4•8/3H2O (4). Отрицательный электрод — 8-12,5%-я амальгама кадмия (1), контактирующая с пастой из кристаллов гидрата сульфата кадмия CdSO4•8/3H2O (4). Электролит (5) — раствор сульфата кадмия CdSO4, чаще всего с небольшой (нормальностью обычно 0,03-0,08) добавкой серной кислоты для предотвращения гидролиза сульфата ртути, снижения его растворимости и снижения скорости разрушения стекла (в этом и заключается разница между «нейтральными» и «кислотными» элементами Вестона). Электрохимическая реакция: Cd + Hg22+ <=> Cd2+ + 2Hg. Все вещества должны отличаться хорошей чистотой, что необходимо для достижения высокой стабильности элемента. |

Нормальный элемент Вестона |
|
*** Каломельный электрод Каломельный электрод используют в качестве электрода сравнения в электрохимии. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, которая помещёна в насыщенный каломелью раствор хлорида калия заданной концентрации. Для того, чтобы потенциал электрода не зависел от концентрации хлорида, обычно используют насыщенный раствор KCl. Потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25°С. |
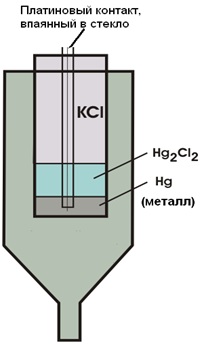
Каломельный электрод |
|
***
Комплексные соли ртути - тетраиодомеркураты (II) серебра Ag2[HgI4] и меди (I) Cu2[HgI4] обратимо изменяют окраску в зависимости от температуры. Желтый Ag2HgI4 при нагревании до 50°С становится красным, а красный при комнатной температуре Cu2HgI4 при нагревании до 55°С становится шоколадно-коричневым.
Данные вещества можно использовать как термочувствительные пигменты. |

Поведение при нагревании: Ag2HgI4 (слева) и Cu2HgI4 (справа) 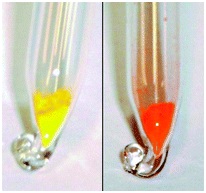
Низкотемпературная (желтая) и высокотемпературная (красная) модификации Ag2HgI4 |
|
*** В одной лаборатории химико-технологического факультета забилась раковина. Когда разобрали колено сифона, в нем оказалось около 1.5 кг ртути (больше 0.1 литра). Как видите, тяжелая ртуть, которую сотрудники выливали в раковину - грубо нарушая технику безопасности - некуда не делась. К сожалению, для химических лабораторий подобные случаи не редкость. *** Люминесцентные лампы содержат пары ртути. В ртутных лампах высокого давления пары ртути частично конденсируются в капельки (фото справа). Перегоревшие люминесцентные лампы нельзя просто выбрасывать – они подлежат демеркуризации специальными службами. К сожалению, это требование выполняется редко - большинство отработанных ртутных ламп нелегально выбрасывают на свалку. |

Ультрафиолетовая лампа высокого давления |
|
*** Ртуть в батарейках Работа ртутно-цинкового элемента основана на реакции между цинком и оксидом ртути: Zn + HgO = Hg + ZnO. Ртутно-цинковые батарейки не имеют равных по надежности, стабильности напряжения и количеству «запасенного» электричества на единицу массы. Они очень удобны в полевых условиях [K2]. Однако ртуть составляет больше половины их массы. После того, как батарейки выработают свой ресурс, возникает проблема их утилизации. Если просто выбрасывать такие элементы на свалку, то это приведет к массовым ртутным загрязнениям. Поэтому использование ртутно-цинковых элементов пытаются ограничить. В частности, в открытую продажу они уже не поступают. А на батарейках, которые продаются в магазинах, можно прочесть: «Mercury 0 %» или «Mercury free», что означает «ртути нет». |

Ртутно-цинковые батарейки |
|
*** На одном из заводов рабочий пытался вынести бутылку со ртутью. Он особо не прятался, и верхняя часть бутылки выглядывала из сумки. На проходной это заметил «бдительный» охранник, который схватил бутылку, думая, что в ней спиртное. Бутылка сразу же выскользнула из рук и разбилась – она была очень тяжелой. Пол-литра ртути весит около 6.8 кг. Ртуть растеклась по всей проходной. Пришлось делать срочную демеркуризацию. |

|
|
*** Один из способов получения едкого натра в промышленности - электролиз раствора хлорида натрия с ртутным катодом. Натрий, который выделяется на катоде, растворяется в ртути, образуя жидкую амальгаму: 2Na+ + 2Cl- + (Hg) => 2Na (Hg) + Cl2 Амальгаму натрия разлагают водой, при этом образовывался раствор NaOH и водород. 2Na (Hg) + 2H2O => (Hg) + 2NaOH + H2 Ртуть возвращают в производство. Одновременно на аноде выделяется хлор, который используют для получения гипохлоритов, хлоратов, хлоридов фосфора и хлорорганических продуктов. Суммарное уравнение электролиза имеет вид: 2NaCl + 2H2O => 2NaOH + Cl2 + H2 |

Цех электролиза ПО "Химпром" г. Павлодар перед началом демонтажа |
|
Теоретически в этом процессе ртуть не расходуется, но на практике ее потери неизбежны, особенно учитывая нашу низкую культуру производства. В "Популярной библиотеке химических элементов" сказано, что для получения тонны едкого натра нужно от 125 до 400 г ртути [1]. В действительности, эта цифра могла быть гораздо выше. В таблице приведен выпуск едкого натра и реальный расход ртути на ПО «Химпром» г. Павлодар
Объемы производства каустической соды и фактический расход ртути [2]
Фактический удельный расход ртути составлял 1.589 кг/т NaOH, в то время как "научно-обоснованная норма" регламентировала потребление ртути на уровне 0.3 кг/т, "технически обоснованная норма" – 0.5 кг/т, а "плановая" – 0.76 кг/т. В 1977 году фактический расход ртути составил 5.05 кг/т NaOH. Баланс потерь следующий. До 0.8% потерь ртути приходилось на шламы, накапливаемые и перерабатываемые на производстве, до 1.9% - на вентиляционные выбросы, до 2.6% - на шламы, направляемые на переработку на ртутный комбинат, до 3.9% - на выбросы в атмосферу с водородом, до 11.8% - на сточные воды и твердые шламы, транспортируемые в накопители для твердых и жидких ртутных отходов, до 83.7% - на неучтенные потери. Последние были обусловлены проливами, утечками металлической ртути и неполнотой сбора ртути при эксплуатации и ремонте электролизеров. |

Емкость для сбора сточных вод, содержащих ртуть и пруд-накопитель |
 |
Литература о ртути Mercury literature |  |
|
П.П. Пугачевич Работа со ртутью в лабораторных и производственных условиях. М. Химия. 1972. [ссылка] (Химия ртути, техника работы со ртутью, очистка ртути, применение, токсикология, техника безопасности, демеркуризация.) Л.Н. Захаров Техника безопасности в химических лабораториях. Л. Химия. 1991. [ссылка] (Химия ртути, техника работы со ртутью, очистка ртути, токсикология, техника безопасности, демеркуризация.) Дж. О.М. Бокрис (ред.) Химия окружающей среды. М. Химия. 1982. [ссылка] (Миграция ртути в окружающей среде, загрязнение ртутью, токсикология ртути.) В.А. Филов (ред.) Вредные химические вещества. Неорганические соединения элементов I-IV групп. Л. Химия. 1988. [ссылка] (Токсикология ртути.) Г. Брауэр (ред.) Руководство по препаративной неорганической химии. М. Издательство иностранной литературы. 1956. [ссылка] (Методики получения соединений ртути.) Л.Ф. Козин Физикохимия и металлургия высокочистой ртути и ее сплавов. Киев. 1992. (Книга содержит справочные данные по физико-химическим свойствам ртути и ее сплавов.) И.В. Петрянов-Соколов (ред.) Популярная библиотека химических элементов. М. Наука. 1977. т. 2. Статья Ртуть. [ссылка] (Много полезных сведений о ртути. Материал изложен в интересной и увлекательной форме.) L.F. Kozin, Steve C. Hansen-Mercury Handbook: Chemistry, Applications and Environmental Impact (2013) [ссылка] (Фундаментальная книга на английском.) Смирнов В. А. Восстановление амальгамами. Л., Химия, 1970 (Автор книги также является автором теории восстановления амальгамами. Однако, судя по всему, книги нет в электронном виде.) |
|
Обнаружение ртути в батарейках Detection of mercury in batteries Stas |
|
Люди постарше помнят, наверное, большие круглые батарейки типа "Элемент 373". В эпоху СССР они были очень популярны, поскольку, -- в отличие от маломощных "пальчиков" и совсем хилых "крон", -- тогдашним фонарям/радиоприемникам обеспечивали весьма длительную работу. Ну и, естественно, валялись эти "бэушные" батарейки повсюду, так что добытчики халявного цинка проблем с сырьем не имели. Таким образом, насобирав с товарищем десяток-другой 373-х, мы их затем оптом разбирали: графитовые стержни -- отдельно, смолу и "землю" (смесь MnO2 с молотым графитом и электролитом) -- отдельно, а недорастворенные в гальваническом элементе цинковые стаканчики скребли под краном от грязи, плющили молотком и плавили все это дело в мелкой нержавеющей посудине. Вонь от смолы стояла ужасная, но мы были счастливы -- вот он, чистый цинк!!. Мы отливали его корольками и в столбики, растворяли в соляной и серной кислотах, переводили соли цинка в оксид и сульфид... В общем, "самопальных" соединений элемента №30 наделали немало. И лишь гораздо позже, уже учась в институте, я где-то вычитал (в Некрасове, кажись), что в тех 373-х в качестве деполяризатора немного и хлорид ртути присутствовал...
|

"Элемент 373" |
|
Минула уйма лет. Давно уж я активно не "химичу". Но тут вдруг захотелось получить гидроксид цинка -- просто так, ради "посмотреть-пощупать".
Так и появился этот лаконичный фотоотчет. Настраивать в домашних условиях вакуум-фильтрование -- муторное занятие. Поэтому для обычных задач я использую вот такую конструкцию: |

Установка для тонкого фильтрования (разобранная) |
|
Пластиковое "ситечко" вставляю в подходящую эмалированную кружку, поверх фильтрующих отверстий кладу кружок плотной синтетической ткани, для герметичности смачиваю ее дистиллятом -- все, можно фильтровать!
|

Установка для тонкого фильтрования (собранная) [На стенках заметны следы только что выгруженного отфильтрованного осадка]; |
|
Доведенный до нейтральности гидроксид цинка несколько раз отмывается от Na2SO4 дистиллятом, фильтруется и пасочкой вываливается на "тарэльку", где он за неделю усыхает до каменного состояния (см. дальше):
|

Элемент "373": (1-я порция полученного гидроксида цинка Zn(OH)2) |

Элемент "373": полученный Zn(OH)2, - творог творогом! (Через пару дней гидроксид сильно подсыхает, но все еще содержит уйму воды. По консистенции сие очень смахивает на нежирный творог).
|
|
Первая порция таки расплылась (не дал нормально постоять-откапать...), зато вторая "паска" получилась отлично:
|

Элемент "373": 2-я порция полученного гидроксида цинка Zn(OH)2 |
|
Вот она же через двое суток:
|

Элемент "373": 2-я порция полученного гидроксида цинка Zn(OH)2 через 2 суток |
|
Продукт после пяти суток высушивания:
|

Элемент "373": 2-я порция полученного гидроксида цинка Zn(OH)2 через 5 суток |
|
В заключение - проба на ртуть. Для сего на влажный еще гидроксид цинка была положена полоска калий-йодной бумаги (обыкновенная бытовая проба на пары ртути) и затем дважды сфотографирована: сразу же, и через сутки.
Разницу сами видите... Какое-то количество ртути в моем Zn(OH)2 таки присутствует. А это значит, что и в исходном цинке она имеется. |
 
Гидроксид цинка Zn(OH)2, полученный из элемента 373, - проба на ртуть. (Обратите внимание: бумага покраснела лишь в точках соприкосновения с осадком. То есть, имела место диффузия ртути лишь из осадка, но не из воздуха, где ее содержание, по-видимому, на порядки меньше...
|
|
Кстати, кроме покраснения калий-йодной бумаги в точках контакта также заметно и легкое общее ее пожелтение. То ли это пары ртути сработали, то ли кислород воздуха, то ли оба вместе - неизвестно.)
Комментарий редактора (по итогам обсуждения). Йодид калия с металлической ртутью непосредственно не реагирует. Он дает красный осадок йодида ртути (II) при взаимодействии с солями ртути в растворе. Если эту реакцию использовать после разделения катионов методом хроматографии на бумаге, она вполне специфична. Покраснение бумажки, пропитанной йодидом калия, при ее соприкосновении с металлической ртутью и парами ртути можно объяснить тем, что иодид калия во влажном состоянии постепенно окисляется кислородом воздуха, при этом образуется йод, который реагирует с металлической ртутью. 4KI + O2 + 2H2O = 4KOH + 2I2 2KOH + CO2 = K2CO3 + H2O Hg + I2 = HgI2 [K1] |
|
Комментарии
К1
Опечатка: 2KOH+CO2=K2CO3+H2O
Раствор карбоната калия имеет сильнощелочную реакцию. Но в окружающем воздухе присутствует избыток углекислого газа. Поэтому основным продуктом реакции будет кислый карбонат калия KHCO3, а pH в системе будет ближе к 7. Иодид ртути(II) реагирует с избытком иодида с образованием очень стабильного тетраиодомеркуриат(II) - аниона [HgJ4]2- желто-оранжевого цвета. Похожим цветом обладает и также очень стабильный тетриодвисмутат(III) [BiJ4]-. Примесь висмута может присутствовать в цинке из советских гальванических элементов. Этот цинк известен низкой чистотой, что приводило к быстрой коррозии корпуса элемента при хранении. Желтое окрашивание может возникать и в присутствии соединений свинца(II). Различить иодидные комплексы ртути и висмута можно, например, с помощью реакции с небольшим количеством аммиака. Иодидный комплекс ртути (реактив Несслера) образует интенсивно окрашенный красно-бурый иодид основания Миллона. Иодидный комплекс висмута в аналогичных условиях не должен изменить окраску. Кстати, заметное изменение окраски иодида ртути могут вызывать даже небольшие примеси аммиака в реагентах, воде или воздухе помещения. К2 Ртутно-цинковые батареи отличаются высокой надежностью при хранении и использовании в широком интервале температур. ЭДС и внутреннее сопротивление таких батарей меняются очень мало даже при большой степени разряда. Это сильно упрощает конструкцию источника питания автономных устройств, предназначенных для работы в полевых условиях. Но высокая стоимость и токсичность ртути практически исключили широкое применение этих батарей. В свое время в СССР выпускали полуавтоматические фотоаппараты и кинокамеры, в которых ртутно-цинковая батарея типа РЦ-55 использовалась для питания фотоэкспонометра. (Внешне такая батарея выглядела как одна третья часть (по высоте) от стандартной пальчиковой батареи типа АА.) Ртутно-цинковые батареи устанавливали в некоторые слуховые аппараты и в кардиостимуляторы. Но в основном их использовали в военной аппаратуре. Естественно, немало использованных батарей было утеряно в процессе и стало источником ртутного загрязнения. Облегчал ситуацию в целом низкий технический уровень массовой советской армии. Что касается количества энергии на единицу массы, то в настоящее время наилучшими являются батарейки с анодом из металлического лития (не путать с перезаряжаемыми литий-ионными аккумуляторами). Они не содержат токсичной ртути и дешевле серебряно-цинковых или ртутно-цинковых батарей. Естественно, есть и недостатки: такие батарейки сложнее в производстве, содержат дорогостоящие и часто токсичные растворители, потенциально пожароопасны. Хранятся они также хуже, чем ртутно-цинковые. Впрочем, выпускают и особо устойчивые разновидности. Популярность литий-металлических батарей вызвала неожиданную проблему в США. Там их стали использовать как доступный источник металлического лития для нелегального производства наркотиков... В 2013 году была разработана Межгосударственная Минаматская конвенция о ртути (mercuryconvention.org), направленная на максимально полное исключение всех соединений ртути из оборота. На конец 2017 года к конвенции присоединились 85 государств. Таким образом, использованию ртутно-цинковых источников тока положен конец. |