Chemistry and Chemists № 1 2024
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2024 Journal of Chemists-Enthusiasts |
Can chemical compound destroy material of container in which it is kept? - pt.1, 2, 3 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Hydrochloric acid leaks through closed bottle - pt.1
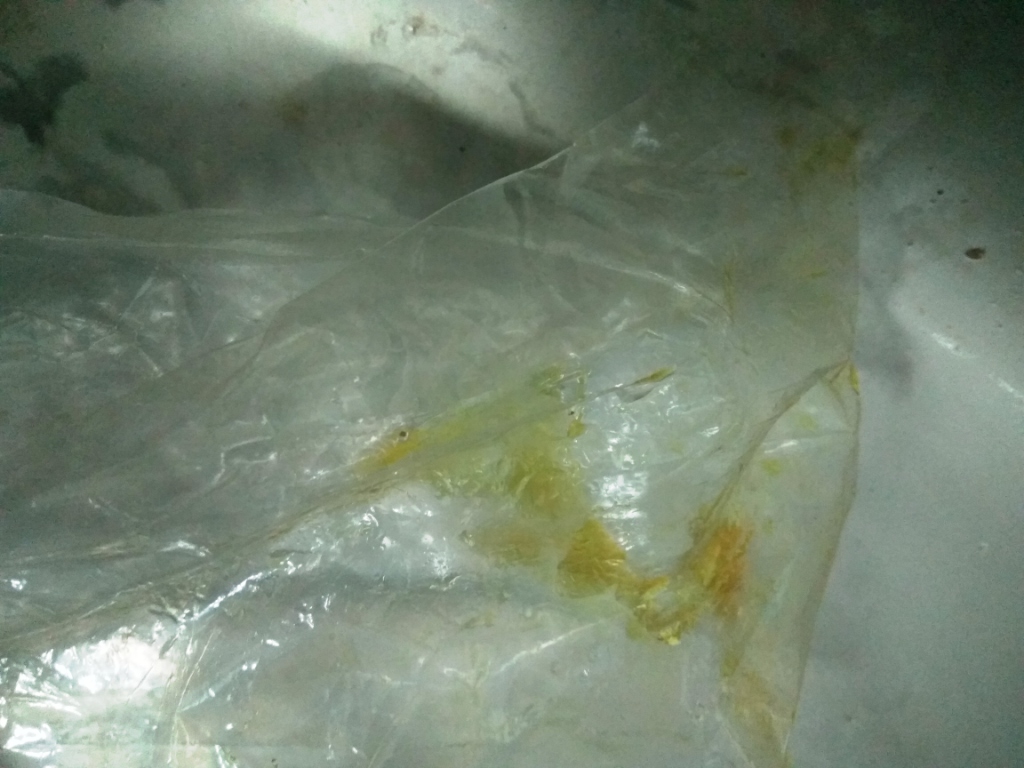
Can a chemical compound react with the material of the container and corrode it? Can chemical reagents destroy the container in which it is kept? I think the answer is obvious: "Of course they can!" If the container material reacts with this chemical, it may destroy/damage the container. The problem is especially relevant for liquid compounds and solutions. When holes form in the walls of the container, liquids leak out, which can cause serious problems (accidents, fires, poisoning, destruction of equipment, etc.) Even if the walls of the container survive, the chemical reaction can cause contamination of the chemical reagent that is stored in the container.Могут ли химические реактивы разрушить тару, в которой они хранятся? Соляная кислота протекает из закрытой бутылки - ч.1 In some cases, it is clear that this substance cannot be stored in a container made of such and such a material. For example, many people know that hydrofluoric acid destroys glass, so this acid is stored in plastic bottles and canisters (polyethene/polyethylene, polypropylene, Teflon ones). In the past, when plastic bottles were not widespread, hydrofluoric acid was poured into paraffin-coated glass bottles. In this case, everything is obvious. Hydrofluoric acid cannot be stored in a glass container: glass is damaged/destroyed by hydrogen fluoride, and the acid itself is contaminated with silicon (and other chemical elements contained in glass): SiO2 + 6HF = H2[SiF6] + 2H2O. Acids cannot be stored in containers made of metals that react with these acids. Solutions of strong alkalis cannot be stored in aluminium containers. But in practice, everything is not always so obvious. Sometimes, the answer to the question: "Can this substance be poured into this container?" causes difficulties. For example, I had a 1-litre plastic bottle. Previously, a concentrated aqueous solution of ammonia was stored in it. There were no problems. The bottle material is most likely polyethene or polypropylene. The ammonia has been used up. I washed the bottle. Can I pour hydrochloric acid into it? Of course, yes. Both polyethene and polypropylene are resistant to hydrochloric acid (and hydrogen chloride gas). There should not be any problems. So, I poured concentrated hydrochloric acid into this bottle. I packed the bottle in a plastic bag, put it in my bag and took it to work - no problem either. I put the bottle (in a plastic bag) on the shelf. The shelf was covered with galvanized steel (zinc-coated steel sheet). The people who organized the chemical laboratory did something stupid by using galvanized steel for shelves with chemical reagents. After some time, I discovered that the zinc coating began to corrode, and a yellow viscous liquid with a strong odour had accumulated in a bag near the bottom of the bottle. The liquid smelled not only of hydrochloric acid but also of turpentine. Miracle! Unfortunately, the unpleasant miracle. It turned out that concentrated hydrochloric acid could not be stored in this bottle. But I was more interested in the answer to the question: ''Why is this happening?'' The leaky bottle cap could explain why some of the acid was outside the bottle. When I carried the bottle in my bag, it tilted and shook. As a result, some acid may have leaked into the bag. But "the leaky bottle cap" does not account for the other facts. Initially, the acid in the bottle was colourless and mobile. But the liquid that collected in the bag was yellow and viscous. This means that a chemical interaction took place. The yellow colour and smell of turpentine indicate that hydrochloric acid has extracted the plasticiser from the bottle plastic. Moreover, the hydrochloric acid that remained in the bottle took on a slight yellow tint and stayed mobile; however, the hydrochloric acid that got outside the closed bottle became intensely yellow and viscous. This means that the acid penetrated through the walls of the bottle (at the same time, it extracted the plasticiser, became yellow, viscous and acquired a turpentine odour). Let me emphasize: the bottle looks undamaged. I did not notice any holes in the walls or signs of destruction of the plastic. However, the acid leaked through the walls and, in the process, became contaminated. I poured the acid from the bottle into a glass flask and closed it with a rubber stopper with polyethene film. As long as it stays like this... |

Hydrochloric acid leaks through closed bottle |

|
|

|

|
|
There was a need to bring a concentrated ammonia solution to work; I planned to experiment with zinc (the reaction of ammonia with zinc in the presence of atmospheric oxygen). I am looking for a suitable bottle, but there is not one! It is not a good idea to bring a 5-litre canister when the experiment requires 100 ml of ammonia (or less).
I decided to use a yoghurt bottle as a temporary container. The bottle was white and opaque. The material is most likely polyethylene terephthalate (PET). I remembered that polyethylene terephthalate is destroyed by alkalis. When I was young, I poured a solution of caustic soda (sodium hydroxide) with a concentration of 600 g/l into a polyethene terephthalate bottle. As a result, the bottle began to leak (over time). Holes formed in the walls through which the solution slowly flowed, falling onto the floor. This caused the oil paint to peel off on the floor. Fortunately, I noticed it in time. Moreover, hydrolysis of polyethylene terephthalate pieces obtained by cutting the bottles can be applied to produce terephthalic acid. Hydrolysis occurs when a solution of sodium hydroxide in methanol or ethylene glycol is added [1]. Also, a colleague told me that he poured ethylenediamine into a polyethylene terephthalate bottle, and as a result, the bottle shrivelled. But I decided, probably, everything will be okay. Nothing would happen to the bottle for a short time. However, the circumstances were such that the polyethylene terephthalate bottle with concentrated ammonia stayed at the laboratory for several weeks since I could not conduct experiments. As a result, on one "fine" day, I found traces of leaks on the walls of the bottle. In some places, a solid crust formed on the surface, coloured pink by a dye extracted from the label. This means that the ammonia "ate through" the bottle! I touch the bottle and find that its walls have become very thin and easily bend when touched with a finger. Typically, a spill of 200 ml of ammonia in a chemical laboratory is not considered a serious issue; it is a minor incident, nothing more. But in my case, the situation took a threatening turn. The neighbour in the laboratory is an 80-year-old man ("eighty years" is not a typo). He has an academic degree named "Candidate of Chemical Sciences", which corresponds to a PhD. In theory, his role involves performing chemical analysis, but in practice, the elderly man is terrified of anything related to chemistry (in the most literal sense). The mere smell of chemical reagents triggers panic attacks, causing him to run around the laboratory. At this moment, the old man is sure that someone is trying to poison him. When I did innocent experiments on charring paper with sulfuric acid [2], it was sufficient to make him afraid to enter this room for several days. His usual "work" is to sit at the computer and nap. Unfortunately, this is a common scenario in our country. Consequently, our science is in a difficult situation. The scientific community faces challenges: elderly individuals, indolent and senile, are taking away jobs from young men and women who dream of doing science. If the slight smell of charred paper caused my neighbour to panic, imagine what could happen when 200 ml of a concentrated ammonia solution spill! The old man could have had a heart attack on the spot... Perhaps some readers find it funny? Now, this may seem funny, but then I was not laughing. Although my neighbour is as bad a person as a chemist, I did not wish him death (in our case, this is not a metaphor or allegory). Therefore, I must prevent the ammonia from spilling from the bottle. I carefully take the bottle and put it in the container, carefully open the bottle cap and pour the ammonia into the glass. The liquid was white and cloudy (the ammonia solution was initially clear and colourless). There was a white solid inside the bottle (a precipitate). The bottle became thin and easily deformed with fingers. The ammonia did not leak out only because the holes in the walls were clogged with the solid product. I filled a bottle with water and poured it into the sink. The white precipitate (scales and flakes) flowed into the sink. I quickly flushed it down the drain to eliminate the ammonia smell. The scales/flakes are incompletely degraded polyethylene terephthalate, or possibly the ammonium salt of terephthalic acid. Then I realized, that this material could clog a sewer pipe. Although there was a small quantity of the precipitate, it was still possible. I unscrewed the sink siphon. Fortunately, I did not find any scales there, but the bottom of the siphon was filled with brown stuff. I cleaned the siphon, taking advantage of the opportunity. The issue has been resolved... ... and during this time, the old man was peacefully sleeping at the computer...  I found later that other chemists had similar results with PET bottles. Let me quote: " Few years ago, I stored some chemicals in plastic PET bottles. I found that PET bottles can be permanently destroyed by 30% hydrochloric acid (it turns into pearl like-colour, become very brittle). With ammonia bottle is thinner and thinner during time and some small holes may occur later. Strong bases solutions (NaOH, KOH) destroying bottles within a week. However, I still have 37% battery acid on the shelf in my garage (about 10 years) and no changes occur. https://www.sciencemadness.org/whisper/viewthread.php?tid=156915 "


Ammonia is also "not friendly" with glass bottles. The glass is gradually destroyed by concentrated ammonia solutions, resulting in a precipitate (white flakes) appearing in the bottle. Previously, ammonia was sold in glass bottles, which led to contamination of the reagent during storage [3].
__________________________________________________ 1 Terephthalic acid from polyethylene terephthalate / Терефталевая кислота из полиэтилентерефталата [Link] 2 See photos and video Sulfuric acid and paper / Серная кислота и бумага [Link] 3 An aqueous solution of ammonia destroys glass and becomes contaminated / Водный раствор аммиака разрушает стекло и при этом загрязняется [Link] |

Ammonia solution destroys plastic bottle |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Siphon |

|

|
|
Раствор аммиака разрушает пластиковую бутылку - ч.2
Возникла необходимость привезти на работу концентрированный раствор аммиака, я хотел поставить эксперимент с цинком (реакция аммиака с цинком в присутствии кислорода воздуха). Ищу подходящую бутылку, а ее нет! Не брать же с собой 5-л канистру, если для эксперимента нужно максимум 100 мл аммиака. Решил использовать в качестве временной тары бутылку из-под йогурта. Бутылка была белой и непрозрачной. Материал - скорее всего полиэтилентерефталат (ПЭТ, ПЭТФ). Я помнил, что полиэтилентерефталат разрушают щелочи. Еще в молодости налил в бутылку из полиэтилентерефталата раствор едкого натра с концентрацией 600 г/л, в результате бутылка потекла (со временем). В стенках образовались отверстия, через которые медленно протекал раствор, попадая на пол. От контакта со щелочной жидкостью на полу облезла масляная краска. К счастью, я тогда вовремя это заметил. Более того, гидролиз кусков полиэтилентерефталата, полученных измельчением бутылок, можно использовать для получения терефталевой кислоты. Гидролиз происходит под действием раствора едкого натра в метаноле или этиленгликоле [1]. А еще коллега рассказывал, как он налил в бутылку из полиэтилентерефталата этилендиамин, в результате бутылка сморщилась. Но я решил, что все будет хорошо. За короткое время с бутылкой, вероятно, ничего не случится. Однако, обстоятельства сложились так, что бутылка из полиэтилентерефталата с концентрированным аммиаком простояла в лаборатории несколько недель, поскольку я не имел возможности ставить эксперименты. В результате в один "прекрасный" день я обнаружил на стенках бутылки следы потеков. В некоторых местах на поверхности образовалась твердая корка, окрашенная в розовый цвет красителем, экстрагированным из этикетки. Значит аммиак "проел" бутылку насквозь! Касаюсь бутылки и обнаруживаю, что ее стенки стали очень тонкими и легко прогибаются от прикосновения пальцем. Обычно разлив 200 мл аммиака в химической лаборатории не считается чем-то серьезным: это - мелкий инцидент, не более. Но в моем случае ситуация приняла угрожающий оборот. Сосед по лаборатории - дед, которому исполнилось 80 лет (восемьдесят лет - это не опечатка). Он имеет ученую степень "кандидат химических наук", которая соответствует PhD. Теоретически, его работой является проведение химического анализа. Однако, практически, дед панически боится всего, что связано с химией. В самом буквальном смысле слова. Запах химических реактивов вызывает у него приступ паники: он начинает бегать по лаборатории в уверенности, что его пытаются отравить. Невинных экспериментов по обугливанию бумаги серной кислотой [2] хватило, чтобы он несколько дней боялся заходить в эту комнату. Обычная его "работа" - сидеть возле компьютера и спать. К сожалению, для нашей страны такое типично. Потому и наука у нас в тяжелом положении: такие вот старые лентяи и маразматики отбирают рабочие места у молодых людей, которые мечтают заниматься наукой. Если легкий запах обугленной бумаги вызвал у деда панику, представьте, что могло случиться, если разольется 200 мл концентрированного раствора аммиака! Дед мог получить инфаркт на месте... Возможно, некоторым читателям смешно? Сейчас это действительно может показаться смешным, но тогда мне было не до смеха. Хоть человек он такой же плохой, как и химик, я не желал ему смерти (в данном случае это не метафора или аллегория). Раз так, я должен не допустить, чтобы аммиак из бутылки разлился. Осторожно беру бутылку и ставлю в лоток, осторожно открываю крышку и переливаю аммиак в стакан. Жидкость оказалась белой и мутной (первоначально раствор аммиака был прозрачным и бесцветным). Внутри бутылки было белое твердое вещество (осадок). Бутылка стала тонкой и легко деформировалась пальцами. Аммиак не вытек только потому, что отверстия в стенках забились твердым продуктом. Я набрал в бутылку воду и вылил ее в раковину. В раковине оказались белые чешуйки. Я быстро смыл их в канализацию, чтобы устранить запах аммиака. Чешуйки - не полностью разрушенный полиэтилентерефталат, или, возможно, аммониевая соль терефталевой кислоты. Потом я спохватился: так можно забить канализационную трубу. Осадка было мало, но все-таки. Раскрутил сифон раковины. Чешуек я там не обнаружил, но углубление сифона было заполнено коричневой массой. По случаю, почистил сифон. Авария устранена... ... а в это время дед мирно спал, сидя за компьютером...  Позже я обнаружил, что схожие результаты с бутылками из полиэтилентерефталата были и у других химиков. Приведу цитату: " Несколько лет назад я хранил некоторые реактивы в пластиковых ПЭТ бутылках. Я обнаружил, что ПЭТ бутылки могут быть необратимо разрушены 30% соляной кислотой (бутылка приобретает жемчужный цвет и становится очень хрупкой). Бутылка с аммиаком со временем становится все тоньше и тоньше, и позже в ней могут образоваться небольшие дырочки. Растворы сильных оснований (NaOH, КОН) разрушают бутылки в течение недели. Однако у меня в гараже до сих пор хранится 37% аккумуляторная кислота (около 10 лет), и никаких изменений не происходит. https://www.sciencemadness.org/whisper/viewthread.php?tid=156915 " Со стеклянными бутылками аммиак также "не дружит". Стекло постепенно разрушается концентрированным растворам аммиака, в результате в бутылке появляется осадок (белые чешуйки). Раньше аммиак продавали в стеклянных бутылках, что приводило к загрязнению реактива при хранении [3]. __________________________________________________ 1 Terephthalic acid from polyethylene terephthalate / Терефталевая кислота из полиэтилентерефталата [Link] 2 See photos and video Sulfuric acid and paper / Серная кислота и бумага [Link] 3 An aqueous solution of ammonia destroys glass and becomes contaminated / Водный раствор аммиака разрушает стекло и при этом загрязняется [Link] |
|
Glacial acetic acid became contaminated due to storage in glass bottle - pt.3
Glacial acetic acid became impure due to storage in a glass bottle. Is it possible? Yes, It is quite possible. Of course, glass is resistant to acetic acid, but... Ледяная уксусная кислота загрязнилась в результате хранения в стеклянной бутылке - ч.3 But let us not get ahead of ourselves and talk about everything in order. I planned to dissolve copper in dilute acetic acid to take photos/videos of the experiment. Some readers perhaps say that copper does not dissolve in acetic acid, won't they? Metallic copper dissolves in this acid if an oxidizing agent is present, such as hydrogen peroxide or atmospheric oxygen. I did not have acetic acid, so I asked a colleague. A colleague gave me glacial acetic acid, which was contained in a glass kefir bottle [5]. I took a flask, poured glacial acetic acid and distilled water into it and dipped stripped copper wire into the solution. I saw that the solution became cloudy! What is the reason for the appearance of turbidity in the liquid? The distilled water was without any traces of turbidity. The acetic acid was chemically pure, transparent and colourless in appearance. Could the flask be contaminated? The flask was brand new and visibly clean. Where did I acquire this flask? At work. In theory, the flask was intended to distil water samples before analysis. But in reality, my neighbour (the same one discussed in the last part of the article) does not use distillation flasks. He does not need them. My neighbour invented a new method of water distillation, unknown to science. The method could be termed "Direct distillation" and does not include boiling, evaporation, or condensation. How is it possible? The neighbour takes the original sample of water (that needs to be distilled) and pours it into a receiving flask designed for the already distilled sample. In other words, he does not need the distillation flask, condenser, electric stove/heater and other parts of the distillation unit. All this equipment lies idle in a safe. Does this impact the analysis results? Undoubtedly, yes. However, there is no one to verify the accuracy of his analysis. This is how the laboratory works... Perhaps there was a contamination invisible to the eye on the walls of the flask? Just because the flask is new does not necessarily mean it is clean. After the problem occurred, I washed the flask thoroughly. Again, I added acetic acid into it - the liquid was transparent and colourless. Then, I added water, and the solution became cloudy. Therefore, the acetic acid was contaminated. This acetic acid contained a compound soluble in it but insoluble in water (or several compounds). Consequently, when water is added, the compound is released as a distinct phase, forming a suspension/emulsion or colloidal solution. This phenomenon is well known. In particular, it is observed if a solution of pine rosin in alcohol is added to water [4]. The described procedure can be used to demonstrate the Tyndall effect during lectures. Instead of a solution of rosin in alcohol, cheap cologne or similar liquids are suitable. But how did the unknown compound(s) get into the acetic acid? The acid was initially pure and was stored in a glass bottle. I guessed right away: the bottle has... a cap! The cap was metallic, coated with a layer of plastic. The cap must be chemically resistant to food in an acidic medium (kefir contains organic acids and has a sour taste). An examination showed clear signs of destruction of the protective plastic coating on the inner surface of the bottle cap. Glacial acetic acid extracted the components of the plastic. This solution looks no different from glacial acetic acid until we add water. Compounds extracted from plastic are soluble in acetic acid but not soluble in water, so a suspension (emulsion or colloidal solution) is formed when water is added. Kefir is primarily composed of water, so the bottle cap material must not contain water-soluble compounds (but it does not necessarily have to be resistant to pure acetic acid or other organic solvents). The experiment with acetic acid and copper had to be postponed. Instead, I filmed another experiment. It demonstrates how storage in a glass bottle with a plastic-coated cap changed the properties of acetic acid. I poured glacial acetic acid (from our bottle) into a glass and placed a glass with distilled water next to it. Both liquids were clear and colourless (without traces of turbidity). I added distilled water to acetic acid and mixed them. The solution became cloudy. When a green laser beam passed through the solution, the Tyndall effect was clearly visible. The result was clear. If the colleague had placed a polythene film between the bottle and the cap, the described problem would not have arisen. Luckily, acetic acid is cheap, and the colleague gave me another bottle of acetic acid. As I write these lines, the experiment on the interaction of acetic acid and copper has already been completed. __________________________________________________ 4 See the article Tyndall Effect (Solution of Rosin in Ethanol was Added to Water) / Конус Тиндаля (раствор канифоли в этаноле добавили в воду) [link]. 5 Kefir is a sour drink made from fermented milk, originally from Central Asia. In our country, this beverage is popular. |

Glacial acetic acid became contaminated due to storage in glass bottle |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Ледяная уксусная кислота загрязнилась в результате хранения в стеклянной бутылке - ч.3
Ледяная уксусная кислота загрязнилась во время хранения в стеклянной бутылке. Это возможно? Вполне возможно. Разумеется, стекло устойчиво к уксусной кислоте, но... Но не будем забегать наперед. Теперь - обо всем по порядку. Я запланировал эксперимент по растворению меди в разбавленной уксусной кислоте. Некоторые читатели скажут, что медь в уксусной кислоте не растворяется? Растворяется, если присутствует окислитель, например, перекись водорода или кислород воздуха. Уксусной кислоты у меня не было, я попросил у коллеги. Коллега дал ледяную уксусную кислоту, которая была в стеклянной бутылке из-под кефира. Я взял колбу, налил туда ледяную уксусную кислоту, дистиллированную воду и опустил в раствор зачищенную медную проволоку. Смотрю, а раствор - мутный! В чем причина появления мути в жидкости? Вода была дистиллированной, без следов мути. Уксусная кислота была химически чистой, на вид - прозрачной и бесцветной. Вероятно, колба было грязной? Колба была новой, визуально чистой. Где я взял эту колбу? На работе. Теоретически она предназначалась для перегонки образцов воды перед анализом. Но реально мой сосед (тот самый, речь о нем шла в прошлой части статьи) перегонными колбами не пользуется. А зачем? Он изобрел новый, неизвестный науке метод перегонки воды. Какой? Его можно назвать "Прямая перегонка", данный метод не требует кипения, испарения и конденсации жидкости. Сосед берет исходный образец воды (который необходимо перегнать) и переливает его в колбу-приемник, предназначенную для уже перегнанного образца. Другими словами, перегонная колба, холодильник, электроплитка/нагреватель (и прочие детали перегонной установки) ему не нужны. Перегонное оборудование просто лежат без дела в сейфе. Влияет ли это на результаты анализа? Разумеется, да. Но проверить достоверность его анализов некому. Так лаборатория и работает... Возможно, невидимое глазу загрязнение таки было на стенках колбы? Если колба новая, это не обязательно означает, что она чистая. После возникновения проблемы я тщательно вымыл колбу. Снова добавляю в нее уксусную кислоту - жидкость прозрачная и бесцветная. Добавляю воду - жидкость стала мутной. Все понятно. Уксусная кислота была загрязнена. В ней было растворено вещество, которое растворимо в уксусной кислоте, но не растворимо в воде (возможно, не одно, а несколько веществ). Поэтому при добавлении воды, вещество выделяется в отдельную фазу, которая образует суспензию/эмульсию или коллоидный раствор. Данное явление хорошо известно, в частности, оно наблюдается, если раствор сосновой канифоли в спирте добавить в воду [4]. Описанную процедуру можно использовать для демонстрации эффекта Тиндаля во время лекций. Вместо раствора канифоли в спирте подойдут дешевый одеколон или аналогичные жидкости. Но как неизвестное вещество (вещества) попало в уксусную кислоту? Кислота изначально была чистой и хранилась она в стеклянной бутылке. Я догадался сразу: у бутылки есть... пробка! Крышка была металлической, покрытой слоем пластика. Крышка должна быть химически устойчивой к пищевым продуктам в кислой среде (кефир содержит органические кислоты и имеет кислый вкус). Осмотр показал, что на внутренней поверхности крышки были явные признаки разрушения защитного пластикового покрытия. Ледяная уксусная кислота экстрагировала компоненты пластика. Этот раствор внешне не отличается от ледяной уксусной кислоты до тех пор, пока мы не добавим воду. Экстрагированные из пластика вещества растворимы в уксусной кислоте, но не растворимы в воде, поэтому при добавлении воды образуется суспензия (эмульсия или коллоидный раствор). Кефир состоит в основном из воды, поэтому материал крышки бутылки не должен содержать веществ, растворимых в воде (но он не обязательно должен иметь устойчивость к чистой уксусной кислоте или другим органическим растворителям). Эксперимент с уксусной кислотой и медью пришлось отложить. Вместо него я снял на видео другой эксперимент. Он наглядно демонстрирует, как хранение в стеклянной бутылке с покрытой пластиком крышкой изменило свойства уксусной кислоты. В стакан налил ледяную уксусную кислоту (из нашей бутылки), рядом поставил стакан с дистиллированной водой. Обе жидкости были прозрачные и бесцветные (без следов мути). К уксусной кислоте добавил дистиллированную воду, перемешал. Раствор стал мутным. При прохождении сквозь раствор зеленого луча лазера был четко виден эффект Тиндаля. Результат получился наглядный. Уверен, что, если бы между бутылкой и крышкой коллега проложил полиэтиленовую пленку, описанной проблемы не возникло бы. К счастью, уксусная кислота - небольшая ценность, коллега просто дал мне другую бутылку с уксусной кислотой. Когда я пишу эти строки, эксперимент с уксусной кислотой и медью уже завершен. __________________________________________________ 4 See the article Tyndall Effect (Solution of Rosin in Ethanol was Added to Water) / Конус Тиндаля (раствор канифоли в этаноле добавили в воду) [link]. |
|
Комментарии
К1
Я наблюдал разрушение пластиковых канистр для химикатов при хранении в них крепкой перекиси. Причем канистра начинала разрушаться сверху, там где не было жидкости.
К1-1 У близкого друга один раз растрескалась бутылка (тоже сверху), в которой был 1 л перекиси 35% - без существенных последствий. Я даже сфотографировал бутылку http://chemistry-chemists.com/N3_2021/ChemistryAndChemists_3_2021-P5-1.html Второй раз это же случилось с 5-л канистрой - пришлось вытирать с пола кухни. Счастье, что кошка не влезла в лужу. К1-1-1 Ага, была точно такая же картина: канистра сверху растрескалась, как будто лето на солнце простояла. К2 От ледяной уксусной кислоты ПЭТ бутылки со временем мутнеют и деформируются, хоть кислота и считается слабой. После такого хранения я бы не стал использовать кислоту в пищевых целях. |