Chemistry and Chemists № 1 2024
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2024 Journal of Chemists-Enthusiasts |
Reaction of copper metal with acetic acid pt.1, 2, 3 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Reaction of copper metal with acetic acid - pt.1
Does copper react with acetic acid? According to many textbooks, copper does not react with non-oxidizing acids, such as hydrochloric acid, dilute sulfuric acid, phosphoric acid, etc., because copper has a higher reduction potential than hydrogen. Copper dissolves in acids in which an anion acts as an oxidizing agent, for example, concentrated sulfuric acid, dilute and concentrated nitric acid, selenic acid, perchloric acid, etc. Реакция металлической меди с уксусной кислотой - ч.1 When I studied at the university, I read in a textbook on chemical technology the description of the method for producing copper sulfate in industry. Some readers will assume that copper sulfate is produced industrially by heating copper metal with concentrated sulfuric acid, as we did during laboratory work in school, or perhaps copper sulfate is prepared by the reaction of copper oxide (carbonate) with sulfuric acid. It turns out that copper sulfate is not produced in factories in this way. In industry, the reaction of copper metal with dilute sulfuric acid in the presence of air is applied to produce copper sulfate. Oxygen plays the role of an oxidizing agent. The reaction is carried out in special towers filled with copper metal. The copper is irrigated from above with dilute sulfuric acid, and an airflow is supplied from below [3]. 2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O 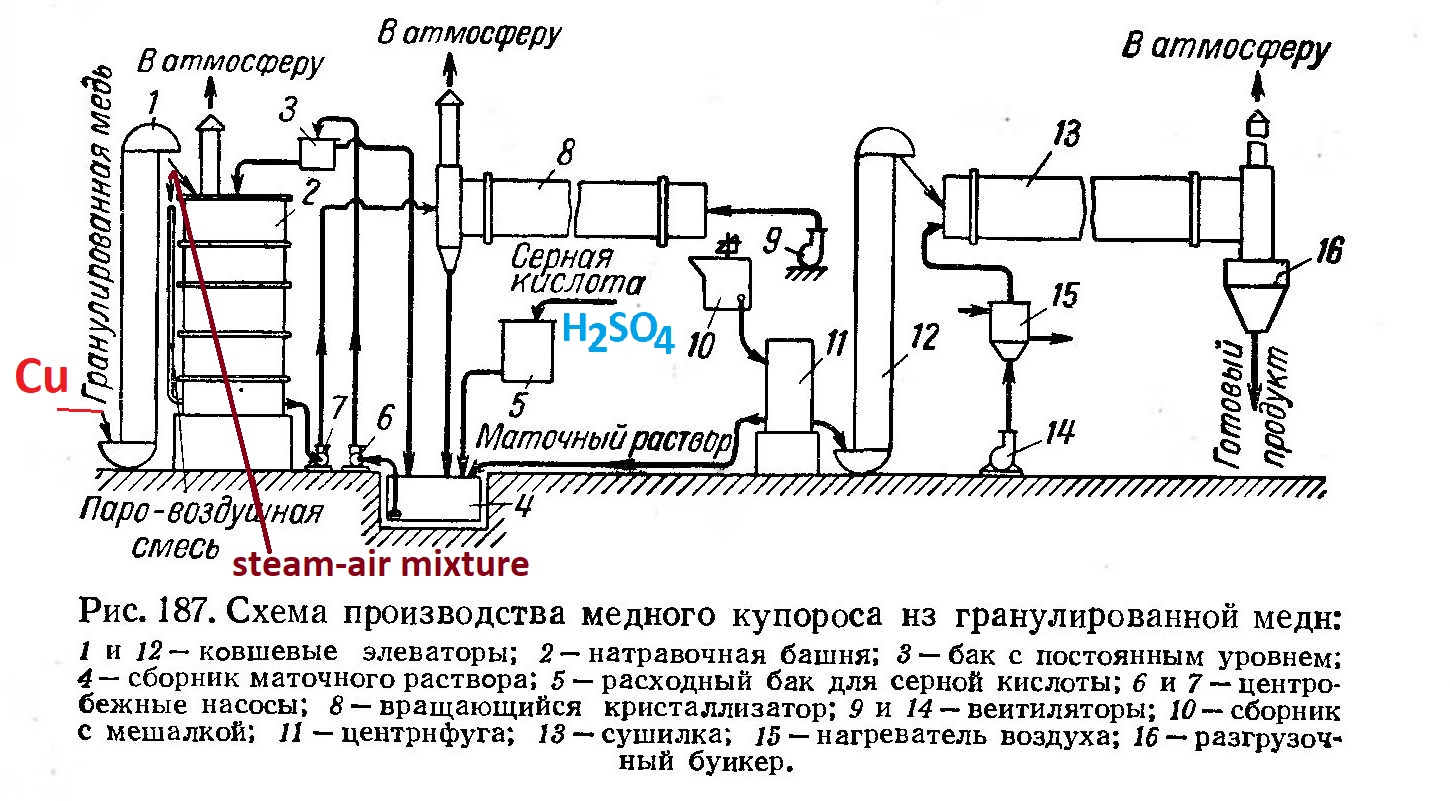
The copper sulfate production scheme (granulated copper metal and sulfuric acid are initial materials) Many years ago, I carried out experiments on dissolving copper in concentrated hydrochloric acid and in dilute sulfuric acid [1]. The results were visual. Is it possible to use weaker (and more accessible) acids, such as acetic acid, to dissolve copper? It turns out that you can... Moreover, you can use a diluted acid, even a table vinegar! A colleague recently wrote: "Copper dissolves well not only in hydrochloric acid but even in 5% table vinegar. I recently needed a solution of copper salt as a fungicide (actually, any copper salt is suitable). The only reagents were salt, soda, vinegar and citric acid. I took a plastic cup, put a copper wire, filled it with vinegar and covered it with film. I stirred it once or twice a day. After a week, a dark blue solution formed. I had to take a photo, but I did not. Of course, if I have to repeat it, I will photo it." In other words, in the colleague's experiment, copper reacted easily with very dilute acetic acid, and the reaction did not require any special conditions. I decided to repeat this experiment. For now, I lack access to a chemical laboratory and must work in unsuitable conditions. Therefore, I prefer simple experiments. On the other hand, they can be easily repeated by many readers. I added 10 ml of glacial acetic acid and 50 ml of distilled water to a conical flask (the acid concentration is about 17%). Then, I placed the stripped copper wire into the flask and stirred. I closed the flask. Most of the volume of the flask was occupied by air. From time to time, I opened the cap and stirred the contents. At the same time, new portions of air entered the flask. I have described the observations below. Day 5. The solution remained colourless (the blue colour was not noticeable). The area of the wire, located above the surface of the acetic acid, turned black, which was the only noticeable change. However, the black colour disappeared when the area was immersed in the solution. Day 9. The solution turned slightly blue (aqua-blue). I noticed that the wire area located above the solution's surface was not black (the colour of copper oxide) but dark green (the colour of solid copper acetate). Day 11. The solution was slightly blue. The copper wire above the solution level had a dark green coating; the copper wire below the solution level had a shiny surface, characteristic of non-oxidized copper metal. Day 15. The colour intensity of the solution increased. The rest was similar to the previous one. Day 66. Intense blue solution. Part of the surface of the copper wire was covered with a dark green coating (above the surface of the liquid). Day 86. The blue solution (the colour is more intense). Part of the surface of the copper wire was covered with a dark green coating (above the surface of the liquid). The thickness of the copper wire decreased significantly. The experiment is over. Thus, when copper wire reacts with dilute acetic acid in the presence of air, an intense blue solution of copper acetate is formed. 2Cu + 4CH3COOH + O2 = 2Cu(CH3COO)2 + 2H2O The reaction took quite a long time. To expedite the process, you can increase the amount of copper wire or use sponge copper (to increase the contact surface). Since this reaction is heterogeneous, enhancing the contact surface of the reactants accelerates the interaction. Stirring the reaction mixture is also beneficial as it speeds up the diffusion of oxygen to the copper surface. Under laboratory conditions, however, it is more convenient to add hydrogen peroxide to the solution; this compound should significantly speed up the dissolution of copper. I have not yet conducted such an experiment, although I have used other mixtures containing hydrogen peroxide to dissolve copper. In the future, I plan to conduct... some other experiments with copper metal, but I should not write about them yet. Otherwise, they may not work out. Sorry for being superstitious. P.S. While translating the article into English, I had to do a Google search because I was unsure of the accurate translation of some chemical terms. As a result, I accidentally found an article in a popular educational magazine where the author suggests using this reaction to teach students the basics of experimental work and to help them better assimilate theoretical chemistry [2]. __________________________________________________ 1 See the article Copper and acids / Медь и кислоты [link]. 2 See the article Stephen DeMeo - Does Copper Metal React with Acetic Acid? // J. Chem. Educ. 1997, 74, 7, 844 [link]. 3 See the book М.Е. Позин Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот) ч.1 [link]. |

Reaction of copper metal with 7% acetic acid |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Реакция металлической меди с уксусной кислотой - ч.1
Реагирует ли медь с уксусной кислотой? Во многих учебниках пишут, что медь не реагирует с кислотами-неокислителями, такими как соляная кислота, разбавленная серная кислота, фосфорная кислота и т.д., поскольку медь имеет более высокий окислительно-восстановительный потенциал, чем водород. Медь растворяется в кислотах, в которых функцию окислителя выполняет анион, например, концентрированная серная кислота, разбавленная или концентрированная азотная кислота, селеновая кислота, хлорная кислота и т.д. Когда я учился в университете, то в учебнике по химической технологии прочитал про метод получения сульфата меди в промышленности. Некоторые читатели сделают предположение, что сульфат меди получают в промышленности путем нагревания металлической меди с концентрированной серной кислотой, как это мы делали на лабораторных работах по химии, или с помощью реакции оксида (карбоната) меди с серной кислотой. Оказывается, что сульфат меди на заводах так не получают. В промышленности используют реакцию металлической меди с разбавленной серной кислотой в присутствии воздуха чтобы получить медный купорос. Роль окислителя играет кислород. Реакцию проводят в специальных башнях, заполненных металлической медью. Сверху медь орошают разбавленной серной кислотой, снизу подается поток воздуха [3]. 2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O 
The copper sulfate production scheme (granulated copper metal and sulfuric acid are initial materials) Много лет назад я проводил эксперименты по растворению меди в концентрированной соляной кислоте и в разбавленной серной кислоте [1]. Результаты были наглядными. А можно ли использовать для растворения меди более слабые (и доступные) кислоты, например, уксусную? Оказывается, можно... Более того, можно использовать разбавленную кислоту, даже столовый уксус! Недавно коллега написал: "Медь отлично растворяется не то, что в соляной кислоте, а даже в столовом 5% уксусе. Мне недавно понадобился в качестве фунгицида раствор соли меди (фактически любой). Из реактивов только соль, сода, уксус и лимонная кислота. Взял пластиковый стаканчик, положил проволоку, залил уксусом и затянул пленкой. Раз-два в день перемешивал. Через неделю образовался темно-синий раствор. Надо было сфотографировать, конечно, если придётся повторить - сниму." Другими словами, в эксперименте коллеги медь легко реагировала с очень разбавленной уксусной кислотой, и реакция не требовала каких-то особых условий. Я решил повторить данный эксперимент. Сейчас у меня нет доступа к химической лаборатории, работать приходится в ненадлежащих условиях. Следовательно, простые эксперименты для меня предпочтительны. С другой стороны, их легко могут повторить многие читатели. В коническую колбу добавил 10 мл ледяной уксусной кислоты и 50 мл дистиллированной воды (концентрация кислоты около 17%). Поместил в колбу зачищенную медную проволоку, перемешал. Закрыл колбу. Большую часть объема колбы занимал воздух. Но я все равно время от времени открывал пробку и перемешивал содержимое. При этому в колбу попадали новые порции воздуха. Ниже я описал наблюдения. День 5-й. Раствор так и остался бесцветным (голубой окраски было незаметно). Единственное заметное изменение - участок проволоки, который оказался над поверхностью уксусной кислоты, почернел. При погружении его в раствор черный цвет исчез. День 9-й. Раствор стал слегка голубым. Заметил, что участок проволоки над поверхностью раствора окрашен не в черный цвет (цвет оксида меди), а в темно-зеленый (цвет твердого ацетата меди). День 11-й. Раствор был слегка голубым. На медной проволоке выше уровня раствора темно-зеленый налет, медная проволока ниже уровня раствора имеет блестящую поверхность, характерную для не окисленной меди. День 15-й. Интенсивность цвета раствора увеличилась. В остальном - аналогично предыдущему. День 66-й. Интенсивно-голубой раствор. Часть поверхности медной проволоки покрыта темно-зеленым налетом (над поверхностью жидкости). День 86-й. Интенсивно-голубой раствор (интенсивность окраски увеличилась). Часть поверхности медной проволоки покрыта темно-зеленым налетом (над поверхностью жидкости). Толщина медной проволоки значительно уменьшилась. Эксперимент окончен. Таким образом, при взаимодействии медной проволоки с разбавленной уксусной кислотой в присутствии воздуха образовался интенсивно-синий раствор ацетата меди. 2Cu + 4CH3COOH + O2 = 2Cu(CH3COO)2 + 2H2O Реакция потребовала довольно длительное время. Для ускорения реакции можно использовать большее количество медной проволоки или взять губчатую медь (для увеличение поверхности соприкосновения). Данная реакция гетерогенная, следовательно, увеличение поверхности соприкосновения реагентов увеличивает скорость гетерогенного взаимодействия. Полезным является также перемешивание реакционной смеси, поскольку оно ускоряет диффузию кислорода к поверхности меди. Однако, в лабораторных условиях более удобно добавить в раствор перекись водорода - это вещество должно значительно ускорить растворение меди. Такой эксперимент я пока не проводил, хотя использовал для растворения меди другие смеси, содержащие перекись водорода. В будущем планирую провести... некоторые другие эксперименты с медью, но писать о них пока не стоит. Иначе они могут не получиться. Простите за суеверность. P.S. Когда переводил статью на английский, вынужденно обратился к поиску в Google, поскольку не был уверен, как правильно перевести некоторые химические термины. В результате случайно нашел статью в хорошем образовательном журнале, автор предлагает использовать данную реакцию для обучения студентов основам экспериментальной работы, а также для лучшего усвоения студентами теоретического материала по химии [2]. __________________________________________________ 1 See the article Copper and acids / Медь и кислоты [link]. 2 See the article Stephen DeMeo - Does Copper Metal React with Acetic Acid? // J. Chem. Educ. 1997, 74, 7, 844 [link]. 3 See the book М.Е. Позин Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот) ч. 1 [link]. |

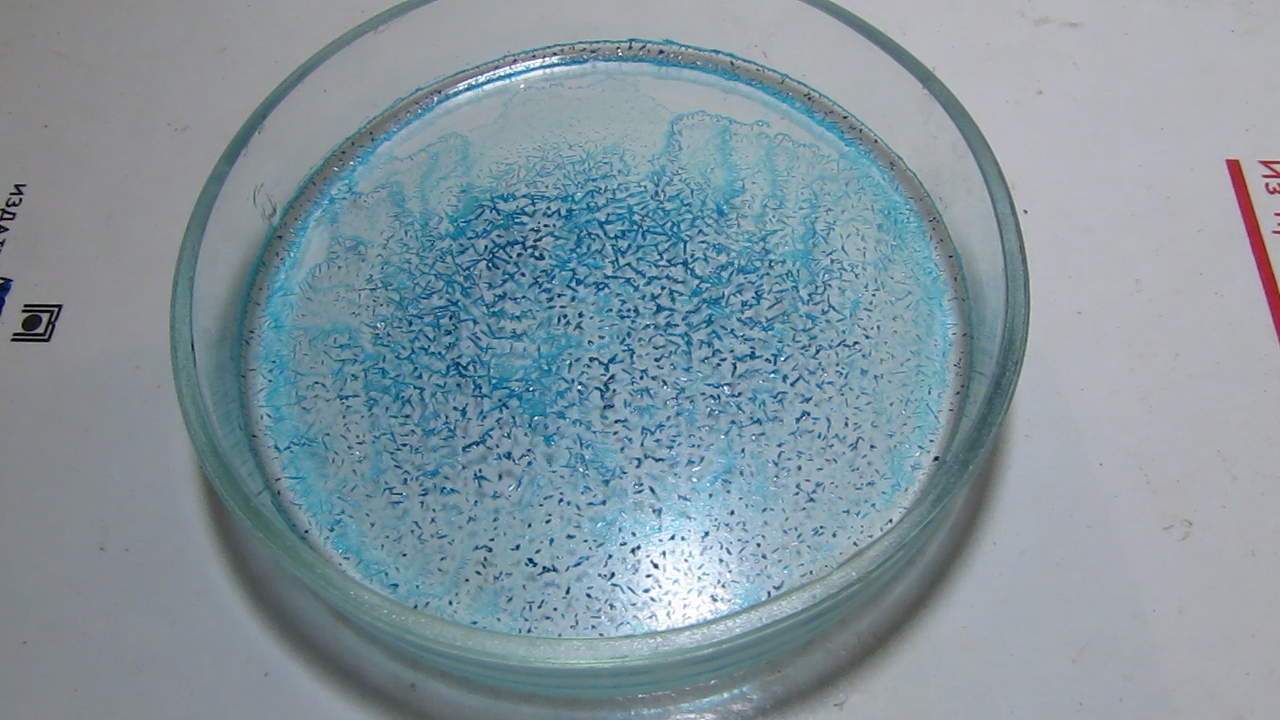
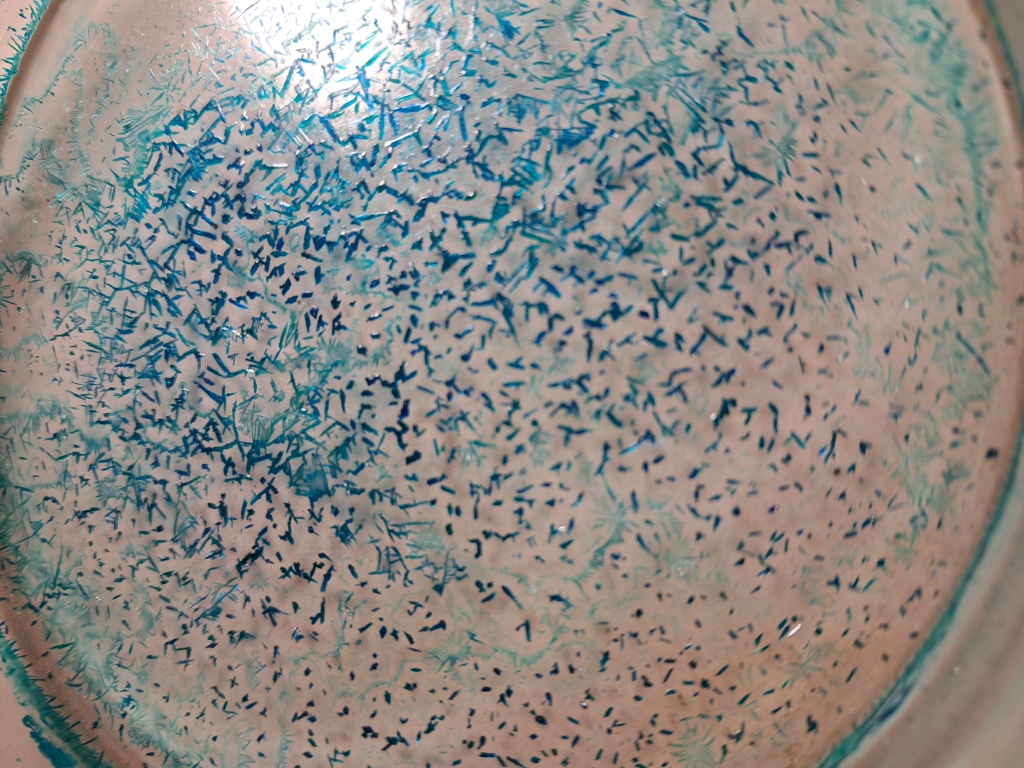
Crystallization of copper acetate at room temperature |

|

|
|

|

|
|

|

|

|

|
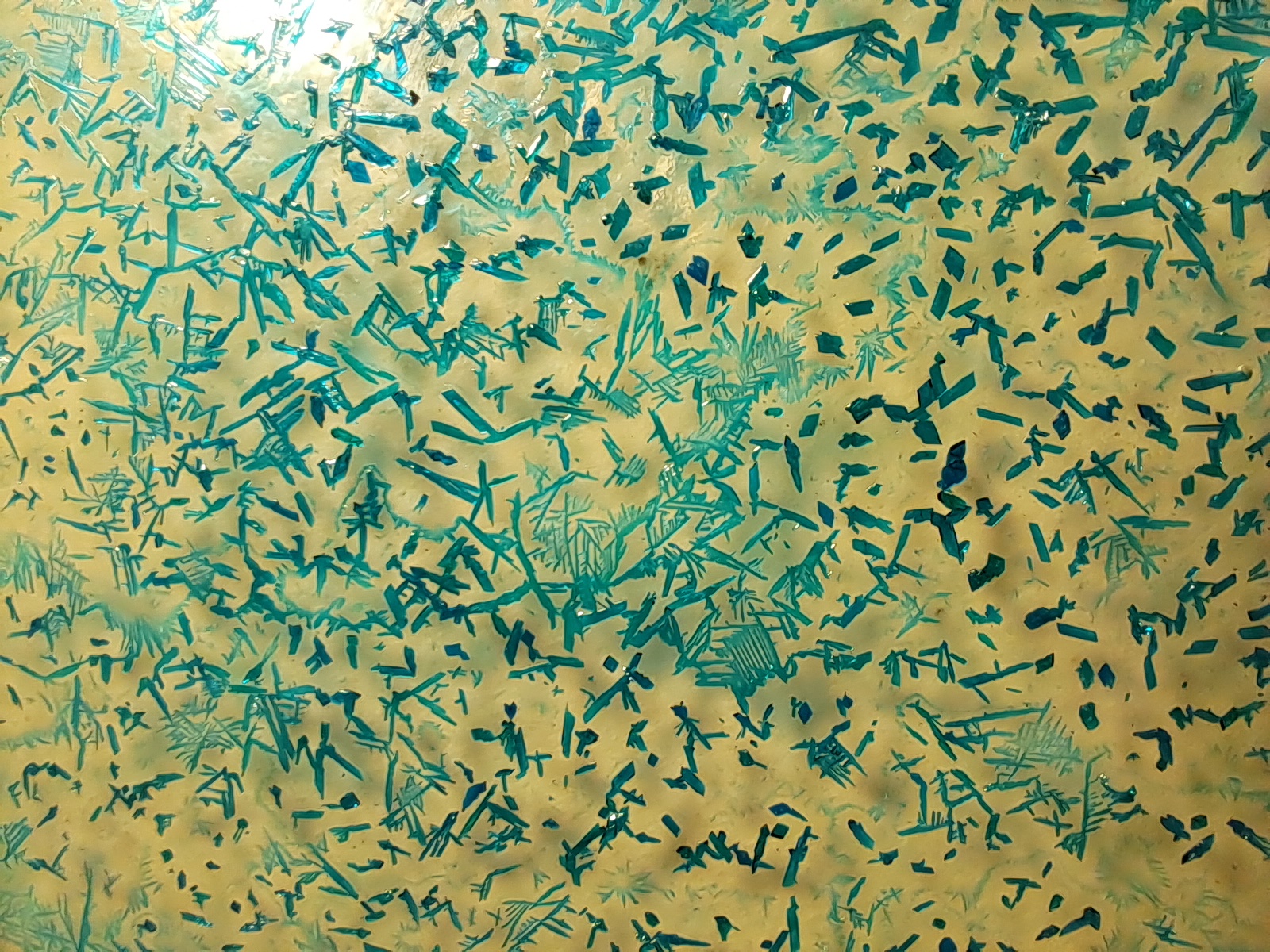
|

|

|

|

|

|

|

|

|

|

|

|

|
|
Copper acetate, copper sulfate and iron metal - pt.3
At the moment, I have been doing chemistry for more than 35 years, but any long journey begins with the first step. My first independent chemical experiment was the oxidation of ethyl alcohol with potassium permanganate. I was ten years old then. The first chemical experiment I saw was three years earlier. Now, in the era of mass Internet and online video, you can click the mouse to see everything you want: the reaction of caesium with water, a model of the atomic nucleus, pictures of the NASA Hubble telescope, and a dancing kangaroo, etc. Ацетат меди, сульфат меди и металлическое железо - ч.3 Things were different when I was a child. There was no internet or accessible computers. Our country was a part of the "socialist concentration camp", so what was shown on TV was mainly communist propaganda or classical music concerts. There were educational movies, in particular, about chemical experiments, but they were rarely shown on TV. Sometimes, educational films were shown at schools, and they were not digital video files but analogue old movies (films recorded on a film stock made of nitrocellulose or сellulose acetate, like films in the time of Charlie Chaplin, only with sound). The image was projected from a moving film stock onto a white screen. The device intended for this was called a ''projector'' (also, a "movie projector" or "film projector"). It was not available in all schools. And where there was one, the projector was rarely used. The number of films was quite limited. And, of course, copying an old analogue movie was a complicated procedure, unlike copying modern video files. 

Often, to see a chemical experiment, you had to do it yourself. Sometimes, chemical experiments were shown by chemistry teachers during lessons. However, we started studying chemistry only in the 7th grade of school (and I still associate school itself with prison). When I was in the first grade, high school students visited our class during a break between lessons, accompanied by a chemistry teacher. They brought a test tube containing a blue solution and asked the student for a steel pin. The students put it into the blue liquid, and the silver-coloured pin turned red. The iron surface became the appearance of shiny copper. Then, the students removed the pin from the solution and wiped it with paper. The copper layer was entirely removed, the pin returned to its original appearance and was given back to the owner. This was the first chemical experiment I saw in my life and the last one I saw in three years. Much later, I learned that the test tube contained a solution of copper sulfate, which reacted with metallic iron to form iron(II) sulfate and metallic copper. The copper coating obtained this way does not stick to the surface firmly and can be easily erased even with paper or cloth. CuSO4 + Fe = FeSO4 + Cu Many years have passed... After the previous experiment, the solution of copper acetate with an excess of acetic acid remained. I decided to conduct another experiment involving an iron nail and copper acetate. A nail made of plain-carbon steel was placed in a glass. Then, I added the copper acetate solution. I expected that the silver-grey surface of the iron would quickly become covered with a layer of copper. The copper layer could be red or black, exhibit a shiny surface (as observed in the mentioned experiment), or take on a sponge-like texture. But time passed, and the surface of the nail remained unchanged! Perhaps the nail was made of high-quality stainless steel, which is chemically resistant? No, it was not. The nail was made of cheap plain-carbon steel, which corrodes easily. Other same nails that were stored nearby became rusty. Why did the surface of the iron metal remain without visible changes? Perhaps copper acetate reacts with iron more slowly than copper sulfate? Finally, the surface of the iron began to turn black, but upon direct observation, I did not notice this. I saw the moment when the blackening started only after the experiment - while watching the video. Therefore, I decided to carry out another experiment in parallel. I poured a solution of copper sulfate into the beaker and put a similar iron nail in it. I did not weigh the compound, but I tried to ensure that the colour intensity of the copper sulfate solution was approximately the same as that of the copper acetate solution (so that the conditions were comparable). Despite my efforts, the copper sulfate solution turned out darker. The iron nail began to turn black in the copper sulfate solution much faster than in the acetate solution. Most of the nail surface turned black, and the head turned red (the black and red colours are due to the release of copper metal). For clarity, I placed two glasses containing the solutions of the copper salts next to each other. Although the nail was in the glass with copper acetate much longer, its surface looked lighter; the head of this nail also turned red. The nail immersed in the copper sulfate looked darker. Perhaps other iron samples will react with copper salts more actively than these nails? I had old steel paper clips. Many years ago, my father bought them; now, they were lying idle. The paper clips were made of cheap plain-carbon steel. In the state we lived in at that time, high-quality alloy steel was used primarily to produce weapons to kill people and not to produce goods FOR people's needs. I placed a paper clip into each of the glasses. Relatively quickly, the surface of the iron was covered with copper. The copper coating was red and shiny in some places, grey or black and dull in others. All these colours were due to one metal - copper. Compact copper is red and shiny, dispersed copper is red and matte, and more dispersed copper is grey or black (all finely dispersed metals are black). When I removed the nails and paper clips from the solutions, the copper coating was easily removed from their surfaces by wiping them with paper. Nails and paper clips have regained their original appearance. To coat the steel surface with copper, electroplating (electrochemical deposition) should be used. Additionally, the iron object must be connected to an electric current source BEFORE being immersed in the solution of a copper salt (a copper plating electrolyte). |

Copper acetate, copper sulfate and iron metal |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Комментарии
К1
Химическое меднение стали иногда используется перед разметкой деталей - царапины лучше видно на покрытии и легче наносить. Варьированием состава можно добиться более-менее удовлетворительной адгезии для этой цели.
См. Шкержик Я. Рецептурный справочник для электротехника: Пер. с чешек. - 3-е изд. - М.: Энергоатомиздат,
1989 с.48. Состав № 168 у меня работал лучше, чем более сложный № 169.
К1-1 Имел дело с ванной химического никеля, читал про аналогичную ванну для кобальта. Но именно медь на сталь и пластик у нас наносили гальванически. Насчет меднения для облегчения разметки, лично мне эта идея не очень нравится, т.к. остатки меди дадут гальваническую пару. |