Chemistry and Chemists № 1 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2025 Journal of Chemists-Enthusiasts |
Hello again, electroplating. Nickel plating of stainless steel... in analytical chemistry laboratory - parts 3, 4 И снова здравствуй, гальваника. Никелирование нержавеющей стали... в лаборатории аналитической химии Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Watt's nickel / Никель Уотта - part - 3
День начал с того, что приготовил небольшое количество ванны никель Уотта - целых 200 мл, использовав сульфат никеля квалификации "без кобальта" (кобальт в данном случае не мешает, но другого сульфата никеля у меня не было), а также хлорид никеля и борную кислоту "ч.д.а.". Борная кислота была моя, а сульфат никеля - дал коллега, поэтому я использовал минимальное его количество (60 г сульфата никеля, 3 г хлорида никеля и 5 г борной кислоты).
Под рукой не оказалось приличного изделия из черной стали, которое бы не требовало длительной механической чистки. Не оказалось и магнита для проверки (чтобы отличить черную сталь от легированной). Попросил у коллеги. Тот нашел лист, покрашенный с одной стороны и ржавый с другой. Рассердился, но не стал скандалить, а сказал нейтральную фразу и ушел. Продолжил поиски в своей лабе - там и вспомнил о монетах из алюминиевой бронзы. К счастью, одна монета 50 копеек оказалась в кошельке. Пост коллеги с форума (который посоветовал взять медь) тогда еще не прочитал - смотреть форум физически не было времени. Взвешивать монету не стал, поскольку понял, что цвет поверхности все покажет. С монтажом (креплением) пластинок из нержавейки было много проблем (поскольку электролит едкий - соляная кислота ест многое, а потом металлы контактов и креплений будут в электролите). Коллега приспособил титановую проволоку. В этот раз я не стал "заморачиваться" и просто зажал монету "крокодильчиком". Протер монету ацетоном. Потом хотел протравить солянкой - для этой цели взял бутылку кислоты, "аутентичность" которой была под вопросом. Кислота оказалась даже бесцветной, но, когда я ее налил в чистый, казалось бы, стакан, она стала красной. Ничего - для травления подойдет. Когда опустил монету - кислота почти сразу стала желтой (цвет хлоридного комплекса меди). Вынул, помыл, закрепил в стакане с никелевым анодом и никелем Уотта (электролит). Принял, что площадь монеты за 1 см2 (на самом деле - в несколько раз больше) - прикинул силу тока. А как ее выставить? С этим блоком питания я еще не работал (блок принес и регулировал коллега, сейчас я на него был сердитый, поэтому не позвал, хотя и надеялся, что он придет). Выставил 0.1 А (что много), подключил контакты. Все включено, блок работает, время идет, а цвет монеты не меняется: как был желтым, так и остается. Даже дефектное покрытие не образуется. Не работает. Через несколько минут заметил, что я забыл включить один из тумблеров на блоке. Монета стала белеть очень быстро. И, что оказалось для меня сюрпризом, - с обратной стороны тоже. Пытаясь поднять напряжение, поднял и ток. Временами - до 1.5 А (такой ток по ГОСТ полагался для 1 дм2, а не для нескольких см2). Монета затянулась блестящим никелем. Вынул, высушил фильтровальной бумагой. Попробовал стереть пальцем. Блеск уменьшился, но металл не стерся. Пошел подарил коллеге. Он тем временем нашел несколько перспективных железяк, которые притягиваются магнитом. Завтра попробую обезжирить, протравить 10% HCl без уротропина (был, но не помню, где) и опустить в ванну. Кстати, вчера мы пытались делать никель старйк, и у коллеги была та же проблема: он все включил (даже тот тумблер), дисплей блока показывает напряжение и ток, а процесс не идет. Выделения водорода и любых других изменений не происходит. Оказалось, он забыл подключить крокодильчик катода. Еще во время работы произошел интересный случай. Коллега, который помогал с гальваникой, встретил одного химика (того самого, который рассказывал мне, что мелкий цирконий горит на коже и чего невозможно ничем потушить). В этот раз химик рассказал ему, что никакой электролит никелирования кроме сульфаминового не работает, а покрыть никелем нержавейку почти невозможно. Воодушевившись идеей, коллега спросил у меня: - У тебя есть сульфаминовая кислота? Сдержался, но внутри этот рассказ вызвал приступ злости. Даже ярости. Ты же занимался электрохимией и полюбил ее на всю жизнь! Как можно насколько некритически относиться к явной лапше, которую тебе на уши вешают! Сульфаминовый электролит применяют для получения толстых никелевых покрытий [K1], но кроме него есть десятки других составов, которые дают хорошие результаты. Кстати, я работал на заводе, где получали сульфамат никеля для гальваники, даже видел его (вместе с сульфаматом кобальта), но сам эти вещества не делал. Процесс простой: кислота + соответствующий основный карбонат. Используется в виде раствора (твердую соль не выделяют). Немного позже, когда мы уже закончили эксперимент, и статья была почти дописана, этот кадр зашел и ко мне, где случайно увидел фото наших работ на мониторе компьютера. Тоже стал говорить про сульфаматы, но уже не рассказывал, что это единственно возможный или лучший вариант никелирования. Увидев, что я разбираюсь, быстро перевел разговор на электрополирование нержавейки (в котором я НЕ разбираюсь), а затем на патинирование титана (платинированный титан - устойчивый материал анодов для агрессивных сред). |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Anode |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Взял ножницы по металлу и после нескольких минут усилий вырезал новую пластинку. В этот раз тщательно счистил покрытие мелкой наждачкой до блестящего металла, промыл. Обработал пластинку в ультразвуковой ванне с едким натром, вынул. При промывке она стала темнеть. Натер пластинку влажным стиральным порошком (старый, сильнощелочной), еще раз промыл - так удалось устранить потемнение.
Опустил пластинку в ванну, дал невысокий ток, 10 минут выдержки. В процессе пластинка визуально не изменилась. Вынул, промыл, высушил салфетками, взвесил. Масса увеличилась аж на 0.005 г (разница за пределами реальной точности весов). Вынул пластинку, снова обезжирил натиранием со стиральным порошком, поместил в ванну, дал ток раза в 3 выше, чем рекомендовано по ГОСТ. Ни выделение пузырьков газа, ни нагрева электролита я не заметил. Выдержал 34 минуты, взвешиваю - масса НЕ изменилась. В чем дело? Блок питания визуально работает. Пропал где-то контакт? (Это - одна из основных причин проблем с "лабораторной гальваникой"). Смотрю, а я забыл включить тумблер на блоке питания, тот же, что и вчера! (Без этого тумблера визуально все работает, дисплей показывает напряжение и ток, но цепь разомкнута). Включаю тумблер, возвращаю пластинку в ванну. Возможно, и в первый раз я забыл включить тумблер? Процесс я подробно фотографировал и снимал на видео. Смотрю фото - вроде бы в первый раз тумблер был включен, хотя наверняка рассмотреть сложно. Опять даю высокий ток, выдерживаю деталь в ванне полчаса... надежда! Взвешиваю, а прирост массы - нулевой. Беру мультиметр, меряю потенциал между анодом и катодом - он есть (примерно, как на дисплее блока питания), а осаждения никеля - не происходит! Даже дефектное покрытие не садится, не говоря уже о пузырьках газа, которые должны выделяться на электродах. Никель по стали не всегда виден, поэтому решил повторить эксперимент с желтой монетой. На случай подобного я планировал взять с дома желтую (старую) монету 1 гривна, но забыл. В кошельке оказались только 2 монеты 10 копеек (алюминиевая бронза), остальные - серебристые гривны. Монета 10 копеек - маленькая, но для проверки она подойдет. Протер монетку ацетоном для обезжиривания, затем опустил на 20 секунд в концентрированную соляную кислоту. Раствор окрасился в желтый цвет. Промыл моменту, закрепил крокодильчиком и опустил в ванну. Даю напряжение, ток, включаю нужный тумблер - процесс не идет. Поверхность так и осталась желтой, блестящей. Газ не выделялся. Проверяют контакт - везде есть, а процесс не идет. Значит, блок питания. |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Неохотно беру другой блок питания, который мне дала сотрудница, которой эту гальванику изначально и поручили. Подключаю моменту, опускаю в раствор. Блок оказался неважного качества (нельзя было независимо регулировать ток и напряжение, заданное напряжение плохо держалось), но монета стала быстро покрываться блестящим никелем! На радостях увеличил ток. На аноде началось выделение пузырьков хлора - я ощутил характерный запах (видимо, была слишком высокая анодная плотность тока из-за малой площади анода), а на катоде стал выделяться водород - слишком активно. В результате вспомнил, что такое питтинг. В двух местах пузырьки водорода сорвали никелевое покрытие с монеты. В одном месте я удалил отставшее покрытие ногтем - потом этот дефект затянуло никелем. Разумеется, пришлось уменьшить ток.
В очередной раз обезжирил стальную пластину стиральным порошком, поместил в электролит на 10 минут. Дал сначала умеренный ток, затем увеличил. На аноде выделялся хлор, снова ощущался характерный запах, на катоде выделялся водород, но питтинга больше не было (видимо, высокая плотность тока наиболее опасна сначала, когда покрытие еще непрочно держится, а когда покрытие уже закрепилось на стали и растет в толщину, более высокий ток уже не так страшен). Вынул пластинку из ванны, высушил бумагой, взвесил. Прирост массы - 0.06 г! Вид - как блестящая сталь. Средняя толщина, исходя из прироста массы, площади поверхности и плотности никеля - 2 мкм. Значит, скорость осаждения - 12 мкм/ч. Повторно погрузил пластинку в раствор на 30 минут. В этот раз прирост массы составил 0.20 г, что соответствует толщине покрытия 7 мкм и скорости осаждения никеля 14 мкм/ч. |

|

|

|

|

|

|

|

|

|

|

|
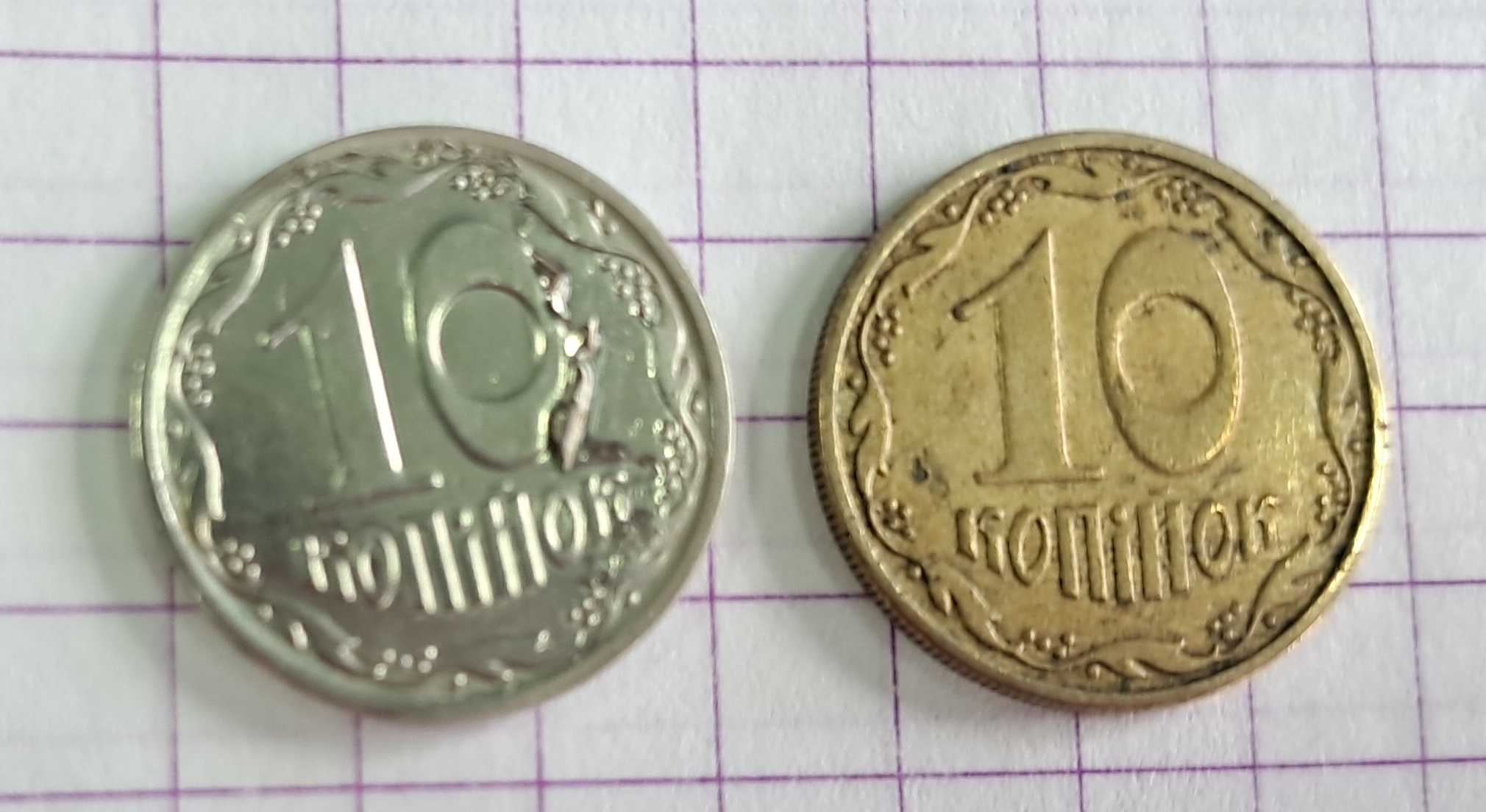
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Комментарии
К1
Скорее "быстрых", а не толстых. Высокая растворимость сульфамата позволяет "загнать" в электролит много никеля и работать на высоких плотностях тока (10+А/дм2). Никель Уотса, даже горячий (60°С), даже с органикой, реалистично вытянет ну 5А/дм2 (с хорошим перемешиванием).
К2 Запах хлора свидетельствует о пассивации анода. Против этого рекомендуют добавку бромида. Сам я не пробовал, в опытах допустимо, но обратно бромид из ванны не вытащишь. |