ОБЩАЯ ХАРАКТЕРИСТИКА ОТРАВЛЯЮЩИХ ВЕЩЕСТВ
КОЖНО-НАРЫВНОГО ДЕЙСТВИЯ
Отравляющие вещества кожно-нарывного действия способны вызвать смертельные отравления людей и животных. Учитывая обеспеченность современных армий надежными средствами индивидуальной и коллективной защиты, зарубежные военные специалисты не ставят целью уничтожение живой силы противника с помощью кожно-нарывных ОВ. Они предназначаются главным образом для временного, хотя и на длительный срок, выведения живой силы из строя. Одновременно решаются задачи по сковыванию боевых действий войск и изнурению живой силы. Первая из них обусловлена способностью кожно-нарывных ОВ заражать на длительное время местность и местные объекты, вооружение и военную технику, объекты тыла и населенные пункты. Вторая достигается высокой кожно-резорбтивной проницаемостью ОВ, обусловливающей необходимость полной защиты тела. Все объекты, зараженные ОВ кожно-нарывного действия, требуют дегазации.
Для применения кожно-нарывных ОВ в иностранных армиях разработаны артиллерийские химические снаряды, химические авиационные бомбы взрывного действия и химические фугасы.
Кожно-нарывным действием обладают представители самых различных классов органических соединений, среди которых наиболее известными являются галоидзамещенные тиоэфиры, третичные амины, первичные арсины, оксимы, кетоны, сложные эфиры сильных кислот. Несмотря на столь разнородный состав, для веществ этой группы характерно одно общее свойство - все они являются алкилирующими или ацилирующими средствами по отношению к соединениям, имеющим атомы со свободными парами электронов.
Так, галоидзамещенные тиоэфиры и третичные амины способны алкилировать нуклеофильные атомы кислорода, азота, серы в различных соединениях с образованием новых элемент углеродных связей — соответственно эфирных С—О, аминных С—N. сульфидных С—S. Кожно-нарывные ОВ алкилирующего действия устойчивы, длительное время сохраняют свои поражающие свойства, признаки поражения ими обычно проявляются после определенного периода скрытого действия.
Ацилирующими свойствами по отношению к нуклеофильным реагентам обладают галоидангидриды некоторых двухосновных кислот, например фосгеноксим и особенно галоидангидриды мышьяковистых кислот. Они ацилируют соединения по атомам кислорода, азота или серы, образуя с ними сложноэфирные, амидные или тиоэфирные связи. Кожно-нарывные ОВ ацилируюшего действия менее стойки, чем алкилаторы, их токсический эффект проявляется быстрее, так как им свойственно еще и прижигающее действие.
Наибольший интерес среди ОВ кожно-нарывного действия представляет вещество НD (иприт). Определенное значение может иметь вещество L (люизит), способное найти применение в качестве компонента тактических смесей. Нельзя полностью исключать возможность использования для заражения источников воды некоторых представителей так называемых азотистых ипритов (агентов НN1, НN2, НNЗ).
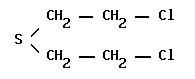
ИПРИТ — 2,2′-дихлорэтиловый тиоэфир
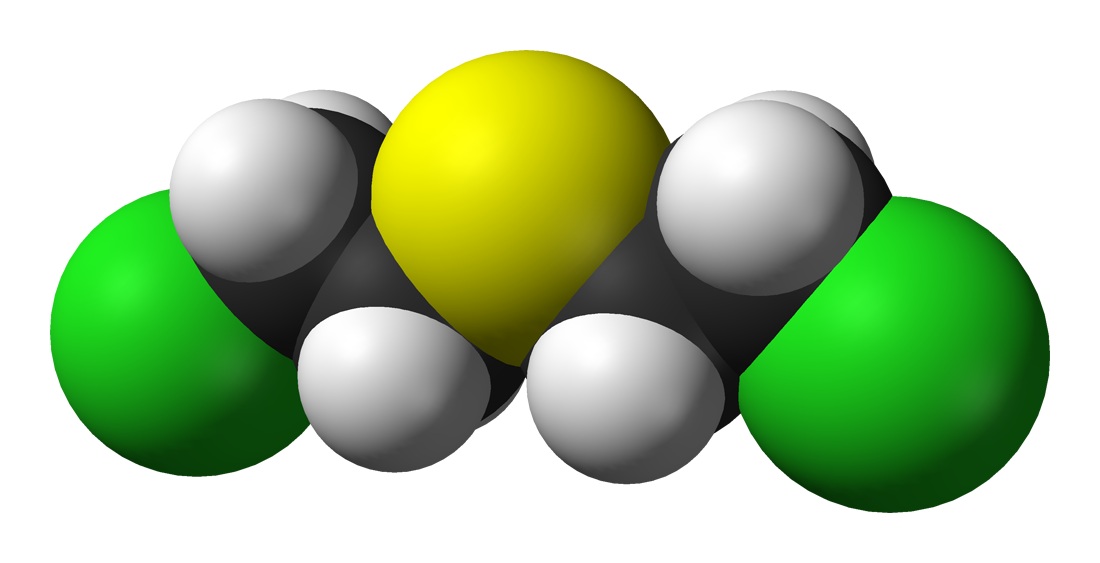
ИПРИТ — 2,2′-дихлорэтиловый тиоэфир
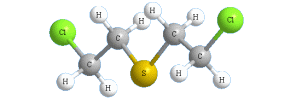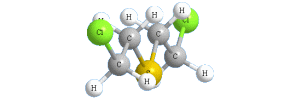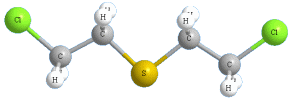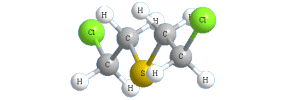 Иприт |
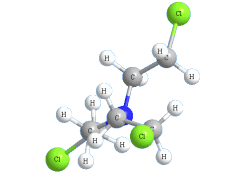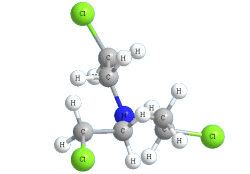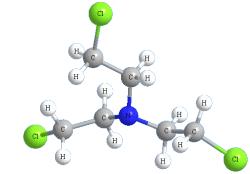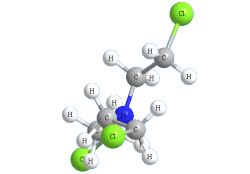 Азотистый иприт (Агент HN3) |
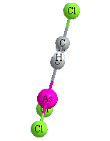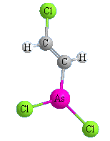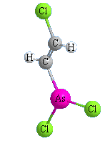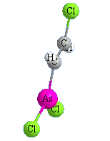 Люизит |
История. Из так называемых OB с желтым крестом бис-2-хлорэтиловый тиоэфир под названием «лост» был впервые применен немецкими войсками в ночь с 12 на 13 июля 1917 г. в ожесточенном сражении за Ипр. Особое значение этого OB заключалось не только в том, чтобы на долгое время сделать пораженных небоеспособными. С этим новым ОВ было принято на вооружение средство поражения, от которого не предохраняли средства защиты органов дыхания от уже известных OB. Из-за особых свойств иприта проникать через обмундирование и обувь и вызывать поражения кожи уже в небольших количествах атакованные были вынуждены защищать от его воздействия все тело.
Химическая стабильность и исключительные физические свойства, которые обеспечивали высокую стойкость иприта, возводили это соединение в ранг мощного оборонительного средства, которое стесненная немецкая армия могла долгое время эффективно противопоставлять наступательным замыслам союзников.
В марте 1918 г. немецкие войска выпустили по частям 3-й английской армии около 250000 ипритных мин. Союзникам удалось применить освоенный промышленностью иприт по рубежам немецкой обороны только в июне 1918 г.
Потери, понесенные от иприта, были больше, чем от других OB. По английским данным, их потери от иприта составили 80% от общего числа отравленных OB; остальные 20% включали пораженных удушающими OB и OB, раздражающими носоглотку.
Полученный в чистом виде Мейером в 1886 г. бис-2-хлорэтиловый тиоэфир еще раньше был синтезирован другими химиками: в 1822 г. во Франции — Дюпре, в 1860 г. в Англии — Гутри и в Германии — Ниманом. Они получали это соединение при действии этилена на моно- или двухлористую серу. Уже Гутри и Ниман установили физиологическую активность этого вещества, хотя они получили его лишь в неочищенном виде. Оба химика отмечали, что действие этой жидкости и ее паров на кожу вызывает образование волдырей. В 1891 г. немецкий окулист Лебер сообщил о проведенных им опытах по исследованию действия иприта на глаза и о возникающих при этом воспалениях.
 Альберт Ниманн (Albert Niemann) (20 мая 1834, Госляр - 19 января 1861, Госляр) Немецкий химик-фармацевт, создатель иприта. В 1849 году Ниманн стал учеником аптекаря в Геттингене.
В 1852 году в возрасте 18 лет он поступил в университет Геттингена на отделение технологии лекарственных форм
философского факультета. В 1858 году он успешно сдал экзамен на фармацевта и стал работать в лаборатории Геттингенского
университета у профессора Ф. Вёлера, который поставил перед молодым исследователем две задачи: провести
химическую реакцию хлорида серы с этиленом, и определить химический состав листьев коки. С обеими задачами Ниманн
блестяще справился. В первом случае он получил горчичный газ (иприт), который использовался в качестве химического
оружия во время Первой мировой войны. В результате первой газовой атаки на реке Ипр было убито 5 тысяч человек, а
15 тысяч остались инвалидами. Проводя эксперименты, Ниманн и сам отравился, так как он ничего не знал о токсических
свойствах горчичного газа и не предпринял никаких мер защиты. Страдая от отравления, он все же успешно провел
исследование листьев коки и в 1860 году выделил в чистом виде алкалоид, которому дал название "кока-ин" (вещество внутри коки).
Специфическое онемение языка после контакта с кокаином Ниманн описал в своей диссертации "О новом органическом основании,
содержащемся в листьях коки". Он был представлен к степени доктора химии, но 19 января 1861 года умер дома в Госларе
от пневмонии в возрасте 26 лет, так и не завершив перспективную научную работу.
|
 Виктор Мейер (Victor Meyer) (8 сентября 1848, Берлин — 18 августа 1897, Гейдельберг)
Изучал химию в Гейдельберге и Берлине. В 1871 году он был приглашен заведовать кафедрой органической химии в университет Штутгарта. С 1872 по 1885 год он работал в Цюрихском политехническом институте. В 1885 году Виктор Мейер работал профессором в Геттингене и, наконец, в 1889 году - в университете Гейдельберга. Виктор Мейер разработал в 1878 году метод по определению молярной массы жидких соединений при помощи аппарата, названного в его честь аппаратом Виктора Мейера. Он также обнаружил органические нитросоединения, открыл в 1882 году новое вещество, которое назвал тиофен и впервые выделил в чистом виде и описал физиологическое действие иприта (горчичный газ, S-Lost). Ввел в обращение термин "стереохимия". Открытая им реакция синтеза нитросоединений получила название в его честь. |
 Фредерик Гутри (Frederick Guthrie) (1833 - 1886) Британский научный писатель и профессор. В 1874 году стал сооснователем Лондонского Физического Сообщества (сейчас Институт Физики)
и был его президентом с 1884 по 1886 год. Гутри был убежден, что наука должна основыватся не на теории, а на экспериментах.
Гутри был первым, кто описал воздействие "горчичного газа" на человека. Независимо от Альберта Нимана, он в 1860 году синтезировал иприт,
используя реакцию этилена и дихлорида серы. Фредерик Гутри был также лингвистом, драматургом и поэтом. Писал под псевдонимом Frederick Cerny.
Его сын Фредерик Бикель Гутри был агрохимиком.
|
Незадолго до первой мировой войны англичанин Кларк, ученик Эмиля Фишера, в химическом институте Берлинского университета изучал некоторые реакции синтезированного им самим бис-2-хлорэтилового тиоэфира.
С тех пор как иприт стал известен в качестве ОВ, он явился предметом научных исследований. Кроме, технологических изменений, методы его получения в принципе изменились несущественно. Описанные Мейером, Гутри и др. методы получили дальнейшее развитие и видоизменение для использования в промышленном масштабе.
С тех пор итальянские фашисты применили иприт при оккупации Эфиопии, а во время второй мировой войны многими воюющими державами были заготовлены большие запасы этого ОВ. Он ни в коей мере не потерял свое военное значение, несмотря на существование более эффективных ОВ. Возможности его применения в бою для обеспечения или затруднения боевых действий, а также для постановки заграждений разнообразны, особенно при помощи современных средств применения.
Иприт считается одним из важных ОВ и принадлежит к табельным ОВ многих армий.
Методы получения. Получить бис-2-хлорэтиловый тиоэфир можно разными способами: хлорированием бис-2-оксиэтилового тиоэфира (тиодигликоля) соответствующими хлорирующими агентами; прямым синтезом из этилена и хлоридов серы; фотохимическим синтезом из хлористого этилена и сероводорода или 2-хлорэтил меркаптана.
Методом получения из тиодигликоля пользовался еще Мейер, который в качестве хлорирующего агента применял треххлористый фосфор:
3S(CH2CH2OH)2 + 2PCl3 → 3S(CH2CH2CI)2 + 2H3PО3
Позже Кларк заменил треххлористый фосфор хлористым водородом
S(CH2CH2OH)2 + 2HCl → S(CH2CH2CI)2 + Н2O
а Штейнкопф и сотр. предложили пользоваться сульфурилхлоридом или тионилхлоридом:
S(CH2CH2OH)2 + SOCI2 → S(CH2CH2Cl)2 + SO2 + H2O
Тиодигликоль получают по аналогии с общим методом синтеза тиоэфиров взаимодействием алкилгалогенидов, в данном случае этиленхлоргидрина, с сульфидом щелочного металла
2СlСН2СН2ОН + Na2S → S(CH2CH2OH)2 + 2NaCl
или из окиси этилена и сероводорода: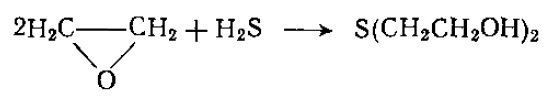
Этиленхлоргидрин получают действием хлорноватистой кислоты на этилен или, с таким же успехом, из окиси этилена и хлористого водорода:
СН2=СН2 + НОСl → СH2OН-СН2Cl
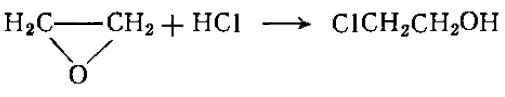
Прямой синтез иприта из этилена и хлоридов серы (развитие экспериментальных исследований Гутри и Нимана) был избран во время первой мировой войны союзниками как самый удобный и быстрый. Они применяли различные смеси как моно-, так и двухлористой серы и получали при этом большое число продуктов, смесь которых они принимали за чистое соединение.
Поуп осуществил синтез иприта - из однохлористои серы и этилена при 70°С и равномерном энергичном перемешивании с применением активированного угля в качестве катализатора:
S2Сl2 + 2СН2=СН2 → S(СН2СН2Сl)2 + S
Промышленные способы получения. В крупном промышленном масштабе производство иприта осуществляется по методам Мейера и Гутри. Возможен промышленный фотохимический синтез, который и был внедрен в ведущих странах по производству ОВ в связи с реорганизацией таких предприятий.
В то время как в Германии и в первую и во вторую мировую войну применяли преимущественно так называемый тиодигликольный (оксольный) процесс (модицифированиый метод Мейера), производство иприта во Франции, Англии, США базировалось на прямом синтезе из этилена и хлоридов серы.
В оксольном процессе для замещения оксигрупп пропускают в тиодигликоль медленный ток сухого хлористого водорода. Реакторы и вся система коммуникаций установки изготовлены из свинца или освинцованы. Тем самым исключается образование солей железа. Процесс хлорирования ведут при 50°С, поддерживая температуру при помощи систем нагревания и охлаждения. После полного поглощения хлористого водорода полученный иприт, обладающий большой плотностью, выводят из реактора и направляют на вакуумную перегонку, где при пониженном давлении отгоняется вода. Иприт очищают перегонкой в вакууме или обработкой органическими растворителями.
По сравнению с прямым синтезом производство иприта тиодигликольным процессом более трудоемко, но приводит к более высоким выходам (95%) продукта при лучшем качестве.
Прямой синтез иприта, применявшийся союзниками, подвергался после первой мировой войны постоянным усовершенствованиям. Процесс состоит из четырех стадий: I) получение двухлористой серы из элементов; 2) приготовление раствора двухлористой серы в четыреххлористом углероде; 3) присоединение двухлористой серы к этилену путем пропускания этилена в раствор, при этом получается разбавленный раствор иприта; 4) отделение иприта от растворителя для повторного его использования в процессе.
Все эти четыре производственные операции можно проводить непрерывно в один прием. Применявшиеся французами реакторы имели высоту 18 м. Изготовлялись они целиком из свинца и были снабжены сложной системой змеевиков охлаждения. У каждой такой гигантской колонны был свой массивный змеевиковый конденсатор из серебра.
Во время пропускания этилена в раствор четыреххлористого углерода температуру реакции поддерживали 60-70°С. Этилен должен быть предварительно тщательно высушен и очищен от спирта. Выход составлял около 80%.
Физические свойства. Чистый бис-2-хлорэтиловый тиоэфир — бесцветная маслянистая жидкость, не обладающая запахом. Технические продукты окрашены примесями в цвета от желтого до темно-коричневого и обладают характерным сладковатым запахом. Ниже температуры застывания (13,5°С) тиоэфир кристаллизуется в виде длинных бесцветных ромбических кристаллов. С помощью прецизионных измерений установлена его температура плавления 14,44-14,45°С; обычно данные колеблются в пределах 14,1-14,5°С. Технический иприт застывает при температуре от 5 до 10°С.
При нагревании до температуры кипения (около 217°С) иприт разлагается с образованием зловонных продуктов, напоминающих по запаху не то горчицу, не то чеснок.
Иприт американского производства, так называмый НD, имеет т. кип. 228°С, т. пл. 14°С.
Иприт тяжелее воды (d20 1,2741). Вследствие некоторой поверхностной активности он уменьшает поверхностное натяжение воды и в небольшой мере растекается по ней тонким слоем, как пленка масла. Добавлением более поверхностно-активных веществ, которые растворяются в иприте, эффективное растекание можно увеличить. Давление пара бис-2-хлорэтилового тиоэфира довольно мало (0,1 мм. рт. ст. при 20°С).
Хотя с возрастанием температуры воздуха стойкость иприта уменьшается, но за счет его испарения воздух обогащается парами иприта. В жаркие безветренные дни создается концентрация, почти в 50 раз превышающая обычно необходимую токсическую концентрацию. Даже при скорости ветра 2 м/сек и плотности заражения порядка 5 г/м2 на открытой местности пары иприта еще эффективны в течение 3-4 ч.
При температуре ниже 15°С, особенно на покрытой растительностью или очень лесистой местности, зараженность держится более недели. Ниже 4°С при скорости ветра свыше 8 м/сек пары иприта в воздухе уже не эффективны.
Чтобы повысить стойкость иприта и, тем самым, его эффективность, вносят добавки, которые повышают его вязкость (так называемые вязкие рецептуры). Эти добавки гарантируют не только большую продолжительность действия, но и затрудняют дегазацию, которая в этом случае вряд ли осуществима водными дегазирующими растворами. Повышение вязкости одновременно подавляет образование аэрозоля и способствует образованию капелек большего размера (а не дыма) при поливке с самолетов.
Растворимость бис-2-хлорэтилового тиоэфира в воде мала, примерно 0,8 г/л. В органических растворителях — галогеналканах, бензоле, хлорбензоле — он растворяется столь же хорошо, как и в растительных или животных жирах. В то время как растворимость ОВ в абсолютном этаноле выше 16°С составляет почти 100%, в 92%-ном этаноле она достигает едва 25%. С такими растворителями, как нефть и дизельное топливо, он смешивается ограниченно, имеются области несмешиваемости. При низкой температуре для растворения иприта можно использовать только низкокипящие фракции, например легкий бензин и петролейный эфир, которые являются превосходными средствами для экстракции иприта.
Вследствие своей высокой диффузионной способности иприт быстро проникает через ряд веществ и материалов. Так, жидкий иприт быстро просачивается через ткани, кожу, картон, бумагу и тонкую резину. Он быстро впитывается в пористые неоднородные материалы, такие, как кирпич, бетон, необработанная древесина и старые потрескавшиеся масляные покрытия.
Химические свойства. При обычной температуре бис-2-хлорэтиловый тиоэфир представляет собой устойчивое соединение. При нагревании выше 170°С он разлагается с образованием неприятно пахнущих ядовитых продуктов различного состава. Выше 500°С происходит полное термическое разложение. Кратковременное нагревание даже выше 300°С почти не приводит к образованию продуктов разложения, поэтому иприт считается относительно устойчивым к детонации.
По отношению к металлам при обычной температуре иприт инертен. Загрязненный продукт, содержащий обычно воду и хлористый водород, вызывает коррозию стали. Образующиеся соли железа способствуют коррозии. Из-за выделяющихся газов — водорода, сероводорода, этилена н других продуктов разложения — следует считаться с повышением давления в закрытых емкостях, минах, бомбах и контейнерах для перевозки.
Гидролиз. В водных растворах бис-2-хлорэтиловый тиоэфир гидролизуется с замещением атомов хлора на гидроксильные группы. В присутствии избытка соляной кислоты реакция обратима. Обычно она идет с образованием неядовитого тиодигликоля:
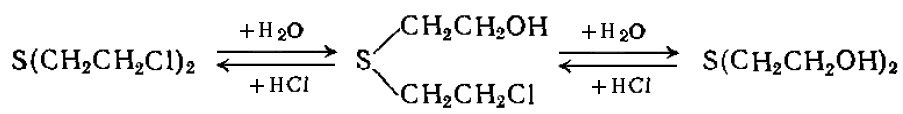
Воду, содержащую небольшие количества (~ I%) иприта, можно дегазировать кипячением в течение 15 мин. При температуре ниже 0°С гидролиз продолжается несколько суток. Более сильно зараженную воду приходится подвергать обычным приемам дегазации и очистки.
Вследствие гидролиза концентрация иприта в воздухе через сутки уменьшается почти на порядок.
Из-за малой растворимости бис-2-хлорэтилового тиоэфира, в зависимости от присутствующего его количества, вода заражается на длительный срок, поскольку взамен гидролизованного иприта в воду все время постепенно диффундируют новые порции иприта. Опыты показывают, что находящееся под водой ОВ остается эффективным годами, если совсем или почти отсутствует перемешивание.
Так как ОВ практически нерастворимо в воде, гидролиз может протекать только на самой границе раздела фаз. Для быстрого гидролиза обязательно требуется энергичное перемешивание. Если же перемешивание недостаточно, то, особенно при применении технических сортов иприта, из-за содержащихся в нем загрязнений и примесей в результате побочных реакций образуется третья фаза, в которой иприт мало растворим и которая защищает и «консервирует» его от дальнейшего гидролиза.
Из всего сказанного выше ясно, что для достижения полноты гидролиза требуются большой избыток воды и энергичное перемешивание либо нагревание, а еще лучше, если действуют все три фактора.
Для того чтобы вывести гидролиз за поверхность раздела фаз гетерогенной системы, нужно гомогенизировать смеси, скажем, добавкой растворителей, которые могут смешиваться и с водой, и с ипритом (метанол и др.). Такими добавками пользуются, в частности, при употреблении водных дегазирующих растворов.
Скорость гидролиза бис-2-хлорэтилового тиоэфира зависит от концентрации ионов водорода — способствует ему щелочная среда, а кислая — препятствует и замедляет гидролиз.
Реакция бис-2-хлорэтилового тиоэфира с аммиаком даже при температуре выше 150°С идет очень медленно. Однако под давлением уже при 60°С образуется 1,4-тиазан — бесцветная, дымящаяся на воздухе жидкость:
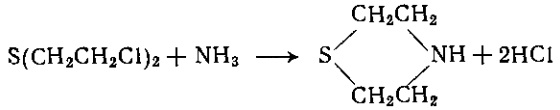
С первичными аминами в спиртовых растворах при обычных условиях происходит аналогичная циклизация тиоэфира.
Окисление. Как типичный представитель тиоэфиров, иприт можно легко окислить в сульфоксид или в сульфон согласно уравнению:
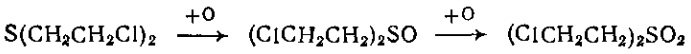
В качестве окислителей пригодны перекись водорода, азотная кислота, перманганат калия, хромовая кислота, хлорная известь, гипохлориты и др.
Хотя продукты окисления иприта — сульфоксид и бис-(2-хлорэтил)-сульфон — сильно ядовитые соединения, а сульфоксид обладает даже кожно-нарывным действием, окисление иприта является одной из важных реакций дегазации. Продукты окисления представляют собой твердые кристаллические вещества, и поэтому они не обладают кожно-резорбтивными свойствами.
При действии сильных окислителей или при окислении в более жестких условиях реакция идет дальше образования сульфоксида и сульфона и завершается полным разложением тиоэфира.
Бис-2-хлорэтиловый тиоэфир окисляется при 150°С избытком концентрированной НNO3 в сульфоксид. Реакция быстрая и экзотермическая. Она может идти и дальше — с выделением двуокиси азота и образованием в конечном счете сульфона:
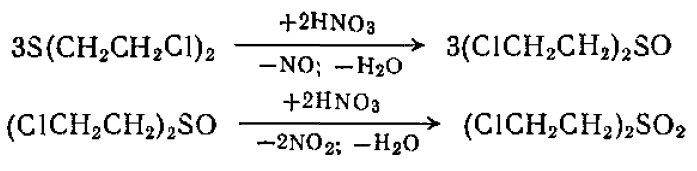
При действии дымящей азотной кислоты и нагревании образуется, например, 2-хлорэтансульфокислота СlСН2СН2SO2ОН.
Для получения бис-(2-хлорэтил)-сульфоксида бис-2-хлорэтиловый тиоэфир прибавляют по каплям при 20°С к концентрированной НNО3. Если смесь разбавить водой, то сульфоксид выпадает в виде белого осадка, который перекристаллизовывают из 60%-ного этанола (бесцветные чешуйки, т. пл. 110°С).
При действии на иприт хромовым ангидридом в уксусной кислоте при 100°С (20 мин нагревания) образуется чистый бис-(2-хлорэтил)-сульфон, т. пл. 55-56°С.
Сухая хлорная известь преимущественно окисляет иприт, но одновременно происходит и хлорирование. При определенных условиях эта быстрая экзотермическая реакция сопровождается воспламенением непрореагировавшего тиоэфира. В качестве продуктов реакции были идентифицированы — хлористый водород, двуокись углерода, двуокись серы, галогеналканы (например, дихлорэтан, хлороформ), хлораль, хлориды серы и др. При использовании кашицы хлорной извести реакция идет спокойнее с образованием в основном сульфоксида и сульфона.
Гипохлориты в водных растворах частично окисляют, частично хлорируют бис-2-хлорэтиловый тиоэфир.
Хлорирование. При действии хлора и, отчасти, других хлорирующих агентов, например дихлорамина и сульфурилхлорида, получают различные хлорированные тиоэфиры и сульфоксиды. Ниже приведены формулы соединений, получающихся при хлорировании иприта:
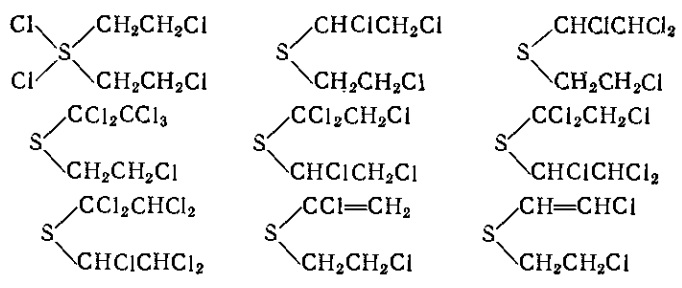
Все они, кроме первого соединения, являющегося твердым веществом (белые неустойчивые иглы), представляют собой жидкости. В зависимости от числа атомов хлора и от их положения в молекуле эти продукты хлорирования обладают лишь слабой, либо вовсе не обладают физиологической активностью.
Реакции с хлораминами. Моно- и дихлорамины легко реагируют с бис-2-хлорэтиловым тиоэфиром. Дихлорамин имеет то преимущество перед монохлорамином, что реакция, идет в гомогенной среде, так как дихлорамин сравнительно легко растворим в органических растворителях. Продукты реакции неядовиты.
Реакция с гексаметилентетрамином. Одной из реакций, важных для дегазации кожи, является предложенное Брюэром и Бушеро воздействие гексаметилентетрамином на гидролиз иприта. Выделяющийся при гидролизе хлористый водород реагирует с гексаметилентетрамином с образованием формальдегида, который, благодаря своему дубящему действию, содействует локализации и лучшему заживлению ипритных поражений на коже. Применение гексаметилентетрамина в качестве стабилизатора этого ОВ объясняется аналогичной реакцией.
Реакция выражается следующим уравнением:
2S(СН2СН2Сl)2 + 10Н2О + (СН2)6N4 → 2S(СН2СН2ОН)2 + 4NН4Сl + 6НСНО
Реакции с солями металлов. Подобно незамещенным тиоэфирам, иприт обладает способностью образовывать аддукты с солями металлов, так называемые соли сульфония. Образующиеся комплексы иногда трудно растворимы в воде и имеют характерную окраску, вследствие чего они нашли применение в качественном и количественном анализе.
Чаще всего используют галогениды тяжелых металлов — иодид и хлорид ртути, хлориды меди, цинка, титана, платины, палладия и золота.
С хлорным золотом бис-2-хлорэтиловый тиоэфир образует комплексное соединение:
S(СН2СН2Сl)2 + АuСl3 → [Сl2АuS+(СН2СН2Сl)2]Сl-
Токсические свойства. Иприт действует как контактный и ингаляционный яд; пары и капли иприта поражают глаза. Как уже упоминалось, вследствие высокой растворимости иприта в липидах или его резорбции во все органы наступают интоксикации общего характера, которые являются причиной его общеядовитого действия.
Способность иприта проникать через кожу зависит от температуры. Скорость резорбции пропорциональна повышению температуры: при 21-23°С она составляет около 1,4·10-3 мг/см2·мин, при более высокой температуре — около 2,7·10-3 мг/см2·мин. Во время этого опыта, проводившегося на предплечье, относительная влажность насыщенного парами иприта воздуха составляла около 46%. Количества ОВ порядка 6·10-3 мг, проникавшие через кожу, в 50% случаев вызывали образование волдырей.
В 100% случаев образование эритем наступает при дозе иприта 0,01 мг/см2 поверхности кожи, маленькие пузыри образуются при 0,1-0,15 мг/см2, большие — при 0,5 мг/см2.
Глаза поражаются малыми количествами ОВ. Так, концентрация 1,2·10-3 мг/л после 45 мин экспозиции вызывает светобоязнь, спазм век и воспаление конъюнктивы, длящееся до 4 недель. Выздоровление наступает через 3 месяца. Более высокие концентрации при меньшей экспозиции приводят к опасным поражениям глаз.
При времени экспозиции 2-5 мин концентрация 0,03 мг/л смертельна, концентрации уже в 0,01 мг/л при воздействии 15 мин очень опасны, они ведут к поражениям кожи и к сильным воспалениям слизистой оболочки глаз.
При подкожной инъекции летальной дозой является 40-60 мг/кг массы.
Использованная литература