
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2015 Журнал Химиков-Энтузиастов |
Получение металлического калия в домашних условиях (обновленная версия, предыдущую версию см. № 3 2011 [ссылка]) Козьма Прутков |
Калий, являющийся одним из самых активных металлов, это желанная мечта многих начинающих химиков. Реакция калия с водой - один из самых красивых и в тоже время простых химических опытов. Несмотря на доступные фото и видео экспериментов, ничто не заменит непосредственного созерцания синеватых кусочков калия и опытов с ним. Сейчас вряд ли найдется много желающих получить щелочные металлы в домашних условиях, не говоря уже об одобрении и помощи со стороны учителей. Хотя при желании можно было сделать даже коллекционные образцы. На фото Вы видите полученный в ходе эксперимента калий (примерно 4 грамма) в вазелиновом масле.
|

|
|
Позволим себе несколько слов об опасности калия. Это, однако, не означает, что не стоит браться за опыты, просто соблюдайте ТБ и уважительно относитесь к этому агрессивному металлу. Главное беречь глаза и работать в защитных очках! При взаимодействии с водой или многими другими веществами реакция идёт обычно очень бурно, со "взрывом". Поэтому берут небольшие кусочки, не больше горошины, а в случае бОльших кусочков необходимо предпринимать меры защиты от разлетающихся горящих капель металла и щелочи. Как правило, всегда образуются разлетающиеся едкие брызги и аэрозоль! Калий и другие щелочные металлы берут пинцетом. Помните о пожароопасных свойствах металла. Об опытах же и его свойствах исчерпывающе сказано на форуме в теме "щёлочные металлы" и видеоархиве журнала.
Ещё в годы учёбы в университете нам попадалась интересная книга - А.И. Беляев - Николай Николаевич Бекетов - выдающийся русский физико-химик и металлург [ссылка]. Вот выдержка из докторской диссертации Н.Н. Бекетова (1865), приведённая в книге: "Если глиний (так раньше называли алюминий) восстановляет барий из окиси, то можно было ожидать и подобного действия его на окись калия: я произвел опыт в изогнутом ружейном стволе, в закрытый конец которого были положены куски едкого кали и глиния; при довольно высокой температуре показались пары калия, большая часть которых сгущалась в холодной части ствола, из которой я добыл несколько кусочков мягкого металла, плавающего на воде и горящего фиолетовым пламенем, имеющего, одним словом, все характерные свойства чистого металлического калия. В большом виде я этого опыта не повторял, а может быть он окажется удобным для практики, так как цена глиния невысока, а восстановление идет, по-видимому, гораздо легче и при низшей температуре, чем восстановление калия железом". Это очень нас заинтересовало, т.к. другие химические способы восстановления требуют более высокой температуры, по описаниям "белокалильного жара" или температуры порядка 1100°С, трудно достижимой в быту; в некоторых случаях образуются реагирующие с калием вещества (например угарный газ), а электролиз расплава едкого кали хотя и возможен, но, намного более трудоёмок (о электролитическом лабораторном способе получения калия см. книгу Lerner L. Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling [ссылка]). Применив подобный способ к гидроксиду рубидия с помощью простейшего прибора Бекетов, добился довольно высокого выхода металла. "3 (15) марта 1888 года на заседании Отделения химии Русского физико-химического общества в Петербурге Н.Н. Бекетов сообщил, что ему удалось получить металлический рубидий восстановлением гидрата окиси рубидия металлическим алюминием. По этому поводу Н.Н. Бекетов сказал: "Редкость материала и невозможность приобрести путем покупки сколько-нибудь значительное количество металла заставили меня искать более удобного способа получения рубидия из его соединений, так как способ, употребленный Бунзеном (прокаливание с сажею кислого виннокислого рубидия), дал ему 18% заключенного в соли металла, не говоря уже о других неудобствах этого способа. С этой целью я применил к рубидию способ, к которому я пришел по чисто теоретическим соображениям много лет тому назад (1859), а именно действие алюминия на гидрат. Способ этот был уже много изучен по отношению к едкому кали; оказалось, что при действии алюминия можно выделить максимум около половины металла, но всегда несколько менее, так как, по-видимому, половина окиси остается в соединении с окисью алюминия... По моим соображениям рубидий должен был также легко выделяться алюминием; это оправдалось на деле, и я уже несколько раз приготовлял, таким образом, сравнительно большие количества металла - от 31 до 27 г за раз. Реакция производится в железном цилиндре с железной же газопроводною трубкою, которая соединена со стеклянным резервуаром. Цилиндр в стоячем положении нагревался в газовой печи до ярко-красного каления; реакция идет сначала быстро с большим отделением газа (водорода, образующегося по реакции. - А.Б.), но затем замедляется и рубидий гонится постепенно, стекая, как ртуть, и сохраняя даже свой металлический блеск вследствие того, что весь снаряд во время операции наполнен водородом. Приведенное количество металла получалось в 3/4 часа, если не был взят избыток алюминия, который вероятно дает с рубидием сплав, почему последние части щелочного металла перегоняются с трудом". Сначала поговорим о необходимых реактивах. Нам потребуются алюминий и едкое кали. С алюминием нет никаких проблем, проще всего взять пищевую фольгу. С гидроксидом калия дело несколько сложнее. Это вещество в быту, подобно едкому натру, не применяется, но его довольно легко купить. Нужно либо попросить его в учебном заведении (в школе, скорее всего, не дадут) или купить. Помимо магазинов химреактивов он продаётся в некоторых радиотехнических магазинах. В любом случае покупка стоящая и он пригодится и для других экспериментов. Едкое кали оправдывает своё название исключительно сильным разъедающим действием на кожу, более сильным, чем действие кислот. Очень опасно попадание даже малейших крупинок в глаза. Это приводит, по крайней мере, к тяжёлому повреждению зрения или полной слепоте. Работать с ним нужно обязательно в защитных очках! Рекомендуются резиновые перчатки. На открытом воздухе оно должно находиться минимальное время, из-за сильной гигроскопичности. Вот ещё одна ложка дёгтя - реактив выпускают не в виде безводного вещества, а в виде смеси, содержащей гидрат. Если Вы её нагреете с алюминием, она расплавится в кристаллизационной воде и прореагирует с алюминием, подобно водному раствору. Калий, понятное дело, не получится. Вот что написано в ГОСТе, описывающем качество реактива. |

ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия |

Едкое кали (Гидроксид калия) |
|
Как видно из таблицы, в лучшем случае, калиевая щёлочь содержит 13% воды! Нам понадобится безводный препарат. Нужно прокалить едкое кали в дешевой чашке/кружке из нержавеющей стали (их без труда можно приобрести в магазине) [K1]. Учитывайте, при испарении воды во все стороны разлетаются брызги щёлочи! Выпаривать нужно в вытяжном шкафу или просто на открытом воздухе, предусмотрев меры предосторожности. Вначале чешуйки плавятся, раствор кипит, постепенно кипение прекращается и образуется расплав со спокойной поверхностью. Температура плавления гидроксида калия - 380°С.
В нашем случае удобно греть газовой горелкой. Бекетов использовал изогнутую железную трубку (ружейный ствол). Реакция идет при нагреве до красного каления и вначале сопровождается заметным разогревом. 2KOH + Al = KAlO2 + K + H2 При этом выделяется водород с примесью паров калия. Вследствие этого он самовоспламеняется, пламя "окрашено" в фиолетовый цвет. Внимание! Образуется едкий аэрозоль! Делать под тягой или на воздухе! Рассчитывать стоит примерно на 30% выход, далее реакция замедляется, и греть после прекращения горения водорода нецелесообразно, проще потом еще раз повторить реакцию. Как известно в XIX веке калий получали полукустарным способом, нагревая поташ с углём и мелом. При этом использовался приёмник Донни и Мареска, позволяющий быстро охлаждать пары металла и не допускать окисления. Вот иллюстрация из словаря Брокгауза и Ефрона. В самодувном горне нагревается до белого каления железный сосуд с реакционной смесью. Пары металла быстро охлаждаются, конденсируются, и образующийся угарный газ защищает его от окисления. Хотя возможная и реакция между калиев и угарным газом, если приемник недостаточно охлажден. Мы используем похожее устройство для сбора и конденсации. |
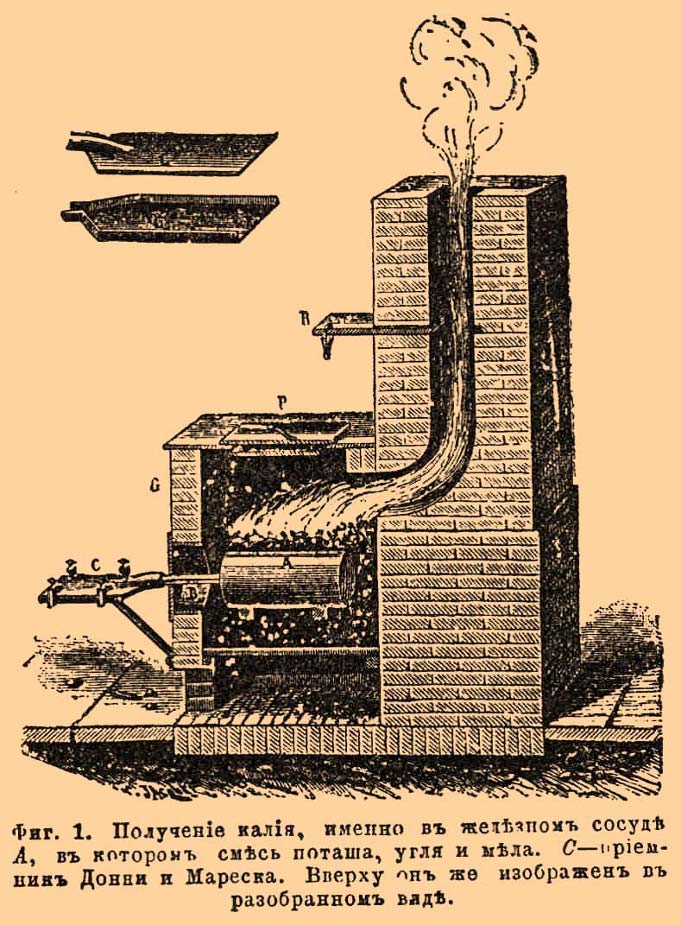
Получение калия (иллюстрация из энциклопедического словаря Брокгауза и Ефрона) |
|
Теперь поговорим о проведении опыта.
Как основу берем пустой тонкий железный аэрозольный баллончик. Вскрываем, прокаливаем горелкой до сгорания краски, и потом, ударяя по деревянной ручке (или палке) выправляем дно. |

|
|
Еще нам понадобится холодильник - делаем его из 8-граммового углекислотного баллончика - вначале пробиваем, насаживая на гвоздь, потом срезаем дно и удаляем алюминий (для этого можно раскалить баллончик, - алюминий выльется; можно рассверлить). Плотно "вкручиваем" в сантехнический чугунный уголок (на 12).
Еще понадобится вырезать по диаметру уголка кружок из жести. Пробиваем в нем небольшое отверстие. При сборке обернем его плотно фольгой, разумеется, освободив отверстие. |

|
|
Широкая банка (например, из-под ананасов) будет штативом. И также отчасти концентрировать пламя. В ней необходимо сделать прорезь для наблюдения, отверстие под баллончик (по размеру) и отверстие вверху (сантиметра 3-4 в диаметре) для выхода газов пламени.
|

|
|
Для реакции понадобится алюминий (10 г). Удобно взять фольгу, плотно свернув её в тугую "веревочку" и потом разрезав ножницами на кусочки.
|

|
|
Еще понадобится мягкая железная проволока (для крепления реактора к банке) и металлическая губка для посуды (послужит механическим фильтром).
Ну и, разумеется, едкое кали - его нужно 42 г - по объему примерно 50 мл чешуек. Его необходимо обезводить, как уже говорилось выше. Разумеется, нужны очки и определенная осторожность - при обезвоживании едкое кали вначале плавится в своей кристаллизационной воде, затем расплав кипит. После того как оно успокоится, став неподвижным, и вы заметите нагрев до красна стенок, выливаем его в баллончик-реактор с заранее насыпанным алюминием, охлаждаем погружая в воду или касаясь снега и сразу заталкиваем губку-фильтр (губка должна быть без полимерной основы). После этого держась за верх, пассатижами плотно заворачиваем края баллончика, на манер тюбика. Понадобятся х/б перчатки. Теперь вставим кусок проволоки в завернутый край. Самая ответственная часть - пробить в верхней части отверстие под горло баллончика-холодильника. Немного выправляем постукиванием деревяшкой, прокалываем ножницами и аккуратно расширяем носом напильника. |

|
|
Главное не переборщить, сделать ровное отверстие чуть меньше - горло должно вставиться на трении. Лучше сразу вставить холодильник в реактор "через" банку-штатив, так будет более герметично - чем вынимать и вставлять второй раз. Пары калия, конечно, все равно будут выходить, но часть их пойдет в нужном направлении. Крепим проволоку за верх банки, устанавливаем немного наклонно холодильник, наворачиваем на уголок ленту из влажной ваты (ее придется потихоньку поливать во время нагрева).
Можно придумать какой-нибудь простой штатив, скажем, использовать кирпичи, нам подвернулся старый ящик. Греем большой корейской горелкой, бутановый баллончик при этом охлаждается и пламя уменьшается, поэтому удобно погрузить его в кружку с теплой водой. Вот как выглядит процесс нагрева. Через некоторое время вы увидите горение водорода с парами калия. Не забываем периодически поливать вату. |

|

|
|
После прекращения горения водорода, греем еще пару минут. После прекращения нагрева обернем фольгой отверстие холодильника.
Теперь надо извлечь калий. Как только "аппарат" остыл (работаем в очках, это обязательно! и резиновых перчатках) отсоединяем холодильник, на горлышко углекислотного баллончика можно сразу навернуть фольгу. Как оказалось внутри уголка калия совсем мало - брызги-капельки и этим можно пренебречь. Основная часть внутри баллончика - он заполнен компактным калием с центральным каналом-пустотой. Извлекать его механически очень неудобно. Пробовали применить кусочки жести-шпатели (поэтому часть калия оказалась в виде неровных обрезков). Разумеется, сразу же поливаем баллончик вазелиновым маслом. Вазелиновое масло лучше заранее обезводить. Проще всего хорошо его прогреть. Правильный подход - выплавить калий (с дополнительной фильтрацией) - поместить баллончик (разумеется, освободив его от чугунного уголка и фольги, узким горлом вверх) в химический стакан с сухим вазелиновым маслом и осторожно нагреть до плавления калия. Щипцами вынимаем баллончик, калий выливается в масло. Из чистого медицинского шприца сделаем фильтр-пресс. Для этого вначале подберем красивый стеклянный пузырек с плотной крышкой. На 10 мл шприц туго надеваем короткую трубочку, в неё заталкиваем плотный комочек из спутанной тонкой проволоки, чем тоньше, тем лучше (мы взяли медную). Наклоняем стакан и засасываем шприцем с фильтром, вначале идет чистый серебристый металл, потом эмульсия из серебристых капелек. В конце отсасывания остается металл с большим количеством примесей, его оставим на потом. Шприц охлаждаем в вертикальном положении, в стаканчике со слоем вазелинового масла, чтобы носик был погружен. Потом выдавливаем масло и спрессовываем капли. |

|

|
|
Получается блестящий слиток. Можно его еще раз нагреть в шприце (например, феном) и взболтать.
После охлаждения, быстро срезаем верх шприца, погружаем отрезанную часть в заранее подготовленный пузырек с осушенным маслом и выдавливаем слиток. Вот что получилось в итоге. Основной слиток, объемом где то в 4.5 мл + три капли, которые жалко было выбросить. |

|
|
Однако из остатков можно извлечь еще немного чистого калия. Делаем еще шприц, в носик вставляем спутанную проволоку, и чтобы не выскочила потом, берем с избытком и придавливаем поршнем. Наливаем масла в шприц и бросаем остатки калия, прессуем.
|

|
|
Нагреваем в вазелиновом масле, как только расплавится, продавливаем - получаются серебристые капли - крупные можно взять для коллекции, мелкие побросать в воду.
|

|
|
Комментарии
К1
Вполне возможно использовать сосуд из обычной стали. Небольшая примесь продуктов коррозии железа не мешает последующей реакции восстановления. Кстати, нержавеющие стали также корродируют под действием расплава щелочи - в присутствии кислорода расплав загрязняется хроматом.
|