

Калий фото И.Н. Григорьев
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2011 |
|
Получение металлического калия в домашних условиях И.Н. Григорьев |
|
(Обновленную версию статьи см. № 2 2015 [ссылка])
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
|
|
|
Калий. Это действительно исключительный элемент. Металл, который при соприкосновении с водой разлагает ее, а образовавшийся водород воспламеняется. Наверняка удивительное зрелище, - эти мысли не давали Фридриху (Велеру) покоя. Он решил, во что бы то ни стало получить металл. Калоян Манолов Великие Химики |
|
Калий - один из самых активных металлов, желанная мечта многих начинающих химиков. Реакция калия с водой - очень красивый и одновременно простой химический эксперимент. В наши дни фотографии и видео опытов с калием общедоступны, но ничто не заменит непосредственного созерцания синеватых кусочков калия и опытов с ним.
Отсутствие простого метода получения калия, доступного школьнику, неослабевающий интерес посетителей химических форумов к этой теме, а также несправедливое запрещение работы с калием в школе навело на мысль разработать доступную всем методику получения калия. Вначале скажу несколько слов об опасности калия, несмотря на то что это всем известно. Работа с калием связана с повышенным риском. Это, однако, не означает, что не стоит браться за опыты, просто соблюдайте ТБ и уважительно относитесь к этому прекрасному, но агрессивному металлу. Главное беречь глаза и работать в защитных очках! Реакция калия с водой и рядом других веществ идет очень бурно, со "взрывом". Образуется едкий аэрозоль, во все стороны разлетающиеся опасные брызги! Калий и другие щелочные металлы берут пинцетом. Помните о пожароопасных свойствах металла. |

|

|
|
Калий фото И.Н. Григорьев | |
|
Много полезной информации про калий и другие щелочные металлы (а также об экспериментах с ними) можно найти на форуме в теме Щелочные металлы <ссылка> и в видеоархиве журнала. Единственное, что хотелось бы добавить - металл может получаться с загрязненной поверхностью. Многим опытам это не мешает, однако желательно срезать корочку, обнажив чистую поверхность металла. Делать это лучше под слоем керосина. Например, если перед реакцией калия с водой не очистить поверхность металла, после реакции в воде остается нерастворимая взвесь. На фото показан один из первых опытов с загрязненным металлом, который был получен в первых пробных экспериментах. В дальнейшем установка была усовершенствована, что позволило получить более чистый калий, после реакции с которым вода оставалась прозрачной. |

|

|
|
Реакция калия с водой | |
|
Еще в годы учебы в университете мне попадалась интересная книга А.И. Беляев Николай Николаевич Бекетов - выдающийся русский физико-химик и металлург 1827-1911 <ссылка>. Вот выдержка из докторской диссертации Н.Н. Бекетова (1865), приведенная в книге: |
|
"Если глиний (так раньше называли алюминий) восстановляет барий из окиси, то можно было ожидать и подобного действия его на окись калия: я произвел опыт в изогнутом ружейном стволе, в закрытый конец которого были положены куски едкого кали и глиния; при довольно высокой температуре показались пары калия, большая часть которых сгущалась в холодной части ствола, из которой я добыл несколько кусочков мягкого металла, плавающего на воде и горящего фиолетовым пламенем, имеющего, одним словом, все характерные свойства чистого металлического калия. В большом виде я этого опыта не повторял, а может быть он окажется удобным для практики, так как цена глиния невысока, а восстановление идет, по-видимому, гораздо легче и при низшей температуре, чем восстановление калия железом". |
|
Это очень меня заинтересовало, поскольку другие химические способы восстановления требуют более сильного нагрева (по разным описаниям "белокалильного жара" или температуры порядка 1100 °С, что трудно достичь в домашних условиях). Электролиз расплава едкого кали возможен, но довольно трудоемок (о электролизе едкого кали и недостатках этого метода подробно написано в монографии
Алабышев А.Ф., Грачев К.Я., Зарецкий С.А., Лантратов М.Ф. Натрий и калий (получение, свойства и применение) [1959] <ссылка>).
Применив подобный способ к гидроксиду рубидия с помощью простейшего прибора, Бекетов добился довольно высокого выхода металла. |
|
"3 (15) марта 1888 года на заседании Отделения химии Русского физико-химического общества в Петербурге Н.Н. Бекетов сообщил, что ему удалось получить металлический рубидий восстановлением гидрата окиси рубидия металлическим алюминием. По этому поводу Н.Н. Бекетов сказал: "Редкость материала и невозможность приобрести путем покупки сколько-нибудь значительное количество металла заставили меня искать более удобного способа получения рубидия из его соединений, так как способ, употребленный Бунзеном (прокаливание с сажею кислого виннокислого рубидия), дал ему 18% заключенного в соли металла, не говоря уже о других неудобствах этого способа. С этой целью я применил к рубидию способ, к которому я пришел по чисто теоретическим соображениям много лет тому назад (1859), а именно действие алюминия на гидрат. Способ этот был уже много изучен по отношению к едкому кали; оказалось, что при действии алюминия можно выделить максимум около половины металла, но всегда несколько менее, так как, по-видимому, половина окиси остается в соединении с окисью алюминия... По моим соображениям рубидий должен был также легко выделяться алюминием; это оправдалось на деле, и я уже несколько раз приготовлял таким образом сравнительно большие количества металла - от 31 до 27 г за раз. Реакция производится в железном цилиндре с железной же газопроводною трубкою, которая соединена со стеклянным резервуаром. Цилиндр в стоячем положении нагревался в газовой печи до ярко-красного каления; реакция идет сначала быстро с большим отделением газа (водорода, образующегося по реакции. - А. Б.), но затем замедляется и рубидий гонится постепенно, стекая, как ртуть, и сохраняя даже свой металлический блеск вследствие того, что весь снаряд во время операции наполнен водородом. Приведенное количество металла получалось в 3/4 часа, если не был взят избыток алюминия, который вероятно дает с рубидием сплав, почему последние части щелочного металла перегоняются с трудом". |
|
В первом опыте я нагрел газовой горелкой сифонный баллончик с газоотводной трубкой из жести, соединенной со стеклянным приемником. Внутри было 5.0 г гидроксида калия и 1.2 г кусочков алюминия. При нагревании до оранжево-желтого каления внезапно появилось фиолетовое пламя. Горел выделяющийся водород с примесью паров калия. После охлаждения я заглянул внутрь трубки. Просвет был заметно уже. Тогда я бросил ее в банку с водой. Раздался хлопок и из трубки вылетел небольшой фонтан пламени. Это означало, что калий получить удалось, но он конденсируется внутри трубки, не стекая в сосуд-приемник. В дальнейших опытах были предприняты попытки улучшить "прибор" и упростить получение калия. Отчасти это удалось. Но об усовершенствованиях сказано ниже. Сначала поговорим о необходимых реактивах. Нам потребуются алюминий и едкое кали. С алюминием нет никаких проблем, просто наточите напильником опилок. В качестве источника чистого алюминия удобен кусок электропровода или старой посуды. С гидроксидом калия дело сложнее. Это вещество в быту (в отличие от едкого натра) не применяется, но его довольно легко достать. Нужно попросить едкое кали в учебном заведении либо купить. Помимо магазинов химреактивов оно продается в некоторых радиотехнических магазинах. Я просто попросил едкое кали у коллег. |

Гидроксид калия |
|
Вещество оправдывает свое название исключительно сильным разъедающим действием на кожу, боле сильным, чем действие кислот. Очень опасно попадание даже малейших крупинок гидроксида калия в глаза. Это приводит к полной слепоте или, по крайней мере, к тяжелому повреждению зрения. Работать с едким кали нужно обязательно в защитных очках! Рекомендуются резиновые перчатки. На открытом воздухе вещество должно находиться минимальное время, из-за сильной гигроскопичности. Вот еще одна ложка дегтя - реактив выпускают не в виде безводного вещества, а в виде смеси, содержащей гидрат. Если Вы ее нагреете с алюминием, она расплавится в кристаллизационной воде и прореагирует с алюминием, подобно водному раствору. Вот что написано в ГОСТе, регламентирующем качество гидроксида калия (ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия <ссылка>): |

ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия |
|
Как видно из таблицы, в лучшем случае, щелочь содержит 13% воды! Нам понадобится безводный препарат. Нужно прокалить едкое кали в чашке из нержавеющей стали (в крайнем случае, железной посуде). Учитывайте, при испарении воды во все стороны разлетаются брызги щелочи! Выпаривать нужно в вытяжном шкафу или на открытом воздухе, предусмотрев меры предосторожности. Вначале чешуйки плавятся, раствор кипит, постепенно кипение прекращается и образуется расплав со спокойной поверхностью. Температура плавления гидроксида калия 380°С. Я просто поставил чашку в печь на угли - для тех, кто живет в частном доме, рекомендую именно такой способ: печь одновременно служит вытяжкой. Если печи нет - используйте плитку или плиту. Затем быстро охлаждаем. Не допускайте попадания воды на расплав! Образуется едкий аэрозоль. (Проверено мной, когда я налил воды в чашку со следами плава). |

Плавление едкого кали |
|
Так как была зима, я просто коснулся снега, наклонив чашку одной стороной. Плав прочно пристал к стенкам, заранее предугадав это, я запасся старой стамеской и молотком. Наготове должна быть сухая банка с плотной крышкой и широким горлом, а также ложка. Лучше эту операцию делать на открытом воздухе: откалываем стамеской (или чем-то подобным) куски и сразу помещаем их в банку. Осторожно, во все стороны разлетаются кусочки щелочи! Получившаяся щелочь загрязнена продуктами коррозии стали, но это не страшно и на результаты нашего опыта не повлияет. Чтобы измельчить едкое кали для реакции восстановления поступите следующим образом: в хлопчатобумажную салфетку в несколько слоев заверните куски щелочи и ударами молотка на прочном основании (я использовал отрезок рельсы) раздробите. Затем быстро разверните салфетку над газетой и пересыпьте щелочь в пузырек, в котором она до этого хранилась. Щелочь должна быть предварительно взвешена в закрытом пузырьке, пересыпать ее нужно по возможности быстрее (для этого удобно использовать газету). Края крышки для дополнительной герметичности можно промазать пластилином. Бекетов использовал изогнутую железную трубку (ружейный ствол). Проведенный мной опыт показал неудобства данного варианта, и я не советую так делать. Вначале я использовал 12-граммовый сифонный баллончик с отводом, который играл роль импровизированной реторты. В него нужно поместить максимум около 6.0 г щелочи и 1.5 г опилок алюминия. Большее количество использовать не следует: из-за бурной реакции, сопровождаемой выделением больших количеств водорода: 2KOH + Al = KAlO2 + K + H2
Нагревать смесь можно либо паяльной лампой, либо газовой горелкой. Я использовал большую корейскую горелку-насадку. Нижняя половина баллончика должна нагреваться сильно, до оранжево-желтого каления. Вначале реакция сопровождается разогревом. |

Горелка, которая использовалась для эксперимента |
|
В качестве "печи" я использовал банку из-под оливок с отверстиями. Отверстие для пламени должно быть широким. Через нижнее отверстие в "печь" направляют пламя, через боковое и верхнее оно выходит. На фото показан прибор после реакции. |

Исходные вещества для получения калия: едкое кали (в банке) и алюминий 
Установка для получения калия |
|
Когда смесь достаточно нагреется, начинается реакция - выходящий из "приемника" водород с парами калия самовоспламеняется и горит фиолетовым пламенем. Если этого не произошло, значит, реакция не началась, смесь необходимо нагреть сильнее. В процессе работы образуется едкий аэрозоль! Делать под тягой или на открытом воздухе! Роль "приемника" играла пробирка, неплотно заткнутая стеклотканью (можно использовать другой негорючий материал). Но основная часть металла конденсируется в средней части трубки. Просвет трубки постепенно сужается, давление возрастает и появляется небольшое пламя возле стыка трубки с баллончиком. Я продолжал нагревать установку 5 минут, но оказалось, что внутри остался непрореагировавший алюминий, поэтому нагревать лучше подольше, наверное, минут 10-15. После охлаждения быстро вскрываем ножницами и пассатижами трубку. Делаем все в защитных очках, под тягой или на открытом воздухе. Маленькие кусочки калия пирофорны! Я подстелил газету, чтобы было удобнее. Газета не воспламенилась, но нужно предусмотреть эту возможность. Кусочки калия поддеваем пинцетом и сразу помещаем в пузырек с керосином. Для глаз кусочки калия очень опасны! Получилось менее грамма (примерно 0.4-0.5г) загрязненного с поверхности металла. Однако такой вариант меня не удовлетворил. "Прибор" был крайне примитивен, извлекать калий было неудобно, и я продолжил улучшать установку. Как известно в XIX веке калий получали полукустарным способом, нагревая поташ с углем и мелом. При этом использовался приемник Донни и Мареска, позволяющий быстро охлаждать пары металла и не допускать окисления. Вот иллюстрация из словаря Брокгауза и Ефрона. В самодувном горне нагревается до белого каления железный сосуд с реакционной смесью. Пары металла быстро охлаждаются, конденсируются, а образующийся угарный газ защищает его от окисления. |
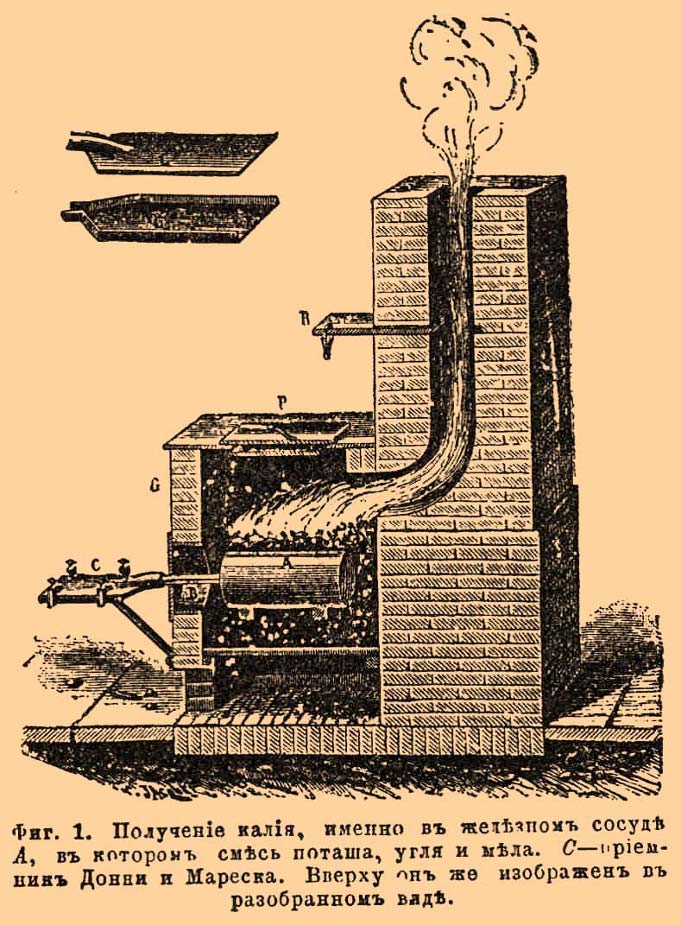
Получение калия (иллюстрация из энциклопедического словаря Брокгауза и Ефрона) |
|
Приемник Григорьева |

Приемник для калия |
|
Для скрепления частей приемника использована жесть от консервной банки из-под сгущенного молока, размеры листа 50х85 мм. С помощью пассатижей, натягивая края и заворачивая шов, удается обеспечить плотное прилегание частей, почти без зазора. Горло приемника немного сошлифовано наждачной бумагой. Оно должно с трением входить в боковое отверстие, просверленное в реакционном сосуде, который представляет собой 12-граммовый баллончик. Если не считать отверстия для выхода водорода, приемник практически герметичен. |

Установка для получения калия в собранном виде 
|
|
В качестве "печи" была использована та же банка с отверстиями, что и в прошлый раз. Крышку можно не использовать, особой роли она не играет. Заранее отшлифуйте гвоздь, чтобы он плотно закрывал отверстие в дне баллончика и сделайте шпатель из жести, чтобы им счищать калий (фотография дана ниже). Шпатель должен повторять округлую форму стенок. Теперь о проведении опыта. Как я уже говорил, реакция сопровождается образованием аэрозоля щелочи, делайте все под вытяжкой или на открытом воздухе. Щелочь должна быть раздроблена до кусочков, проходящих через отверстие "реторты". Алюминий использован в виде крупных опилок. Было взято 6.0 г щелочи и 1.5 г алюминия. Не берите исходные вещества в количествах, которые превышают указанные! |

Исходные вещества для получения калия: едкое кали (в банке) и алюминий |
|
С помощью воронки и стеклянной палочки насыпьте внутрь баллончика-реактора опилки алюминия, затем щелочь, закройте отверстие кусочком скотча и встряхните содержимое. Далее присоединяем приемник. Его нижнее отверстие (для выхода водорода) должно быть закрыто гвоздем. Аккуратно подмазывают стык реактора и приемника кашицей алебастра (берите его совсем чуть-чуть). Выждав 5 минут, сушим соединение феном около 4-5 минут. Теперь аккуратно наворачиваем влажную вату на жесть приемника, отступив от краев 5-8 мм, и закрепляем ее тонкой проволокой. Вначале удаляем гвоздь-затычку. Затем понемногу прогреваем баллончик с реакционной смесью горелкой (можно для экономии пользоваться паяльной лампой). Для нагрева я использовал бутановый баллончик и большую горелку-насадку, упомянутую выше. Горючий газ внутри баллончика охлаждается, и со временем пламя немного уменьшается, поэтому пришлось согревать бутановый баллончик рукой. Следите, чтобы половина "реторты" была нагрета до оранжевого каления, горло приемника должно быть нагрето до начала красного каления. Грейте около 13-14 минут. Реакция вначале сопровождается появлением фиолетового пламени, выходящего из приемника, потом оно постепенно уменьшается и пропадает, тогда можно уменьшить отверстие, вставив гвоздь (неплотно и с зазором). В ходе реакции понемногу смачивайте вату пипеткой, не допуская попадания воды на стыки. Прекратив нагрев, плотно вставьте затычку. Дайте прибору остыть до комнатной температуры! Я просто вынес его на мороз. Затем удаляем вату, и стираем следы воды. Заранее подготовьте место, где будете выскребать калий из приемника. Помните об опасности возгорания! У Вас должен быть бензин, пинцет, самодельный шпатель-скребок, емкость для хранения калия с инертной жидкостью, вроде керосина или масла. Желательно, чтобы жидкость была высушена. Соскребаем гипс и разнимаем приемник. Сразу на горло приемника надеваем кусок полиэтилена и придавливаем его пластилином (или заранее сделайте пробочку). Размыкаем половинки приемника, основная часть калия сконденсировалась в левой части (которая была присоединена горлышком к реактору), внутри правой части были лишь следы калия (строение приемника показано на фотографии <ссылка>). В левую часть налейте бензин (я использовал гексан). Делается это для защиты металла от окисления (бензин хорош тем, что потом он испарится бесследно, и можно будет опять использовать холодильник, не нарушая гипсовую замазку). Операцию проводят в защитных очках! Шпателем соскребите металл со стенок, потом пинцетом поместите его в емкость для хранения. Помните, маленькие стружки калия окисляются на воздухе так быстро, что могут воспламениться. Это легко увидеть, если тщательно расплющить ножом обсушенный кусочек калия на куске бумаги (лучше фильтровальной или туалетной) - калий обычно воспламеняется. Часть металла получится в виде небольших стружек и крупинок. Их можно собрать смыв бензином в емкость для хранения или сухой стаканчик. Они пригодятся для реакции с водой: даже небольшие крупинки горят красивыми фиолетовыми огоньками. Мне удалось собрать в бюкс около 1.1 г калия (0.7-0.8 г в виде компактной массы). Всего образовалось где-то 1.3 г металла. Часть калия в виде остатков я собирать не стал, промокнул бумагой от гексана и пинцетом перенес в воду (удобно просто стряхивать крупинки с бумаги). После реакции нужно удалить следы металла с приемника, правую половину ("дно") просто бросьте в воду на вытянутой руке и сразу отойдите. Левая половина пусть полежит на воздухе, пока следы калия частично окислятся, потом удалите их с помощью влажной ваты на проволоке (не повредив гипсовой замазки). Затем промойте приемник пипеткой и просушите его салфеткой (осторожно, не направляйте отверстие на себя). Реакционный сосуд тщательно промойте водой и высушите. Вот что получилось после опыта: |

|
|
Полученный калий

Калий и шпатель для отделения металла | |
|
Конечно, металла получилось немного, но для большинства опытов этого достаточно. Можно повторить несколько циклов получения калия. Описание, фотографии и видео опытов с калием смотрите на сайте журнала Химия и Химики. Если вы захотите их повторить - строго соблюдайте меры предосторожности, иначе можно ослепнуть! Натрий (дополнение)
К сожалению, натрий далеко не всегда можно извлечь из клапанов двигателей или попросить в школе. Юные химики, которым необходим натрий, могут попробовать получить его в небольших количествах способом, подобным описанному выше методу получения калия.
Процесс (как и меры предосторожности) должны быть аналогичными. Температура кипения натрия (883 °С) выше, чем калия (761 °С). Учитывайте, что необходимо обеспечить такой нагрев, чтобы натрий испарился из реактора и конденсировался в приемнике. Гидроксид натрия более доступен и содержит меньше влаги. Восстановление едкого натра алюминием идет легче, чем использовавшаяся в 19 веке реакция соды с углем (способ Девилля). Для восстановления соды углем требуется температура 1100 °С (по данным книги А.Г. Морачевский, И.А. Шестеркин , В.Б. Буссе-Мачукас, Е.Б. Клебанов, Л.Ф. Козин Натрий. Свойства, производство, применение. (1992) <ссылка>). Согласно другому источнику (Д.И. Менделеев Основы химии <ссылка>) необходима температура "белокалильного жара", которую достичь сложно. Баллончик-реактор выдержит довольно много циклов восстановления (более пяти). Для загрузки следует брать около 5.0 г гидроксида натрия и 1.7 г опилок алюминия. Как правило, проблема недоступности натрия актуальна лишь для начинающих юных химиков. |
|
|