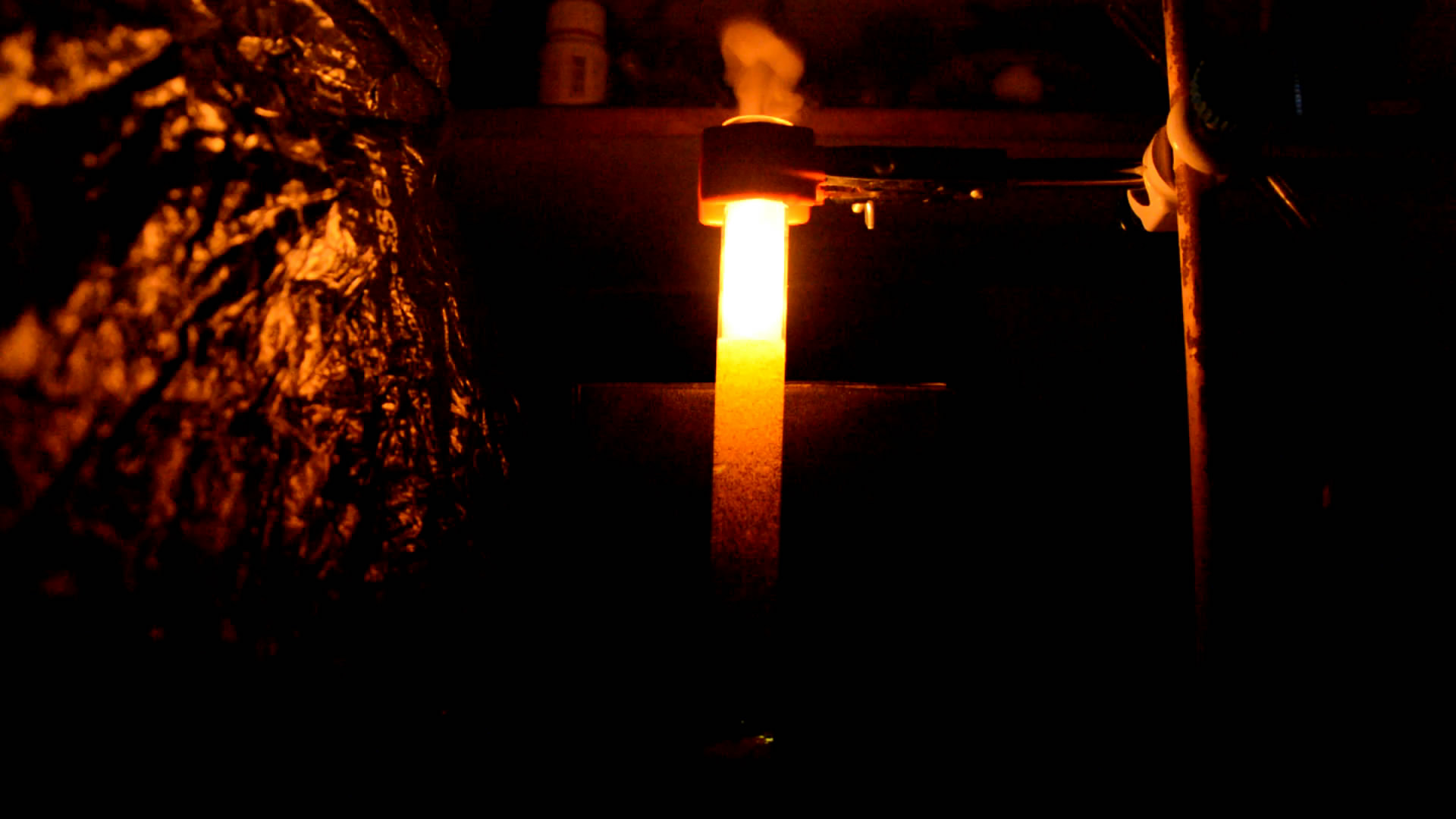Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Суть эксперимента проста: на дно стеклянного сосуда конической формы помешают хлорат калия, в сосуд наливают воду, помещают в него несколько кусочков белого фосфора размером с пшеничное зернышко. Далее при помощи воронки, опущенной почти до дна, льют в сосуд концентрированную серную кислоту. В результате реакции серной кислоты и хлората калия образуется диоксид хлора - неустойчивый газ и сильный окислитель. В результате белый фосфор горит даже под слоем воды. Ранее я проводил этот опыт, воспользовавшись описанием из практикума Рипана и Четяну [1].
Тогда были проблемы с хлоратом калия, поэтому вместо рекомендованных 10 г пришлось взять 1 г, белый фосфор также приходилось получать возгонкой красного (что проблематично). Вместо конического стакана была взята пробирка, вместо капельной воронки - пипетка. В этот раз хлорат калия и белый фосфор были, но в лаборатории не оказалось... большой, широкой пробирки. Можно было взять мерный цилиндр, но я не был уверен, что он не треснет от горящего фосфора: вспомнилось, как в опыте по горению фосфора в струе кислорода под водой [2] несколько раз треснула стеклянная трубка, по которой подавался кислород.
Для опыта был нужен сосуд достаточной вместимости, но с узким дном: чтобы хлорат калия и фосфор компактно собрались в одном месте, а не рассредоточились по широкому дну конической колбы или обычного стакана. И главное, чтобы сконцентрированная серная кислота опустилась вниз и реагировала с хлоратом, а не смешалась с водой и разбавлялась.
В прошлый раз за неимением конического стакана я брал пробирку. Это было логично, поскольку масштабы опыта были "пробирочные" (1 г хлората калия, 10 мл воды, кусочек фосфора, размером с пшеничное зерно).
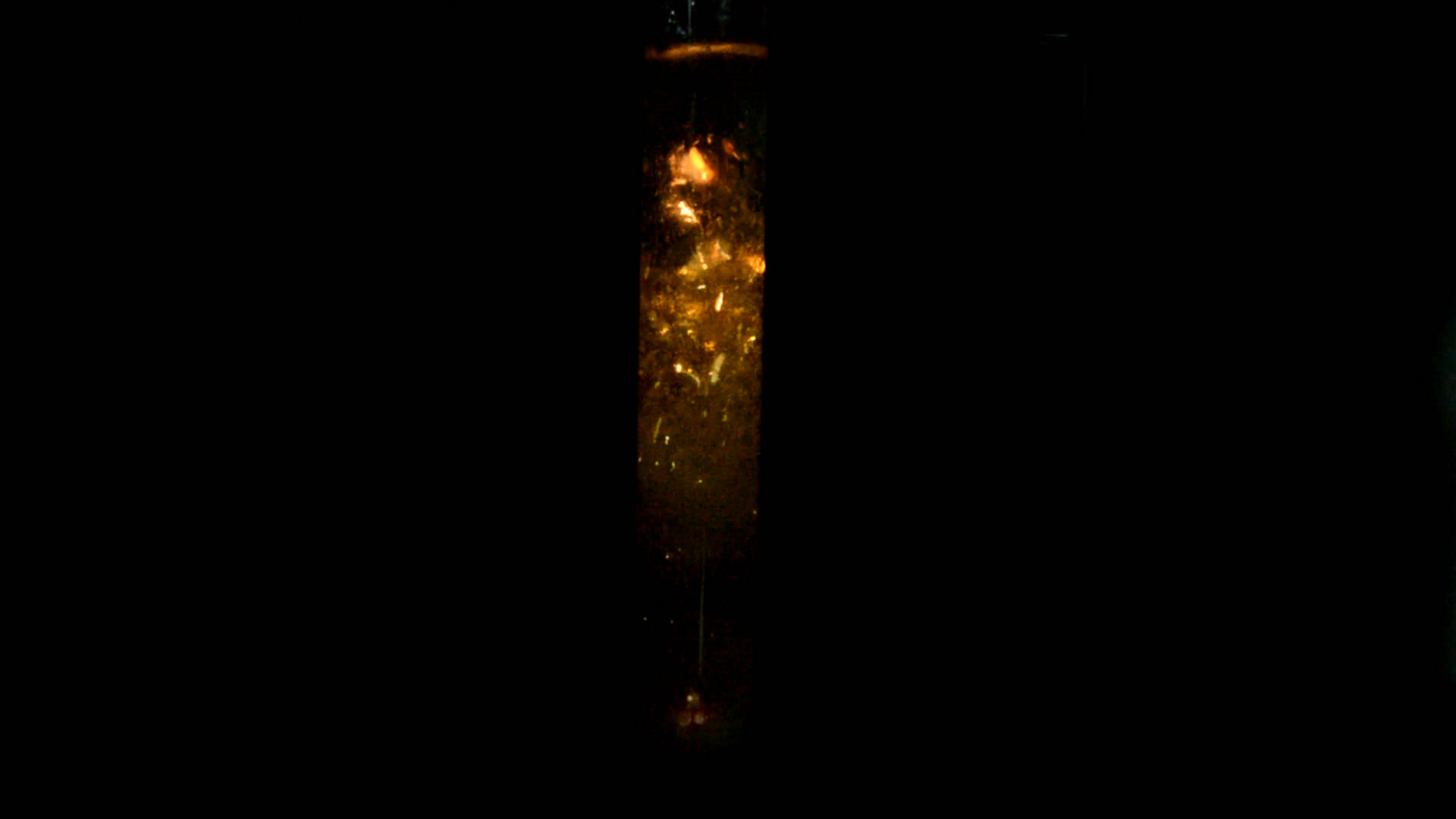
В этот раз решил взять 5 г хлората калия и 80 мл воды, что требовало сосуда объемом, по крайней мере, 150 мл. Взял коническую колбу, закрепил ее в штативе так, чтобы она располагалась углом в низ (по диагонали), поместил в колбу хлорат, воду и 2 кусочка фосфора с пшеничное зерно. Добавил серной кислоты. Фосфор расплавился и превратился в желтую капельку, которая начала с треском подпрыгивать, появились желтые искры и вспышки. Раствор в колбе стал зеленовато-желтым (что характерно для диоксида хлора и хлорноватой кислоты HClO3). Выделялся газ. Выключил свет. Искр и вспышек оказалось мало. Капля фосфора светилась, но это было слабое зеленовато-белое свечение, которое скорее напоминало мирное свечение фосфора на воздухе, чем горение.
Включил свет. Оказалось, что капля фосфора была с одной стороны дна колбы, а осадок хлората калия - с другой. - Не удивительно, почему опыт пошел вяло.
Для второго эксперимента взял пробирку вместимостью примерно 40 мл (это мало), 5 г хлората калия, 10 мл воды и кусочек белого фосфора размером с фасоль. Добавил несколько миллилитров серной кислоты. С количеством фосфора вышел перебор. Явный перебор. А воды оказалось мало - нечем было поглощать излишнее тепло окисления фосфора.
Фосфор расплавился и превратился в темно-желтую жидкость. Начались искры, вспышки, треск и звуки, аналогичные шипению воды на сковородке с горячим маслом. Капельки фосфора подпрыгивали и снова тонули. Потом процесс вышел из-под контроля. Содержимое пробирки вскипело и стало выплескиваться наружу, капельки фосфора поднимались вверх - на воздух и сразу же загорались: пробирка начала плеваться горящим фосфором . Потом кипение немного успокоилось и можно было наблюдать горение шариков фосфора на стенках пробирки. На этом опыт и закончился: в пробирке остался зеленовато-желтый раствор с осадком хлората калия. Фосфор сгорел.
. Потом кипение немного успокоилось и можно было наблюдать горение шариков фосфора на стенках пробирки. На этом опыт и закончился: в пробирке остался зеленовато-желтый раствор с осадком хлората калия. Фосфор сгорел.
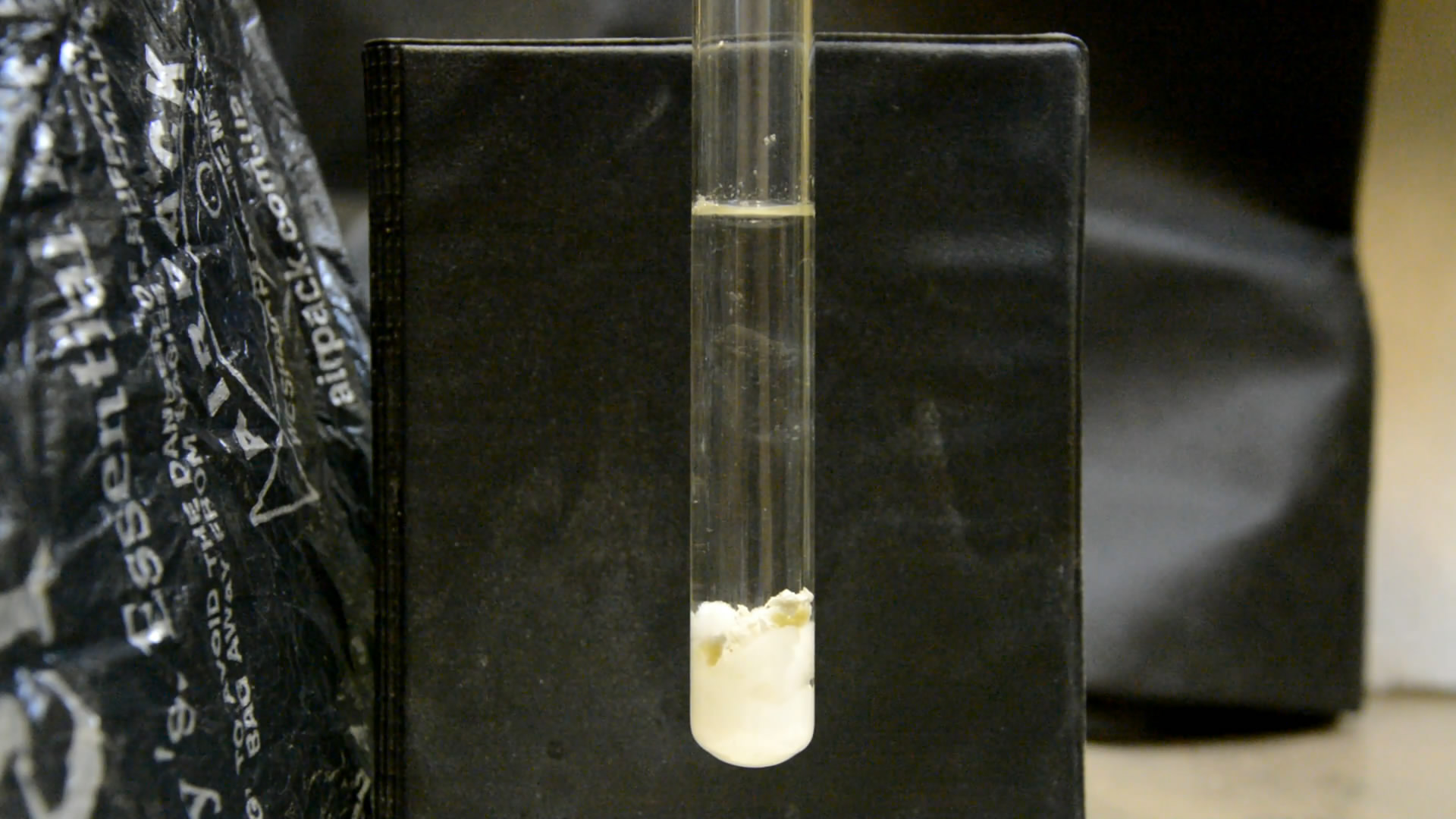
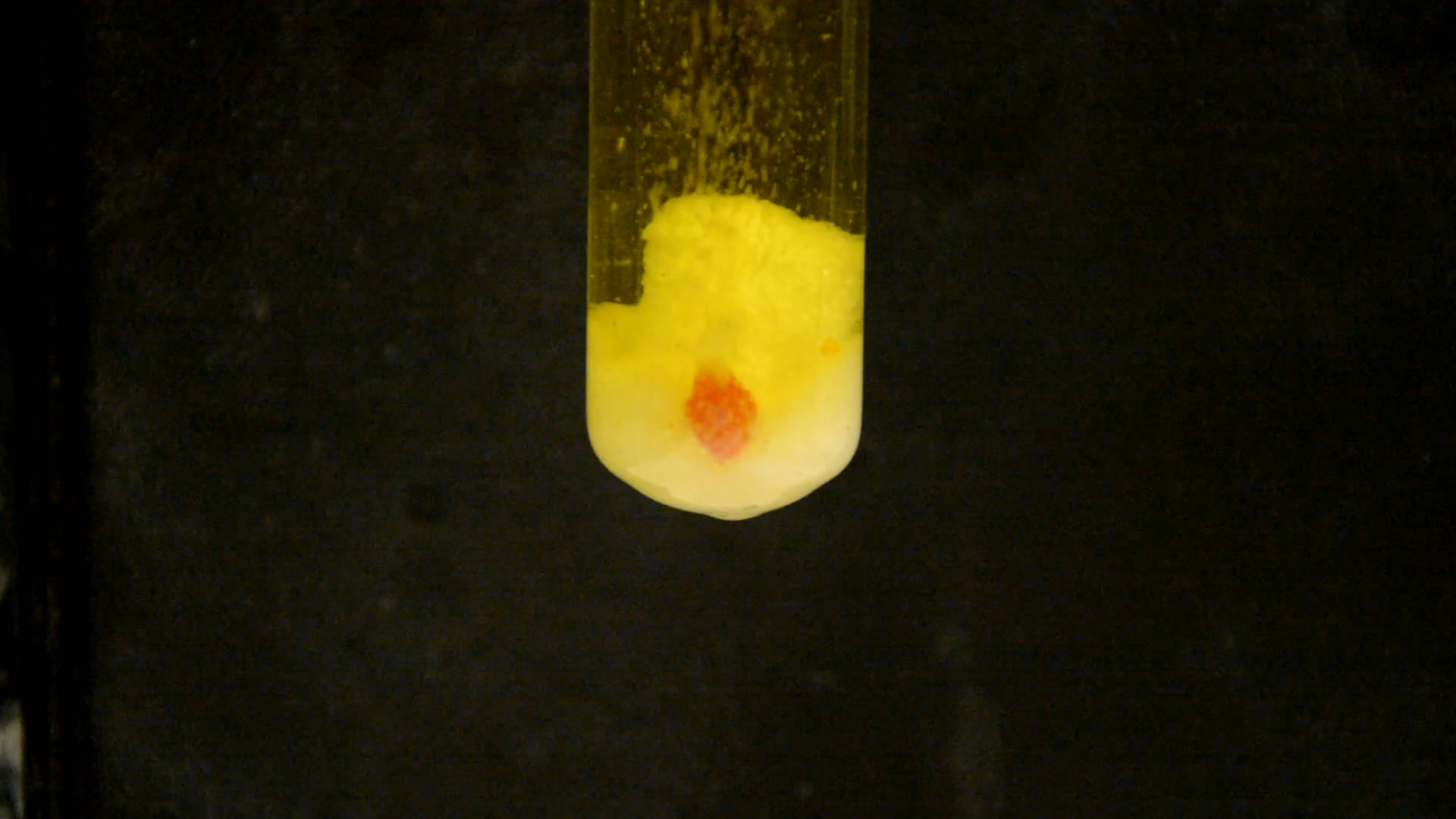
Для следующего опыта взял 5 г хлората калия, 20 мл воды и кусочек фосфора размером с 3 пшеничных зернышка. Пипеткой добавил 3 мл концентрированной серной кислоты.
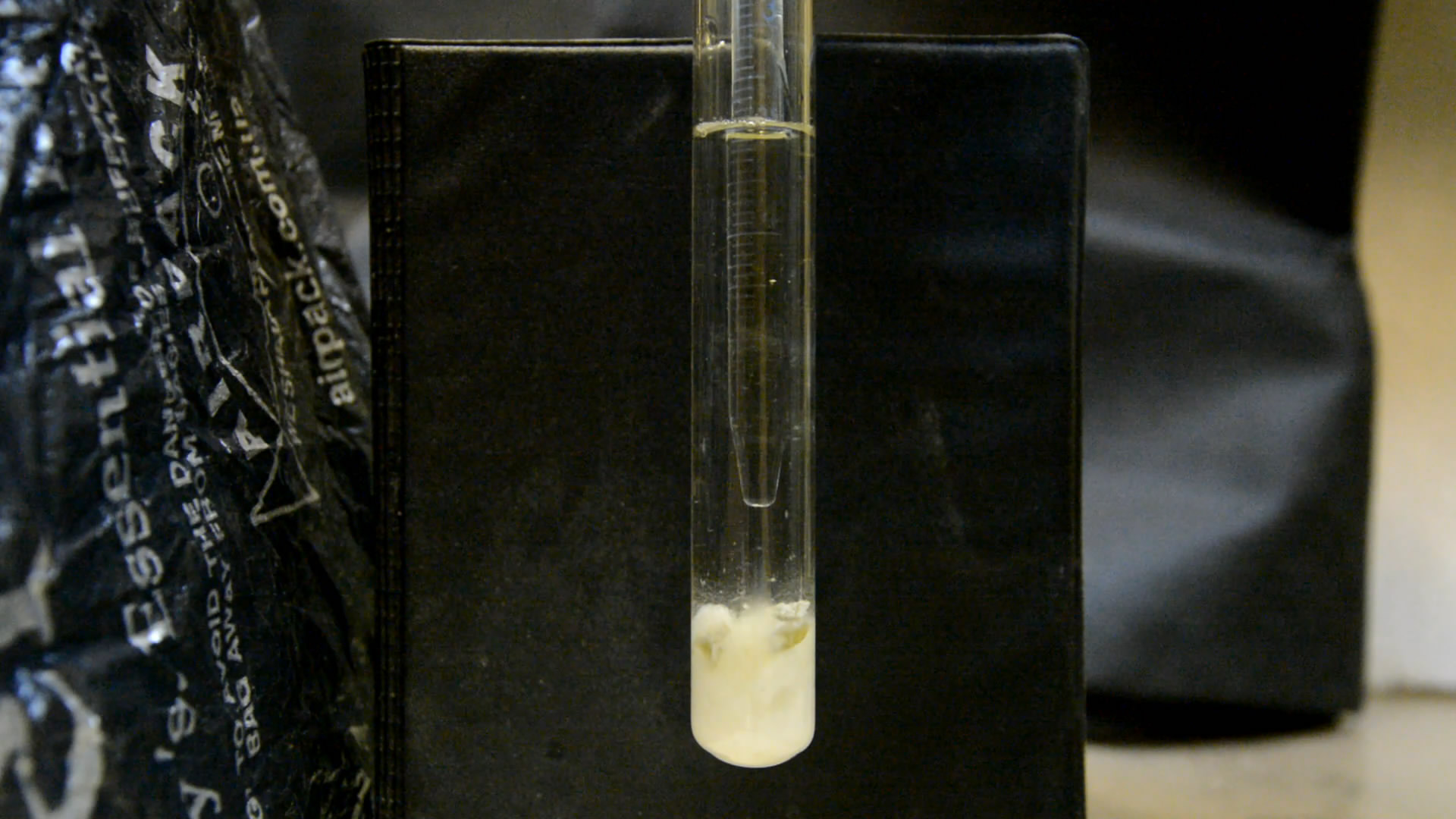
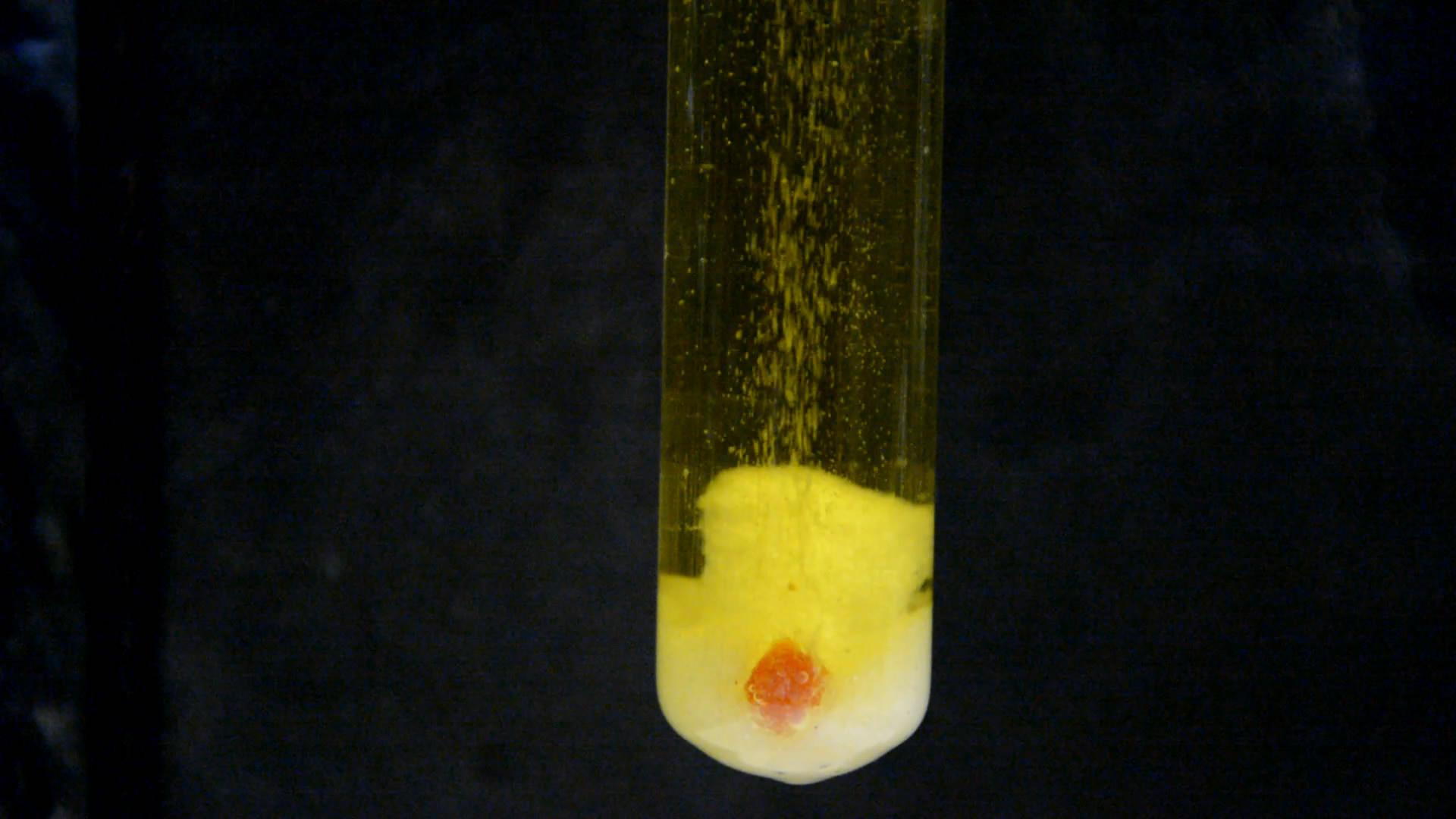
Раствор стал зеленовато-желтым, начал выделяться газ, фосфор расплавился, капельки подпрыгивали благодаря пузырькам газа. Треск и звуки кипения. В темноте капелька светилась. Вспышки оказались слабыми - добавил еще кислоты. В результате вспышки и искры усилились. Часть капелек фосфора поднялась к поверхности, где ярко горела. Еще несколько раз добавлял кислоту, что активизировало вспышки.
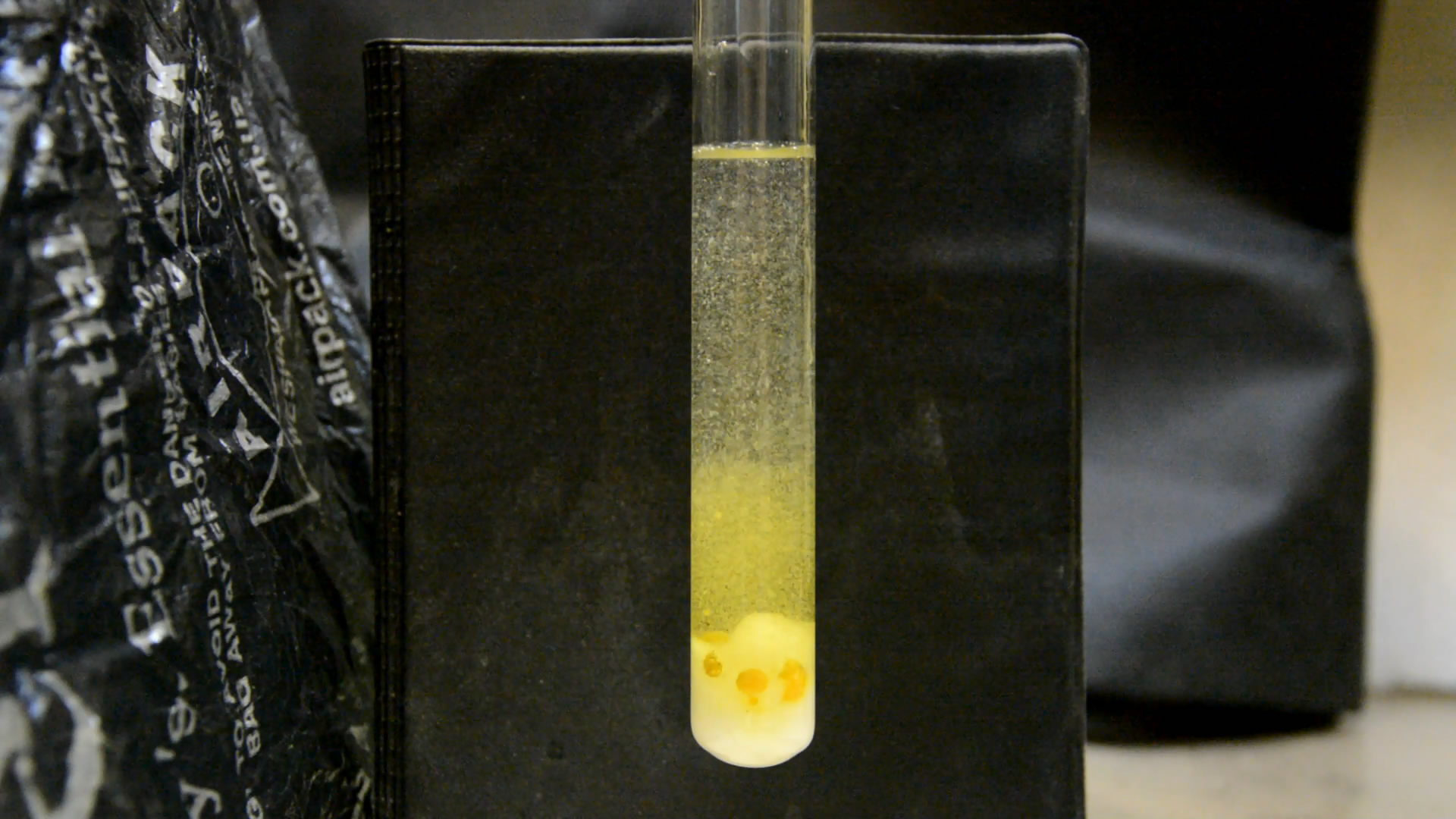
Вскоре в пробирке не осталось капелек фосфора, но на дне еще остался хлорат калия. Добавил в пробирку новый кусочек белого фосфора - размером с половину фасоли. Фосфор вспыхнул в пробирке еще до того, как коснулся поверхности жидкости - за счет контакта с газообразным диоксидом хлора. В жидкости кусочек фосфора погас, но не надолго: вскоре начались сильные белые вспышки, было много искр, треск и шипение, активное выделение газа.
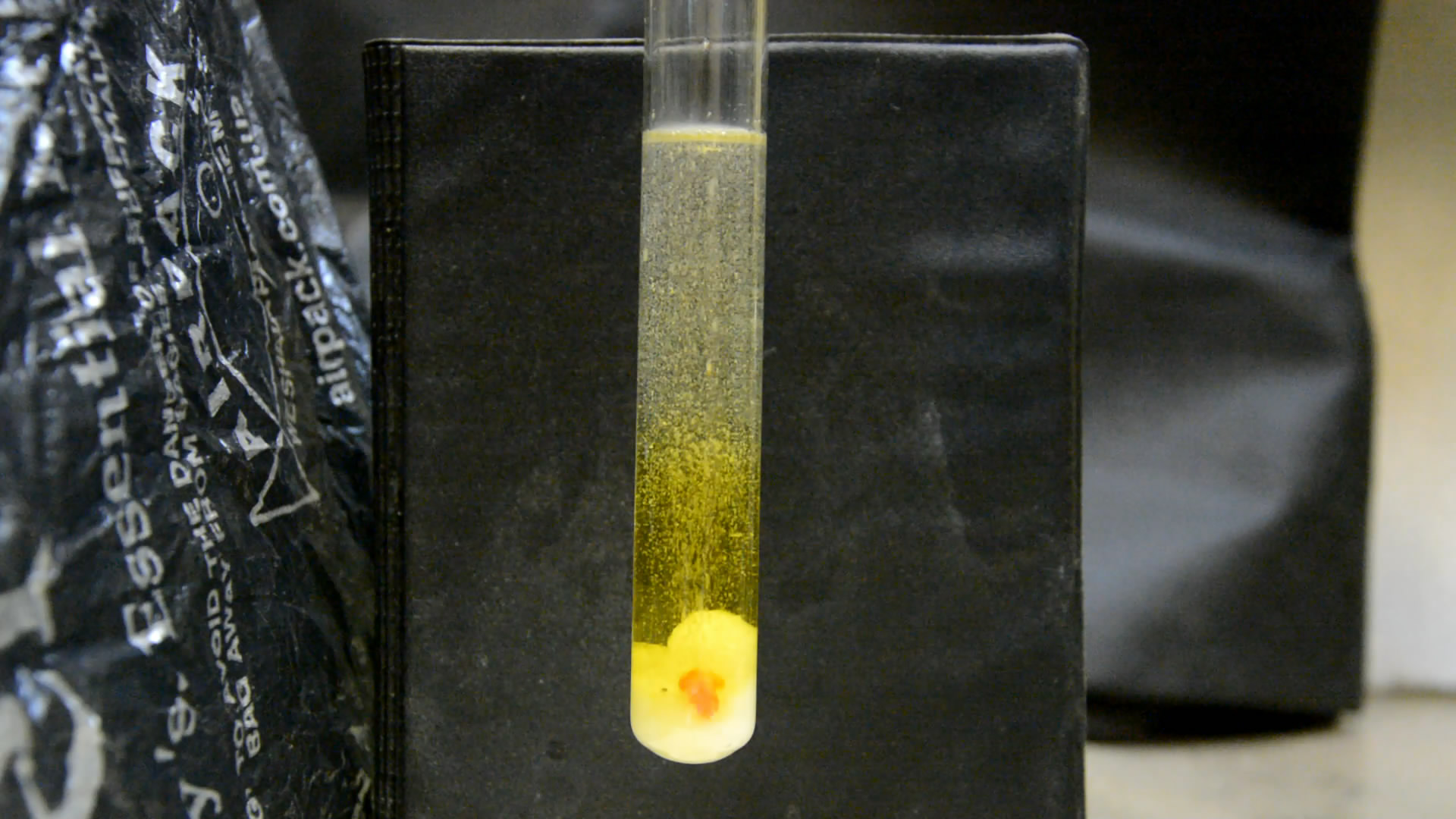
Со временем осадок хлората растворился, но шарик фосфора еще остался. Добавил несколько грамм хлората. Снова начались сильные вспышки, образование искр, раствор закипел (как в случае, когда я взял кусочек хлората размером с фасоль, но в этот раз он не выплеснулся из пробирки). Еще несколько минут продолжались треск, искры и яркие вспышки, пока не сгорел весь фосфор. На дне остался осадок хлората. - Можно было попробовать еще раз добавить в пробирку кусочек фосфора, но я не стал. Эксперимент окончен. __________________________________________________
1 Описание эксперимента - см. Опыты с фосфором ч.9-1. Горение фосфора под водой [ссылка]; оригинал практикума - см. Рипан Р., Четяну И. - Руководство к практическим работам по неорганической химии (1965) [ссылка]. См. также Опыты с фосфором ч.10. Горение фосфора под водой [ссылка]
2 Описание эксперимента - см. Эксперименты с белым фосфором ч.5. Горение белого фосфора под водой (колба) [ссылка]
Тогда были проблемы с хлоратом калия, поэтому вместо рекомендованных 10 г пришлось взять 1 г, белый фосфор также приходилось получать возгонкой красного (что проблематично). Вместо конического стакана была взята пробирка, вместо капельной воронки - пипетка. В этот раз хлорат калия и белый фосфор были, но в лаборатории не оказалось... большой, широкой пробирки. Можно было взять мерный цилиндр, но я не был уверен, что он не треснет от горящего фосфора: вспомнилось, как в опыте по горению фосфора в струе кислорода под водой [2] несколько раз треснула стеклянная трубка, по которой подавался кислород.
Для опыта был нужен сосуд достаточной вместимости, но с узким дном: чтобы хлорат калия и фосфор компактно собрались в одном месте, а не рассредоточились по широкому дну конической колбы или обычного стакана. И главное, чтобы сконцентрированная серная кислота опустилась вниз и реагировала с хлоратом, а не смешалась с водой и разбавлялась.
В прошлый раз за неимением конического стакана я брал пробирку. Это было логично, поскольку масштабы опыта были "пробирочные" (1 г хлората калия, 10 мл воды, кусочек фосфора, размером с пшеничное зерно).
В этот раз решил взять 5 г хлората калия и 80 мл воды, что требовало сосуда объемом, по крайней мере, 150 мл. Взял коническую колбу, закрепил ее в штативе так, чтобы она располагалась углом в низ (по диагонали), поместил в колбу хлорат, воду и 2 кусочка фосфора с пшеничное зерно. Добавил серной кислоты. Фосфор расплавился и превратился в желтую капельку, которая начала с треском подпрыгивать, появились желтые искры и вспышки. Раствор в колбе стал зеленовато-желтым (что характерно для диоксида хлора и хлорноватой кислоты HClO3). Выделялся газ. Выключил свет. Искр и вспышек оказалось мало. Капля фосфора светилась, но это было слабое зеленовато-белое свечение, которое скорее напоминало мирное свечение фосфора на воздухе, чем горение.
Включил свет. Оказалось, что капля фосфора была с одной стороны дна колбы, а осадок хлората калия - с другой. - Не удивительно, почему опыт пошел вяло.
Для второго эксперимента взял пробирку вместимостью примерно 40 мл (это мало), 5 г хлората калия, 10 мл воды и кусочек белого фосфора размером с фасоль. Добавил несколько миллилитров серной кислоты. С количеством фосфора вышел перебор. Явный перебор. А воды оказалось мало - нечем было поглощать излишнее тепло окисления фосфора.
Фосфор расплавился и превратился в темно-желтую жидкость. Начались искры, вспышки, треск и звуки, аналогичные шипению воды на сковородке с горячим маслом. Капельки фосфора подпрыгивали и снова тонули. Потом процесс вышел из-под контроля. Содержимое пробирки вскипело и стало выплескиваться наружу, капельки фосфора поднимались вверх - на воздух и сразу же загорались: пробирка начала плеваться горящим фосфором
 . Потом кипение немного успокоилось и можно было наблюдать горение шариков фосфора на стенках пробирки. На этом опыт и закончился: в пробирке остался зеленовато-желтый раствор с осадком хлората калия. Фосфор сгорел.
. Потом кипение немного успокоилось и можно было наблюдать горение шариков фосфора на стенках пробирки. На этом опыт и закончился: в пробирке остался зеленовато-желтый раствор с осадком хлората калия. Фосфор сгорел.
Для следующего опыта взял 5 г хлората калия, 20 мл воды и кусочек фосфора размером с 3 пшеничных зернышка. Пипеткой добавил 3 мл концентрированной серной кислоты.
Раствор стал зеленовато-желтым, начал выделяться газ, фосфор расплавился, капельки подпрыгивали благодаря пузырькам газа. Треск и звуки кипения. В темноте капелька светилась. Вспышки оказались слабыми - добавил еще кислоты. В результате вспышки и искры усилились. Часть капелек фосфора поднялась к поверхности, где ярко горела. Еще несколько раз добавлял кислоту, что активизировало вспышки.
Вскоре в пробирке не осталось капелек фосфора, но на дне еще остался хлорат калия. Добавил в пробирку новый кусочек белого фосфора - размером с половину фасоли. Фосфор вспыхнул в пробирке еще до того, как коснулся поверхности жидкости - за счет контакта с газообразным диоксидом хлора. В жидкости кусочек фосфора погас, но не надолго: вскоре начались сильные белые вспышки, было много искр, треск и шипение, активное выделение газа.
Со временем осадок хлората растворился, но шарик фосфора еще остался. Добавил несколько грамм хлората. Снова начались сильные вспышки, образование искр, раствор закипел (как в случае, когда я взял кусочек хлората размером с фасоль, но в этот раз он не выплеснулся из пробирки). Еще несколько минут продолжались треск, искры и яркие вспышки, пока не сгорел весь фосфор. На дне остался осадок хлората. - Можно было попробовать еще раз добавить в пробирку кусочек фосфора, но я не стал. Эксперимент окончен. __________________________________________________
1 Описание эксперимента - см. Опыты с фосфором ч.9-1. Горение фосфора под водой [ссылка]; оригинал практикума - см. Рипан Р., Четяну И. - Руководство к практическим работам по неорганической химии (1965) [ссылка]. См. также Опыты с фосфором ч.10. Горение фосфора под водой [ссылка]
2 Описание эксперимента - см. Эксперименты с белым фосфором ч.5. Горение белого фосфора под водой (колба) [ссылка]