Химия и Химики № 2 2020
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2020 Журнал Химиков-Энтузиастов |
Реактив Фелинга, Реактив Бенедикта, реактив Толленса и металлизация пластика Fehling's solution, Benedict's reagent, Tollens' reagent and metallization of plastic В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Какое отношение имеют три качественные реакции на углеводы, вынесенные в заголовок, к линии металлизации пластика? Получился ералаш? Ответ прост: "красный осадок оксида меди (I) и серебряное зеркало".
Теперь - все по порядку. В одной прекрасной стране есть один прекрасный город, а в нем - один завод (язык не поворачивается назвать его "прекрасным" - даже с иронией). На этом заводе есть цех гальваники. Основное его назначение - гальваническое и химическое покрытие металлических изделий: медью, никелем, хромом, химическим никелем. Но кроме этого еще есть линия металлизации пластика. Точнее, линий металлизации две - "большая" и "маленькая". "Большая" линия - хорошая: с момента покупки прошло десять лет, а она так и не заработала. Зато "маленькая" линия металлизации - не такая хорошая: еще недавно она работала, чем создавала постоянные проблемы: и технологам, и рабочим. Объемы производства - никакие, цена такая, что металлизация стала нерентабельной (спасибо китайскому демпингу), но раз линия работает - ее нужно обслуживать: делать анализы ванн, корректировать их состав, готовить растворы (концентраты) для корректировки состава. Рабочим - стоять с подвеской в руках и дышать аэрозолем хромового ангидрида, который летит из ванны травления (а еще там - серная кислота; и того, и другого в ванне - примерно по 400 г/л). Есть на этой линии ванна с коммерческим названием "Cu-link" ("связывание с помощью меди"), состоит она из сульфата меди, сегнетовой соли и большого избытка щелочи - гидроксид натрия и гидроксид лития (в таких количествах, что рН под 13). Перед этой ванной протравленные в хромовом ангидриде и серной кислоте изделия из пластика ABS погружают в палладиевый активатор металлизации, где на поверхность пластмассы (точнее в вытравленные на ней углубления) садятся кластеры палладия, окруженные ионами двухвалентного олова. В ванне "Cu-link" происходит "замещение ионов двухвалентного олова на ионы меди" (так написано в регламенте - понимай, как знаешь). После этого пластик помещают в "обычную" ванну гальванической меди, в которой на поверхности изделий образуется красное зеркало металлической меди. Сначала я решил, что в ванне "Cu-link" идет осаждение металлической меди - небольших количеств, незаметных глазу (что блестящего металла в этой ванне не образуется - трудно было не заметить, наблюдая за работой ванны). Но восстановителя в составе этой ванны нет - для выделения химической меди нужен восстановитель, в более ранних версиях технологии восстановителем меди обычно был формальдегид. Здесь его нет. Как тогда может образоваться металлическая медь? За счет того, что восстановителем служат небольшие количества олова (II), которые попали из предыдущей ванны? Спрашивал-спрашивал у других технологов, но однозначного ответа не получил. Все сходились, что металлическая медь там образуется. Наверное, образуется. А как иначе?! Один из технологов сбросил мне статью Печатные платы. Системы прямой металлизации // Компоненты и технологии, № 3'2003 [ссылка]. У нас не платы, а пластиковые безделушки, но принцип тот же. Из статьи я узнал: "Металлическая медь в данной ванне не образуется - в чем и состоит особенность технологии". Электропроводность поверхности пластика обеспечивают частицы палладия, которые сели на нее в предыдущей ванне. Понятно. Казалось, бы, интересное закончилось - с этой ванной. Дальше - рутина и банальное. Но интересное снова появилось. Поставили новую задачу. Нужно сделать концентрат для приготовления ванны "Cu-link", но не такой, как у нас, а другой вариант состава. Состава, который был известен лишь приблизительно, а процедура его приготовления - неизвестна (от слова "совсем"). В отличие от нашего концентрата (вернее, части "А" концентрата), раствор был не кислым, а щелочным. У нас - раствор "А": сульфат меди, винная кислота и серная кислота; раствор "В" - щелочь. И то, и другое приливают в частично заполненную водой ванну. Во время приготовления ванны (а также - во время корректировки ванны) раствор "В" дается в избытке, что и обеспечивает сильнощелочную среду после смешивания растворов. Зато в новом варианте раствор "А": сульфат меди, винная кислота, гидроксид лития. Т.е., раствор "А" - тоже щелочной. Как его приготовить? Растворить твердые вещества и смешать? Все не так просто - если не так смешать, возможен осадок. Который потом не растворится. Пришлось немного поработать (см. статью: "Не та" винная кислота. "Wrong" tartaric acid [ссылка]). В конце концов, порядок смешивания и концентрации компонентов удалось подобрать. Все было прекрасно, если бы не одно "но". При стоянии раствор "А" давал осадок: сначала - желтый, потом - красный. Другой технолог решил, что это - металлическая медь. Но откуда ей взяться? Для образования металлической меди из этого раствора нужен хороший восстановитель, например, - формальдегид. Тем более, осадок сначала - желтый, потом - красный. Это характерное поведение: желтый осадок - гидроксид меди (I) - CuOH, который при стоянии переходит в красный оксид меди (I) - Cu2O. Оксид меди (I) из этого раствора образоваться может - достаточно примеси слабых восстановителей вроде восстанавливающих сахаров (которые содержат альдегидную группу). Как избежать образования осадка? По телефону - еще до того, как подключиться к работе, я посоветовал: - Отфильтруйте и забудьте. - А концентрация меди в растворе? Она же упадет! - Осадка много? - Мало. - Забудьте. Ошибка взвешивания компонентов даст большее отклонение. Все-таки решили попробовать изменить состав так, чтобы красный осадок не выпадал. В результате во всех колбах с раствором, кроме одной, при стоянии образовался осадок, - сначала желтый, потом - красный. Там, где осадка не было, был максимальный избыток щелочи - самый высокий pH. Сделали выводы и закончили работу. Колбы с осадком я вылил и помыл, оставил стоять только одну - там, где не было осадка. Зачем? Не знаю. Просто так. Через пару месяцев и там выпал осадок. Я его не заметил (и раствор темный, и сам осадок на дне), но в гости зашел другой технолог - он поинтересовался. Оказалось, что все дно колбы - красное. "Невооруженным глазом" это плохо видно, но если вооружиться фотовспышкой... |

Сульфат меди, сегнетова соль и гидроксид лития до сильнощелочной среды.
Один из концентратов (раствор "А") для приготовления ванны "Cu-link" линии металлизации пластика. При стоянии раствора выпал красный осадок закиси меди Cu2O |

|

|
|
Думал, что все. Уже начал описывать наблюдения, но для очистки совести задал в гугле поиск картинок оксида одновалентной меди. Какой он - я отлично помнил, просто решил перестраховаться. Один из первых результатов - статья про реактив Бенедикта - он предназначен для качественного обнаружения (и количественного определения) восстанавливающих сахаров (альдоз и кетоз) [1].
Раскапываю дальше, дошел до реактива Фелинга (фелингова жидкость) - он тоже служит для обнаружения и количественного анализа восстанавливающих углеводов. Впервые про прочел него еще в школе - в книге Гроссе Э., Вайсмантель X. Химия для любознательных. Основы химии и занимательные опыты [ссылка]. Даже не читая найденной статьи, вспоминаю: "Реактив Фелинга - сульфат меди, гидроксид натрия, сегнетова соль"... СТОП! Это же - моя ванна "Cu-Link"! И компоненты раствора те же! (Если не считать таких мелочей как гидроксид лития). И еще одно совпадение: если проба Фелинга положительная, выпадает красный осадок оксида меди (I). И растворов Фелинга фактически два: их смешивают непосредственно перед использованием (как и в нашей ванне - часть "А" и часть "В"). А если это предостережение проигнорировать - смешать два раствора перед долгим хранением (I - сульфат меди; II - сегнетова соль и щелочь: едкий натр или едкое кали), наградой станет красный осадок закиси меди, который образуется при стоянии (особенно - при стоянии на свету). Как в ванне "Cu-Link", так и в реактиве Фелинга медь образует с анионом тартрата комплекс (синего цвета): 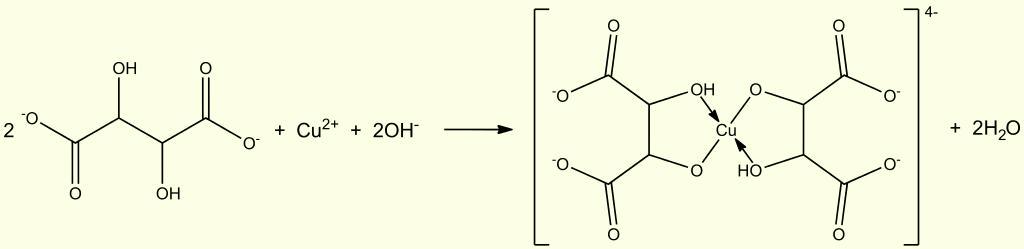 Мир аналогий на удивление богат: состав ванны для металлизации пластика взят из состава реактива для определения восстанавливающих углеводов! За рецептом реактива Фелинга обратимся к книге Ф. Файгль Капельный анализ органических веществ [ссылка]. " Восстановление реагентов Фелинга, Толленса и Несслера.
Реагент Фелинга, предназначенный для открытия восстановителей, главным образом редуцирующих Сахаров, готовят непосредственно перед употреблением, смешивая равные объемы растворов сульфата меди (7.5 г CuSO4·5H2O в 100 мл воды) и щелочного раствора тартрата натрия-калия (35 г сегнетовой соли и 25 г едкого кали в 100 мл воды). В реагенте Фелинга медь входит в состав комплексного аниона, т. е. замаскирована и поэтому не осаждается ОН-ионами. Однако и малой концентрации Cu2+-ионов в растворе реагента Фелинга вполне достаточно, чтобы они реагировали при нагревании с органическими соединениями, которые могут оказывать сильное восстанавливающее действие в щелочном растворе. Осаждается окись или гидроокись меди (I); ее цвет - от желтого до красного - зависит от степени дисперсности и размера частичек осадка. С нагретым раствором Фелинга реагируют некоторые сахара (альдозы, кетозы), фенилгидразин и другие органические замещенные гидразина и гидразиды кислот. Чувствительность реакции с реактивом Фелинга мала, если ее проводить в виде капельной реакции в микропробирке; обычно можно обнаружить миллиграммовые количества восстановителя."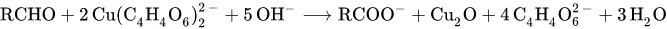 __________________________________________________ 1 Восстанавливающие сахара содержат свободную альдегидную группу либо могут ее образовывать в результате изомеризации в щелочной среде. |


Реактив Фелинга: левая пробирка - контроль, правая - реакция с восстанавливающими сахарами |

Реактив Фелинга: глюкоза и фруктоза дают положительную пробу, сахароза и крахмал (не показан) - отрицательную |
|
Теперь - реактив Бенедикта. За его рецептом обратимся к оригинальной статье, благо, она есть в свободном доступе: Benedict S.R. A reagent for the detection of reducing sugars. // J. Biol Chem 1909;5:485-7 [ссылка].
Сульфат меди (пентагидрат) 17.3 г, цитрат натрия 173 г, карбонат натрия (безводный) - 100 г, дистиллированная вода - до 1 л. Отдельно растворяют сульфат меди, который потом прибавляют к раствору, содержащему карбонат и цитрат натрия. В отличие от реактива Фелинга, такой раствор устойчив к хранению и нагреванию. В реактиве Бенедикта медь (II) образует комплекс с анионом цитрата (в реактиве Фелинга - медь связана в комплекс с анионом тартрата). В присутствии восстанавливающих сахаров реактив Бенедикта дает красный осадок закиси меди (или часто - желтый или даже зеленый осадок гидроксида меди (I)) - в этом он аналогичен реактиву Фелинга. Реактив Бенедикта более чувствителен, чем реактив Фелинга. |
 .jpg)
Реактив Бенедикта (до и после реакции) Benedict's test (before & after) |

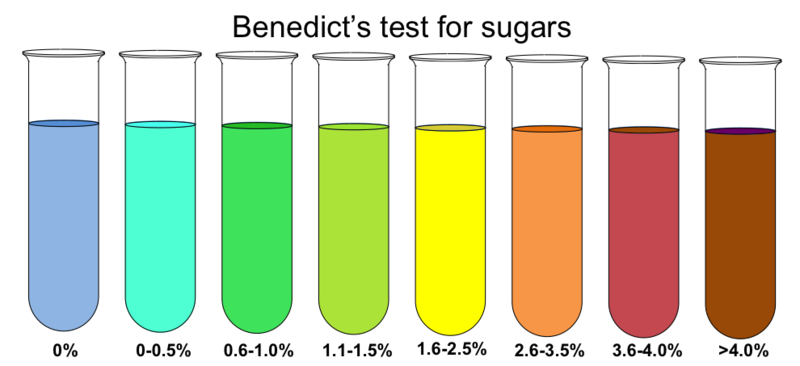
Реактив Бенедикта (примерная количественная шкала для углеводов) Benedict's test |
|
Есть еще более чувствительный реактив для определения альдегидов (восстанавливающих сахаров, в частности) - реактив Толленса. Оказывается, он тоже имеет отношение к металлизации пластика. Обратимся к упомянутой монографии Ф.Файгль Капельный анализ органических веществ:
"Реагент Толленса. К 1 мл 10%-ного раствора нитрата серебра прибавляют 1 мл 10%-иого раствора едкого натра; образующийся осадок окиси серебра растворяют, прибавляя по каплям аммиак (1:1). Выполнение реакции. Реакцию выполняют в микропробирке или в центрифужной пробирке Эмиха. Смешивают каплю исследуемого раствора с каплей свежеприготовленного реагента и помещают на 15-30 сек. в воду, нагретую до 70-85°. Выделение металлического серебра указывает на наличие восстановителей." Нетрудно видеть, что это и есть реакция серебряного зеркала. |

|

Реактив Толленса: слева - положительная реакция на альдегиды (серебряное зеркало) справа - отрицательная реакция Tollens' test for aldehyde: left side positive (silver mirror), right side negative |

|
|
Чтобы серебро образовало качественный зеркальный слой, который хорошо держится, поверхность стекла (пробирки, колбы и т.д.) следует соответствующим образом подготовить. В результате из "обычного стекла" мы получим серебряное зеркало. Но если нужно только провести качественную реакцию - такая подготовка необязательна. Оказывается, этим методом покрывали серебром не только стекло, но и пластик. Об этом я узнал от товарища:
- А ты в курсе, что с помощью Толленса тоже металлизировали пластик? - Аммиачный раствор оксида серебра? - Да. Но сейчас так не делают. Можно взорваться. - Так раньше же этим методом покрывали серебром зеркала (пока не стали их делать методом напыления алюминия). - Делали - и подрывались. При стоянии раствора выпадал взрывоопасный нитрид серебра. Про нестабильность аммиачного раствора оксида серебра при хранении я помнил - раствор вообще не рекомендуют хранить. Об этом, в частности, упоминается в сноске к приведенной выше методике из монографии Ф.Файгль Капельный анализ органических веществ: "Реагент Толленса нельзя хранить, так как со временем он становится взрывоопасным вследствие образования азида серебра" [точнее - нитрида]. Состав вещества, которое выпадает при этом в осадок, не совсем соответствует формуле нитрида - "Ag3N", но более важно другое - осадок взрывоопасен. А поскольку нарушения техники безопасности на производстве неизбежны - неизбежны и взрывы нитрида серебра. Зато факт, что эту же реакцию использовали не только для серебрения стекла, но и пластика, стал для меня новостью. Посмотрел, литературу, задал поиск в интернете - оказалось, что так и есть. Для примера приведу один из рецептов: "Серебрение пластика Металлизацию пластика слоем серебра выполняют в следующей последовательности. 1. Ошкуривание поверхности и ее обработка абразивным порошком. 2. Промывка изделия мыльным раствором и дистиллированной водой. 3. Обезжиривание поверхности в растворе, состоящем из хромового ангидрида (100 г/л) и сульфата железа (10 г/л). 4. Промывка детали в дистиллированной воде. 5. Сенсибилизация, для выполнения которой используют раствор хлористого олова (2 г/л). 6. Погружение изделия на 60 минут в раствор, состоящий из следующих компонентов: нитрата серебра (3 г/л), каустической соды (3,5 г/л), 25-процентного аммиака (8 мл/л), глюкозы (2,5 г/л). Температура раствора - 18-25°." Некоторые читатели могут возразить: серебро дорогое, дешевле покрывать, например, медью. Да, только при химическом меднении пластика используется палладий. По крайней мере, - в популярных вариантах этой технологии. Именно на палладий идет львиная доля затрат. Что дешевле, а что дороже - пусть разбираются экономисты. Я же обращу внимание на другое: сразу два реактива для обнаружения восстанавливающих сахаров - реагент Фелинга и реагент Толленса используются в технологии металлизации пластика. Думаю, что при желании и реактив Бенедикта для этой цели пристроить можно. Совсем разные области - аналитическая химия (с уклоном на биохимию и медицину) и технология композиционных материалов на основе пластмасс - а реагенты одни и те же. |