Химия и Химики № 1 2020
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2020 Журнал Химиков-Энтузиастов |
Мешочная история (из жизни химических веществ на заводе) ч.2.1-2.3 Bag story (about chemical substances) В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Хромовый ангидрид на гальванике (ч. 2.1)
Начальство поставило задачу осуществить металлизацию пластиковой детали, напечатанной на 3-D принтере. Задача оказалась невыполнимой, но тогда я этого еще не знал (правда, догадывался). Пока готовил необходимые растворы в лаборатории, пока сходил на линию и зачерпнул электролит меднения, а за компанию - "кюлинг" (аналог ванны химической меди), - пока я бегал и всем этим занимался, позвонил менеджер, попросил спуститься, получить "химию". Странно: я ничего не заказывал. Спускаюсь: в машине - куча всего, мой - барабан с хромовым ангидридом.
Chromic anhydride on electroplating И снова - хромовый ангидрид... Заказывал не я, но нужен он именно для нашего цеха (ванна блестящего хромирования, ванна желтой пассивации цинка, ванна снятия бракованных покрытий). В нагрузку дали 5 штук 1-килограммовых пакетов сульфата меди... темно-зеленого цвета. Что ерунда полная - увидел сходу, но я за него не расписывался, а на претензии к качеству менеджер ответил: - Не нравится - выкинь. Не выкинул только чтобы сфотографировать и, по возможности, провести качественный анализ. Привез на тележке барабан с хромовым ангидридом в кладовку, а там - места в обрез. Пришлось играть в "химические пятнашки": чтобы занести что-то новое (мешок, барабан, ящик...), нужно вынести что-то старое - уже распечатанное. Затем - занести новое, вернуть в кладовку старое (вскрытое) и поставить его сверху на новое. Так и сделал. Вынес старый барабан, занес новый, потом занес старый и поставил его сверху. Смотрю, а на полу в коридоре рассыпались чешуйки хромового ангидрида... Откуда? Оба барабана были закрыты (новый - еще и запечатан). Неважно: идти за веником на этаж выше поленился, взял тряпку. Что смог - собрал в мусор, остальное - рассеял: все равно на коричневом полу чешуйки CrO3 не видно. Ага. И полчаса не прошло, как поступили претензии, что возле кладовки весь пол в растворе хромового ангидрида. Чешуйки и более мелкие частицы поглотили атмосферную влагу и превратились в капли и лужицы темно-коричневого раствора, который разнесли ботинки рабочих по всему коридору. Чтобы сделать, как было, пришлось основательно поработать тряпкой. На следующий день набирал хромовый ангидрид для приготовления ванны желтой пассивации цинка - рабочая сказала, что старая ванна перестала действовать. Нужно вычерпать отработанную ванну в три 25-кг канистры (начальство не разрешило слить в канализацию, как делали предшественники, - все-таки шестивалентный хром - не шутки!) Дело скучное, хорошо, что рабочая нашла удобную воронку (я приготовился использовать срезанную 6-л ПЭТФ бутылку - с ней неудобно, т.к. такая воронка легкая и слетает с канистры). Вычерпал. На дне обнаружил потерянную деталь - при погружении в ванну она отвязалась и опустилась на дно. Вероятно, тогда в ванну погрузили много деталей сразу - поэтому пропажу вовремя не заметили. Вообще на дне гальванических и вспомогательных ванн можно найти много интересного... Новая ванна. Задача - взвесить 620 г хромового ангидрида. А в чем проблема? Весы - есть, только - очень неудобные. От легкого прикосновения пальцами к весам единица измерения постоянно меняется - то граммы, то килограммы, то весовые фунты, то караты... А ты не видишь, что там на весах - в кладовке слабое освещение (вернее, цифры - видно, а значок единицы измерения: "kg, g, lb, q" - нет: он слишком мелкий). Вынести весы в цех - там светло и можно нормально взвесить? С другими веществами я так и делал, но с хромовым ангидридом - не очень хочется. Куда весы поставить? Когда взвешивал в кладовке, я их ставил на барабан с хромовым ангидридом. Но теперь этот барабан пришлось открыть, чтобы зачерпнуть вещество. Зачерпнул совком - а с него чешуйки во все стороны рассыпаются: убирать еще и в кладовке, как в коридоре, не хочется. Положи совок на пол - половина рассыплется. Нашел клеенку - подстелил. Закрыл барабан, установил весы, взвесил. Подмел, что рассыпалось. Сморю, а хромовый ангидрид все сыплется и сыплется на пол... Откуда? Оказалось, что начатый барабан, который я днем ранее поставил сверху на новый, проржавел: его дно почти сгнило. Барабан время от времени открывали - рабочий раз в месяц добавляет хромовый ангидрид в ванну блестящего хрома. В результате вещество в барабане наглоталось воды, она стекла вниз, образовала с хромовым ангидридом хромовую кислоту (или полихромовые кислоты), которые и вызвали коррозию железного барабана. Теперь ясно, откуда взялся хромовый ангидрид в коридоре - я выносил этот барабан из кладовки, не зная, что он дырявый. Кстати, а как рабочий взвешивает хромовый ангидрид? Не видел, но уверен, что он просто берет его "на глаз": сколько-то совков. Взял срезанную канистру с хромовым ангидридом, 25-кг канистру с гальванической добавкой, потом принес канистру с азотной кислотой. Приготовил новую ванну: 7 ведер деионизированной воды, 620 г хромового ангидрида, 400 мл азотки и 2.8 л гальванической добавки. Пока готовил, рабочая окунула оцинкованные детали в канистру с уже слитой отработанной ванной - нужно было срочно нанести пассивацию. Потом опробовали новую ванну - работает. Закончил с хромовым ангидридом, вернулся к занятию с палладием - активатором металлизации пластика. И снова получил проблемы с шестивалентным хромом, но это уже другая история. |

Новый барабан с хромовым ангидридом (для нужд гальваники) |

|

|

Сверху - начатый барабан с прогнившим дном (синего цвета) |

Хромовый ангидрид (начатый барабан внутри) |

Регламент на ванну желтой пассивации цинка |

Вычерпываю отработанную ванну - уже видно дно |

|

Готовлю новую ванну желтой пассивации цинка |

|

|

Ванна готова |

Кладовка: барабаны с хромовым ангидридом, канистры с плавиковой и азотной кислотой, гидроксиламин солянокислый, оксид цинка, мешки с едким натром, гальванические добавки и т.д., и т.п. |
|
Только закончил писать данный раздел статьи, как попросили приготовить новую ванну "хим. окс. э." - химическое оксидно-фторидное покрытие алюминия и сплавов (покрытие токопроводное, хотя и механически непрочное). Состав: оксид хрома (VI), бифторид аммония и красная кровяная соль. Точнее, ванну будут готовить рабочие, с меня - взвесить компоненты. Опять - хромовый ангидрид (моя любовь) и опять неудобные весы. Но в этот раз было хотя бы куда их поставить - на новый барабан с хромовым ангидридом (само вещество набирал из старого барабана). Взвесил все три вещества в одной срезанной канистре. Тщательно убрал рассыпавшиеся чешуйки. Принес вещества рабочим - те засомневались: а не слишком много на такой объем? Нашел на мобилке фото с рецептурой, которую мне дала мастер, рабочие принесли бумажку со своей рецептурой - совпало. После обеда приготовили ванну [1].
А через пару часов наблюдал необычайно красивое зрелище. Именно в этой ванне. Под толщей красно-коричневого раствора замкнул ТЭН ванны. То тут, то там, вспыхивали яркие искры, растворенный хромовый ангидрид придал им красно-оранжевый цвет. Жаль, тогда не было с собой телефона. Где выключается нагрев этой ванны - я не в курсе. Позвал гальваников. Они тоже не знали (на этой ванне работают не они) - нашли и выключили далеко не сразу, зато тоже успели полюбоваться. Вообще, "электрические фейерверки" на гальванике не редкость. Сегодня чуть не выронил кружку с добавками, когда перед самым носом с характерным треском вспыхнул сноп искр: что-то с ванной блестящего никеля. Посмотрел, где причина, но продолжения не последовало. Пошел дальше. __________________________________________________ 1 Ванна "хим. окс. э" (она же - "хм. окс. фтор", "хим. окс. тп.") описана в книге: Грилихес С.Я. Оксидирование и фосфатирование металлов (1971) [ссылка] |

|

|

|

|

|

|

|

|

|

|

|
|
На следующий день иду мимо - электрик что-то делает с ТЭНом - именно в этой ванне. Оказалось, это уже новый ТЭН. Старый он снял - ТЭН лежал рядом. Титановый корпус проело, в нем большая "пробоина", через которую видно спираль. Вот что значит триоксид хрома.
|

Нагреватель в титановой трубке - коррозия в ванне с хромовым ангидридом и бифторидом |

Новый нагерватель в ванне хим. окс. э. |

|
|
Комментарии
К1
Что сказала гальваник, которая работает с этой ванной.- С новым нагревателем будет то же, что и со старым - через месяц хромовый ангидрид и его "съест". Раньше были стеклянные обогреватели [кварц, по-видимому]. Бригадир гальваников застал такие нагреватели на ваннах меди и никеля. Я - уже не застал. ТЭНы в стеклянной (кварцевое стекло) оболочке видел только в дистилляторе. К2 Бифторид будет и кварцевое стекло "жрать", думаю. Тут бы свинец, наверное, мог помочь, но он при высоких температурах расплавится. Кстати, сам нихром к действию кислот и окислителей довольно стоек. Но оболочки ТЭНов из нихрома делать это уже жирно будет, наверное. К3 Для этой ванны нагреватель должен быть во фторопластовой оболочке. Любые растворы с неорганическими соединениями фтора разрушают титан. У меня была ванночка с электролитом, содержащим фторборат, прикрытая титаном 2 мм толщиной. Ползучие соли проели дырку. Но я, как технолог, стараюсь выбирать рецептуры ванн без подогрева. Хим.окс.тп. - наше обозначение покрытия. "тп" - токопроводящее. Окраска от жёлтой до коричневой. |
|
Палладиевая мелодрама (ч. 2.2)
Palladium melodrama Металлизация изделий из пластика ABS, напечатанных на 3-D принтере
В соседнем цеху с палладием - невесело. Ради нескольких плат директор приказал сделать новую ванночку - на нее ушла куча хлорида палладия. А рабочие, обрабатывая платы, схалтурили - отказались выполнять распоряжение технолога. Результат: с качеством плат возникли проблемы. На что директор сказал технологу: "Будешь за свои деньги переделывать!" Угроза голословная, но технолог уже несколько месяцев, как ищет работу поспокойнее.
Когда она рассказала, что рабочие обнаглели и демонстративно отказались делать операции, как нужно, ответил, что я в подобной ситуации пообещал нашему гальванику прибить его на месте. При свидетелях. - Я бы могла прибить, но это слишком. Посмотрел на ее физические кондиции: действительно могла бы... В конце концов - обошлось. Платы сделали и сдали заказчику. На следующий день проблема с палладием возникла в нашем цеху. Гальваник сказал, что в ванне активатора (на линии металлизации пластика) палладий выпал в осадок. На приготовление ванны идет хлорид палладия, хлорид олова (II) и соляная кислота. Палладий в растворе находится в коллоидной форме, стабилизированный ионами олова. Именно коллоидные частицы ("кластеры") палладия садятся на поверхность пластика, обеспечивая электропроводность. Потом поверх частиц палладия наносят гальваническую медь, по ней - блестящий никель и хром. При нормальных обстоятельствах цвет раствора в ванне - темно-коричневый. Смотрю, а раствор в ванне прозрачный и почти бесцветный, как вода. И черный налет палладия на стенках (неравномерный). Отобрал на анализ - оттитрую хотя бы олово. От первых же капель йода - окраска. Олова там нет (двухвалентного).
Три месяца назад концентрация олова была 7.5 г/л, я откорректировал до 10 г/л. Потом - перерыв в работе линии металлизации - три месяца. Олова в растворе не осталось - по-видимому, окислилось кислородом воздуха. Нет олова (II) - палладий в осадке. Необратимо. Начальник дал мне указание, чтобы во время простоя раствор через день разогревали и перемешивали. - Рабочие это делали, не знаю, правда, насколько часто. Но что нужно корректировать олово во время простоя он не говорил (по мнению рабочих - сам не знал). Соседка по лаборатории - технолог цеха печатных плат (о которой я упомянул вначале) подтвердила, что т.н. "совмещенная ванна" - так там называют этот вариант палладиевого активатора - стабильна, если ее время от времени прогревать, перемешивать и корректировать олово (II). Спрашиваю у рабочих, корректировали ли мои предшественники олово во время простоя? - Нет. Было ли раньше, что палладий выпадал в осадок во время простоя? - Нет. Но было во время работы: приходишь утром, а ванна осела. Оказалось, что раньше таких долгих простоев не было вовсе: хоть немного, но линия работала. Теперь моя проблема - объяснить ситуацию начальнику. Линия металлизации - его любимая игрушка. Она нерентабельна и морально устарела. Сильно. Но начальник эти факты игнорирует. Будет крик и истерика. По просьбе гальваника отложил это до завтрашнего дня (от гальваника сегодня пахнет перегаром - кроме меня начальник может сделать виноватым и его). Угробленная ванна с палладием сошла с рук. Совсем-совсем... А с другой стороны - " не совсем..." Вечером того дня пришел начальник - пришлось ему сказать. Отреагировал спокойно, даже изобразил хорошее настроение. Но... Он принес две детали, напечатанные на 3-D принтере. Хочет, чтобы я их металлизировал. "Встретимся через 5 минут в конторе" - в комнате, где сидят его менеджеры. Они числятся технологами, но преимущественно - работают с заказчиками: ищут, принимают и отдают заказы, чтобы обеспечить цех работой. Плюс - занимаются золочением (не плат, - платы в другом цеху, - а декоративных изделий под заказ). Так вот, прихожу, говорю менеджеру, что ванна палладия накрылась. Он уже в курсе - бригадир гальваников сказал. Показывает мне детали и уточняет, что немцы такие детали месяц металлизировать пробовали - не получилось. Дело в том, что при печати на 3-D принтере пластмасса получается неравномерной - она не годится для металлизации. Пришел начальник и стал рассказывать про золотые горы. Про неудачи немцев тоже упомянул, но это - новый принтер, может с ним получится. Есть оборонное предприятие "Искра", они делают такие детали из металла, но хорошо было бы перейти на металлизированный пластик. Конечно, хорошо, только ванна палладия накрылась - новую придется готовить в стакане, а весь процесс делать - в лаборатории. Точнее - часть операций - на линии (травление в хромовке), промывка, а остальное - в лаборатории: "кюлинг" (аналог ванны "химическая медь"), палладиевый активатор и ванна гальванической меди. На все - два дня. Палладий, чтобы приготовить ванну активатора в лаборатории? Пол-литра готового концентрата для приготовления ванны активатора было, но я уже месяц не проверял: не осел ли в нем палладий на дно? Новый приготовить - нужен хлорид палладия. Есть в наличие? Да: у Коли было 10 г. Коля - сын этого начальника, один из менеджеров. Когда я сказал - он чуть не обделался. Уточнил, что получил у кладовщицы и отдал Коле. Оказалось, что эти "10 г" идут совсем в другое место - он передал их и оформил бумаги, как положено. Все облегченно вздохнули. Чтобы разрядить ситуацию, начальник дал менеджерам несколько указаний насчет учета золота. Вчера истек первый день срока. Я попросил рабочих нагреть ванну травления, принес в лабораторию растворы из ванны гальванической меди и ванны "химической меди" ("кюлинг" - Cu-Link), рассчитал приготовление палладиевого активатора, но работу так и не начал. Весь день провозился на гальванике - готовил новую ванну желтой пассивации цинка. Кстати, с расчетами - как готовить ванну активатора из приготовленного мной ранее концентрата, - провозился долго. Рецепт явно не соответствует оригинальному (рецепту немецкой фирмы): в нем больше олова и меньше палладия, чем должно быть в ванне. Корректировать ванну таким концентратом можно, готовить новую из него - нет. Решил не морочить себе голову и посчитал все по регламенту: сколько миллилитров солянки, сколько концентрата (палладий + олово), сколько воды. Концентрация не соответствует? Ну и что. Металлизация и так вряд ли получится. Подвеску для детали подобрали. Пошел на линию травить пластик в хромовой смеси (точнее - это не хромовая смесь, а ее аналог: серная кислота и хромовый ангидрид). Начальник сказал попробовать сначала 1 минуту, потом - 3. Сразу погрузил на 3 минуты, чтобы увеличить вероятность успеха. Вынимаю - даже визуально (без микроскопа) видно, что поверхность стала рельефной - пластик вытравило слишком сильно. Суть процесса в том, что пластик ABS состоит из трех полимеров - акрилонитрил, бутадиен и стирол. В сернокислом растворе хромового ангидрида вытравливается только бутадиеновый каучук (не полистирол и не полиакрилонитрил), в результате на поверхности остаются микроскопические ямки, куда потом и садятся частицы палладия. Но ямки должны быть микроскопическими, а тут их видно даже невооруженным глазом. Вторая неприятность. После ванны травления пластика - промывка от шестивалентного хрома. В случае попадания он губит палладиевый активатор. Поэтому пластик сначала промывают в воде, потом - в растворе хлорида гидроксиламина (восстанавливает остатки шестивалентного хрома до трехвалентного), снова в воде, в конце - в слабой соляной кислоте. Промываю-промываю, держу деталь в растворах, а только достань - вода на ее поверхности становится желтой. Хром (VI) не уходит. Уже вроде бы отмыл, несу в лабораторию в кружке со слабой соляной кислотой. Позвонил менеджер. Поставил кружку на пол, ответил на звонок. Поднимаю - а вода в кружке желтая. Вернулся, снова промыл, как мог. В лаборатории нагрел палладиевый активатор до рабочей температуры. Металлический палладий начал выпадать в осадок (черный порошок такой). Думаю, из-за нарушения рецептуры - избыток двухвалентного олова. Ну и бог с ним [1]. Пытаюсь погрузить пластиковую деталь с подвеской в стакан с активатором - не пролазит. Пришлось использовать принесенную кружку. Перелил активатор, выдержал деталь подольше. Поверхность детали - без изменений. Значит - не получилось. Когда палладий садится, на поверхности пластика видно серую пленку, но не в этом случае. Для очистки совести вынимаю деталь из палладиевого активатора и выдерживаю в ванне "кюлинг" (сульфат меди и винная кислота в большом избытке гидроксидов натрия и лития - аналог ванны "химической меди"). Потом - погружаю в ванну электрохимической меди. Даю ток - сначала 2А, потом - 6. Эффект нулевой. Выдержал, понял, что не получается, - позвонил начальнику. Сообщил: результат отрицательный. Он не удивился и сказал, что с изделиями, которые напечатаны 3-D принтере, только один из экспериментов получился, остальные попытки (а их было много) - провалы. -Хром не хочет отмываться? Потому что пластик сильно растравлен? Не потому. Пластик напечатан на 3-D принтере. Он, как ткань. - Имеет пористую структуру? - Да. ... После звонка начальнику обнаружил, что блок питания во время нанесения гальванического меднения был выключен: напряжение на электродах нулевое. Для очистки совести включил блок, выдержал 10 минут. Напряжение через ячейку стало около 2 В. Результат: не так чтобы совсем ничего, но пластик абсолютно не покрылся. Зато медью покрылись контакты подвески: в тех местах, где не было изоляции, выросли миниатюрные медные самородки. На этом - все. Отдал деталь менеджеру, чтобы он вернул ее заказчику. Менеджер совсем не удивился нулевому результату. Гальваники - тоже: к "творческим экспериментам" они уже привыкли, но полюбить их не смогли (труда много, а результат, как правило, нулевой). __________________________________________________ 1 Позже оказалось, что причина разложения палладиевого активтаора другая: "олово не виновато". Подробнее - см. продолжение истории [ссылка]. |

Рецепт приготовления ванны палладиевого активатора из немецкого концентрата. Я использовало "home-made" аналог |

Подвеска и деталь |

|

Слева: ванночка с электролитом гальванической меди, далее - бутылка с концентратом для приготовления ванны палладиевого активатора и стакан с "кюлингом" - аналогом ванны "химической меди" |

|

Соляная кислота для приготовления ванны активатора |

Приготовление ванны палладиевого активатора металлизации пластика |

|

|

|

|

Ванна травления деталей из пластика ABS (линия металлизации) |

|

|

Промывка детали после травления |

Деталь после травления и частичной промывки |

|

Нагрев палладиевого активатора до рабочей температуры 40°С |

Деталь с подвеской в слабом растворе соляной кислоты (так я принес ее с линии в лабораторию) |

Обработка пластика в ванне палладиевого активатора металлизации |

|

Дальше - ванна "кюлинг" (Cu-Link) |

|

Ванночка гальванической меди - попытка нанесения покрытия |

|

|
|
На этом все интересное не закончилось.
Продолжение истории с металлизацией пластика в лаборатории - см. в статье: Металлизация пластика - наше все. Metallization of plastic [ссылка]
"Не та" винная кислота (ч. 2.3)
Винная кислота необходима для приготовления одной из ванн на линии металлизации пластика ABS. А именно ванны, которая имеет коммерческое название "Cu-Link" ("связывание с помощью меди"). Это аналог ванны "химической меди" с той разницей, что сама металлическая медь в этой ванне не образуется, просто идет "замещение ионов двухвалентного олова на ионы меди" на поверхности частиц палладия. Про эту ванну - ее анализ и приготовление - я уже немного писал (см. ''Химическая медь''. ''Electroless copper'' [ссылка]).
"Wrong" tartaric acid Ванну представляет собой раствор комплекса двухвалентной меди с винной кислотой в крепком растворе щелочи (гидроксиды натрия и лития). У нас ее готовят из двух растворов. Раствор "A"- сульфат меди, L-винная кислотаи серная кислота и раствор "B" - гидроксид натрия с гидроксидом лития. Это - первый вариант немецкой технологии металлизации, а на данный момент существует уже четвертый вариант. Что с вторым вариантом - не знаю, зато концентраты для приготовления ванны по третьему варианту фирма выпускать перестала. Нашему предприятию от этого - ни жарко, ни холодно (т.к. у нас стоит - "первый вариант"), но один из заводов "залетел". Им для работы нужны растворы "А" и "B" - для "третьего варианта" ванны Cu-Link. Они не такие, как в "первом", "втором" или "четвертом" вариантах и эти растворы уже не выпускают. Состав растворов - примерно известен (существует коммерческая тайна, но существует и химический анализ). Вопрос, как их приготовить, чтобы концентраты были "идентичными натуральным". С раствором "В" проблем не возникло - щелочь, она и в Африке щелочь (не знаю, какая там у них: только гидроксид лития или смесь гидроксидов лития и натрия, как у нас). Зато с раствором "А" - интереснее. У нас он - сернокислотный (сульфат меди, L-винная кислота, серная кислота), у них - сильнощелочной (L-винная кислота, сульфат меди и гидроксид лития). До меня попробовали смешать компоненты - получили сине-фиолетовый раствор, из которого выпал осадок красного цвета - решили, что это металлическая медь. Я - не поверил: металлическая медь без восстановителя образовываться из тартратного (виннокислого) комплекса не будет. Кстати, восстановитель нужен хороший - вроде формальдегида. Красный осадок? Оксид меди (I). И вообще, в чем проблема? Декантируйте раствор с осадка и забудьте. Концентрация меди в растворе упадет? Осадка много? Нет - мало. Значит - нестрашно: это - технический концентрат, а не титрованный раствор для объемного анализа. А если еще выпадет? Так подержите на складе пару дней. Нет, я понимаю, что вам интересно приготовить и сразу же продать, но вы в курсе, сколько оригинальный продут стоял у немцев? Может и они выдерживают перед тем, как расфасовать по канистрам. Принесли в лабораторию канистру. Красный осадок действительно был, его количество я бы охарактеризовал как "легкий налет на дне". Пробуем приготовить аналогичные растворы. Ограничение: суммарный объем раствора не должен превышать такую-то величину. Но в каком порядке растворять вещества и смешивать растворы? Это не математика, где: "от перестановки слагаемых сумма не меняется", например, 5 + 6 = 6 + 5. Зато в химии результат еще как меняется - от изменения последовательности прибавления веществ. |

Канистра с раствором "Cu-Link" ("связывание с помощью меди") - аналог ванны "химической меди". На дне - небольшой осадок. Из-за его образования - все наши эксперименты
|

Исходные вещества для приготовления ванны (разные варианты составов) |

|

|
|
Тем временем, я вспоминаю задачу из школьного сборника Я.Л. Гольдфарб, Ю.В. Ходаков Сборник задач и упражнений по химии для средней школы: Учебное пособие для учащихся (1981)- С.124, задача 15-181 [ссылка].
Чтобы найти эту задачу, пересмотрел большую половину сборника. Хороший задачник - высокого уровня. Лирическое отступление: вот только эти похвалы нельзя перенести на школьную систему образования, в т.ч. и ту, что была во времена, когда была издана эта книга. Равнодушные, а нередко - психически-неуравновешенные учителя, ярко выраженный "синдром вахтера" у некоторых из них, скучные уроки, нервное напряжение, масса бесполезной и оторванной от жизни информации, большие объемы домашнего задания, "построения и завывание" на школьных линейках - словно ты уже в армии... Мой коллега просто убегал с уроков кататься на "велике", я - пытался заболеть, причем не просто симулировал болезнь, а ел лед, старался, чтобы продуло... Потом - неделями валялся по больницам. Все это не от лени, а из-за отвращения к такому "храму знаний". "Школьные годы чудесные": доступ к реактивам - ограничен провинциальным хозмагом, фотомагазином и аптекой, доступ к посуде - пробирками и нетермостойкими стаканчиками, нагрев - таблетка сухого спирта. Книги - только те, которые были в библиотеках провинциального городка. Интернет, электронные книги? До них еще оставалось лет 10-15. |
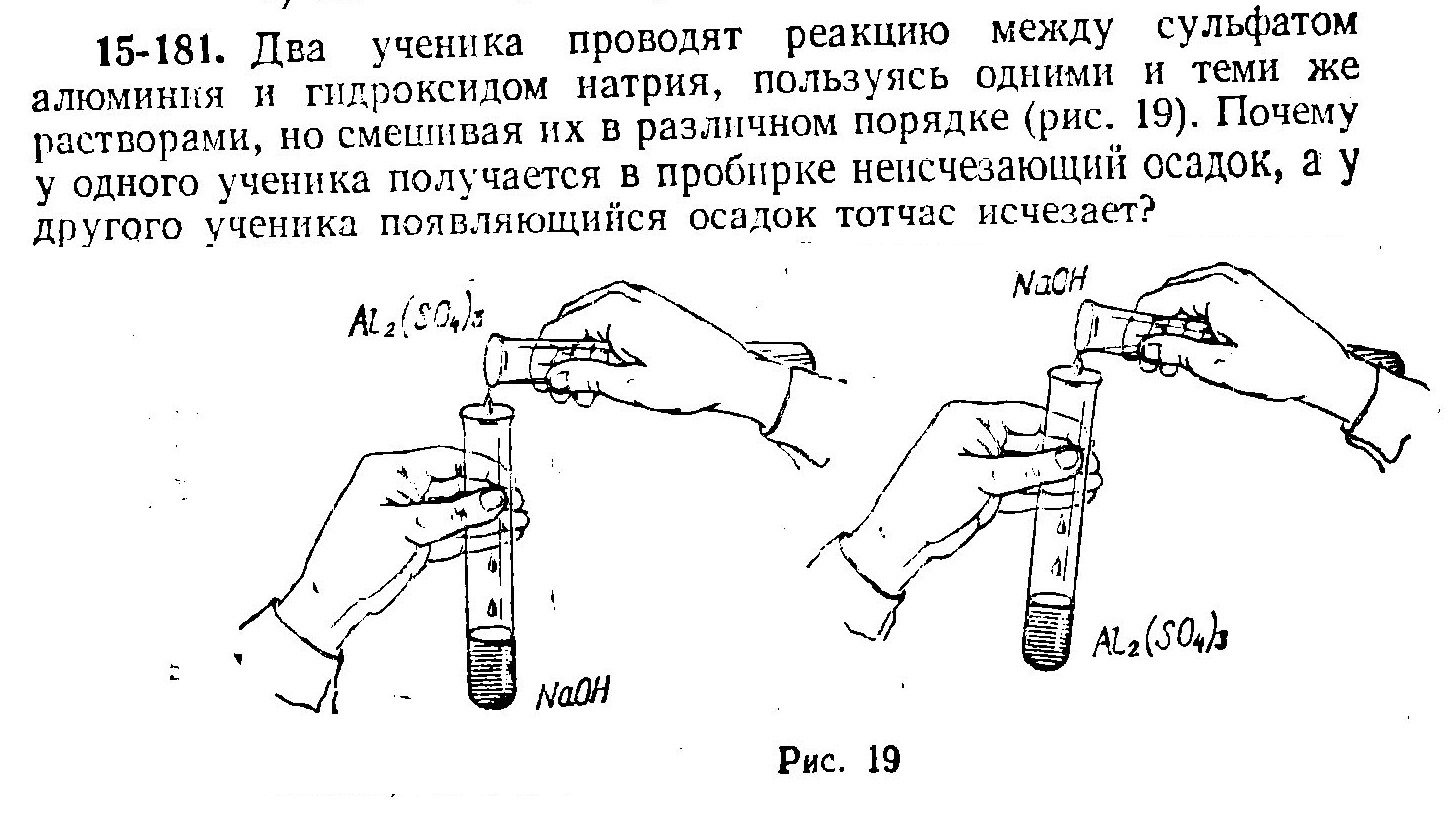
|
|
Но не будем о грустном. Итак, по аналоги со школьной задачей. Если раствор гидроксида лития вылить в сульфат меди, выпадет осадок гидроксида меди. В избытке щелочи этот осадок должен раствориться, но не все так просто... При нагреве гидроксид меди (II) распадается до черного оксида - он в щелочи нерастворим. Откуда нагрев? - Тепло реакции. Да и сам гидроксид меди (II) не очень-то в щелочи растворяется. В книгах пишут, что да - растворяется, а на практике я этого не наблюдал. Дашь крепкую щелочь в избытке - выпадает черный оксид меди, в более разбавленной щелочи - растворяться не хочет. По-видимому, для растворения нужны специфические условия. Чтобы меньше заниматься "спецификой", нужно не только поступить наоборот - лить сульфат меди в гидроксид лития, но и предварительно смешать гидроксид лития с винной кислотой - она играет роль лиганда, который дает комплекс с медью. Объем раствора ограничен? Давайте растворим твердую винную кислоту не в воде, а в растворе гидроксида лития. Потом - добавим к ней раствор сульфата меди - небольшими порциями при хорошем перемешивании. Кстати, винная кислота бывает разная. Согласно рецепта того раствора, что используется у нас (первый вариант технологии), идет L-винная кислота. Мой предшественник настаивал, что для ванны "химической меди" (точнее "квазихимической меди") подходит только L-винная кислота. И это не просто так: L-винная кислота хорошо и быстро растворяется в воде. В ее случае не обязательно проводить "совместное растворение" винной кислоты и гидроксида лития в одной порции воды. У нас большое количество L-винной кислоты быстро растворилось в небольшом количестве воды. Технолог фирмы, которая продает добавки, не согласен, что нужна именно L-винная кислота. Он принес D,L-винную кислоту. Какая разница? Выяснилось, что в воде эта кислота растворяется медленнее и гораздо хуже, чем L-винная кислота. При попытке растворить ее просто в воде, технолог грел-грел стакан, но на дне так и остался осадок D,L-винной кислоты - содержимое пришлось вылить. Тогда я и придумал "совместное растворение" - сначала гидроксид лития, потом - винная кислота. Помогло, но осадок выпал и в этом случае (тартрат лития). Добавили чуть больше воды, размешали - тратрат растворился, но пришлось понервничать. Выливаем раствор сульфата меди в гидроксид лития с винной кислотой (кстати, сам раствор сульфата меди пришлось профильтровать - от зеленого осадка основных сульфатов). Сначала - мутная смесь, а потом - все растворилось. Цвет - сине-фиолетовый, чем напоминает "натуральный" (точнее - "оригинальный") раствор. Выпадет ли осадок оксида меди (I) Cu2O при стоянии раствора? - Посмотрим. Приготовили несколько вариантов: из L-винной кислоты, из D,L-винной кислоты - с разным соотношением компонентов. Начальник очень долго сверял оттенки разных вариантов растворов. Брал оригинальный раствор, брал разные варианты, приготовленные нами. Смотрел: где цвет более фиолетовый и менее синий, где - менее фиолетовый и более синий... Ну и... Оказалось, что не на цвета и оттенки нужно было смотреть.А на самое дно колбы... И не сразу, а со временем. На следующий день во всех колбах образовался желтый осадок. Гидроксид меди (I) - CuOH, еще через день он стал красным: гидроксид перешел в оксид Cu2O. Исключением была только одна колба с рН=11.6: в ней был максимальный избыток гидроксида лития - здесь осадок не выпал. В других колбах (в которых образовался осадок) среда была менее щелочной. Позже выяснилось, что рН оригинального раствора должен быть не меньше 11.5. |

Приготовление разных вариантов раствора аналога "химической меди" |

|

|

|

|

|

|

D,L-винная кислота и L-винная кислота |

В большинстве колб при стоянии выпал желтый осадок гидроксида меди (I), CuOH |

|

|

|

|

|

Фильтрование осадка гидроксида меди (I), CuOH (это не помогло - при стоянии осадок продолжил выпадать) |

|

Измерение и коррекция рН (а это помогло - если рН был достаточно высокий, осадок при стоянии не выпадал) |

|

|
|
Приготовили - вылили - забыли. Только один раствор - тот, что без осадка,- стоит, но и его нужно будет вылить. Думал, что с этими" D,L-фокусами" я больше не столкнусь. Как бы не так...
"Третий вариант" технологии - хорошо, но у нас стоит первый. И нужно постоянно готовить растворы для коррекции ванны. Рецепт - известен хорошо, но компоненты - нужно время от времени заказывать. В числе прочего заказал L-винную кислоту. Купили D,L. Сразу увидел, что реактив не тот, но не стал жаловаться. Уже знал, что из-за плохой растворимости D,L-винной кислоты будет лишняя морока, но это некритично. Или критично? Вдруг растворимости D,L-винной кислоты в воде не хватит, чтобы приготовить концентрат по рецептуре, написанной для L-винной кислоты? А там ведь еще содержится сульфат меди и серная кислота - они могут уменьшить и так недостаточную растворимость D,L-винной кислоты. Посмотрел в "Химической энциклопедии" растворимость винных кислот и узнал много интересного... D,L-Винная кислота (виноградная кислота) из воды кристаллизуется в виде дигидрата 2С4Н6О6·2Н2О; растворимость дигидрата (г в 100 г воды) - 20.6. Зато D-Винная кислота (виннокаменная кислота, винная кислота) имеет растворимость - 139.44 (при 25°С). Для L-винной кислоты растворимость не указана, по-видимому, она такая же (или примерно такая), как уD-винной кислоты. Т.е., D,L-винная кислота растворяется в воде намного хуже, чем чистая D- или L-винная кислоты. Хватит ли растворимостиD,L-кислоты, чтобы соблюсти рецептуру? Посчитал - хватит, но на грани. Плохо. А что мешает мне добавить при растворении больше воды (и потом учесть при коррекции ванны, что концентрат я приготовил более разбавленный)? Или дать, например, 2/3 нормы винной кислоты в виде плохо растворимой D,L-формы, а оставшуюся 1/3 добавить в форме хорошо растворимой L-винной кислоты (благо, килограмм L-винной кислоты еще остался). Но главное, что я узнал из химической энциклопедии. L-винную кислоту получают расщеплением виноградной кислоты (она же - D,L-винная кислота). По-видимому, из всех упомянутых изомеров винной кислоты L-форма самая дорогая - отсюда стремление заменить ее на более дешевую D,L-винную кислоту, не считаясь с ее растворимостью. |

Вместо L-винной кислоты купили D,L-винную кислоту - это не ошибка, просто D,L-винная кислота дешевле. Выписали бы себе путевку - не в санаторий, а в крематорий - так тоже дешевле...
|

|

|
|
Кстати, давно возник вопрос: зачем для приготовления этой ванны используют гидроксид лития (или смесь гидроксидов лития и натрия - для технологии "первого поколения"), если можно использовать более дешевый гидроксид натрия? "Официального" ответа я не знаю, но думаю, что дело в низкой растворимости карбоната лития - он, в отличие от карбонатов натрия и калия, плохо растворим в воде. Сильнощелочной раствор в ванне (рН>13) активно поглощает углекислый газ из воздуха. В результате в растворе накапливались бы карбонаты - если использовать гидроксид натрия, но в случае гидроксида лития или смеси гидроксидов лития и натрия карбонат лития выпадает в осадок и не накапливается в растворе. В этом я лишний раз убедился, пока проводил манипуляции с остатком раствора, который принесли в канистре: объем маленький, а поверхность - большая. В результате буквально на глазах образовался белый осадок Li2CO3. Я его отфильтровал и промыл на фильтре.
Кстати, видели бы вы, как я наклонил 10-л канистру горизонтально, поднес ее к лицу и заглянул в горлышко, пытаясь рассмотреть осадок карбоната лития. рН раствора - почти 13. Пару капель такого раствора в глаза могли привести к слепоте, я это понимал, но любопытство оказалось сильнее... |
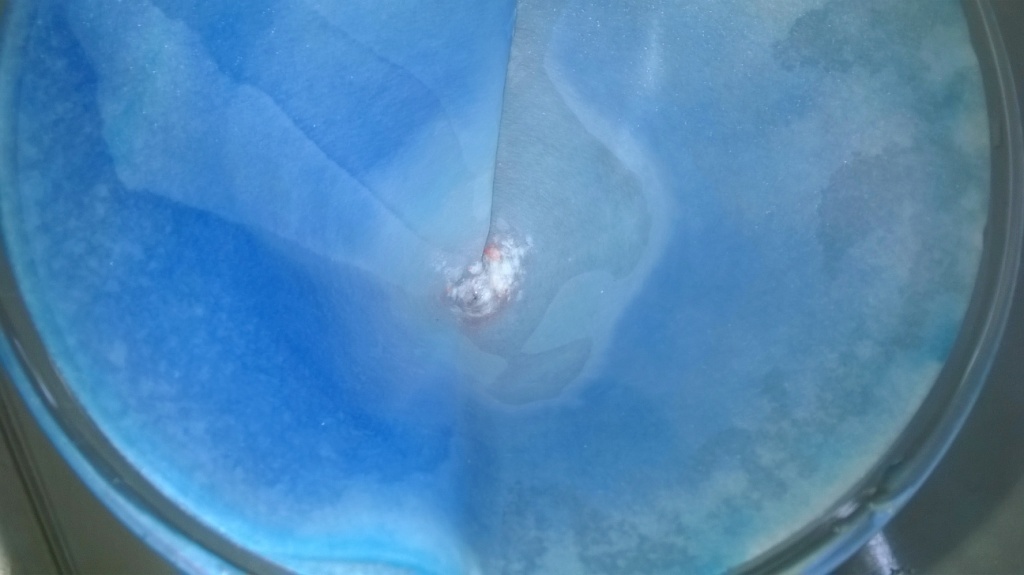
Карбонат лития, который образовался при контакте раствора с воздухом |
|
А зачем вообще все эти "усовершенствования" состава ванны Cu-Link - от "первого" - до "четвертого" варианта? С целью экономии палладия в предыдущей ванне - ванне палладиевого активатора металлизации пластика. Варьируя состав ванны Cu-Link, можно уменьшить необходимую концентрацию палладия в активаторе, чем сэкономить драгоценный металл. Именно стоимость палладия составляет львиную долю себестоимости металлизации. Причем палладий теряется безвозвратно.
Если вам интересны свойства винных кислот - приведу статью из химической энциклопедии полностью. ВИННЫЕ КИСЛОТЫ (дигидроксиянтарные к-ты), мол. м. 150,09; бесцв. кристаллы. Существует в виде трех стереоизомеров и рацемата (виноградной к-ты; см. ниже): 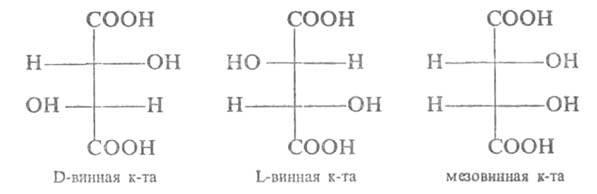 D-Винная к-та (виннокаменная к-та, винная к-та) - т. пл. 170°С; d420 1,7598; [α]20D+11,98° (Н2О), [α]20D +0,46° (СН3ОН); K1 1,3*10-3, К2 6,9*10-5 (25°С); р-римость (г в 100 г р-рителя): в воде-139,44, этаноле - 20,40 (18°С); раств. в ацетоне. При пиролизе D-винной к-ты образуются пировиноградная СН3СОСООН и пировинная (метилянтарная) НООССН(СН3)СН2СООН к-ты, СО2. Она восстанавливается до янтарной к-ты, восстанавливает аммиачный р-р AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего р-ра - реактива Фелинга. Получают D-винную к-ту действием минер. к-т на ее кислую К-соль (винный камень), образующуюся при брожении виноградного сока. D-Винную к-ту применяют в пищ. пром-сти, медицине, для произ-ва ее эфиров и солей, наз. тартратами. О применении последних см. таблицу.  D,L-Винная к-та (виноградная к-та) из воды кристаллизуется в виде дигидрата 2С4Н6О6*2Н2О (т. пл. 73 °С), из спирта-в безводной форме (т. пл. 205°С); К1 1,02*10-3, К2 4,0*10-5 (25 °С); р-римость дигидрата (г в 100 г р-рителя): в воде - 20,6, этаноле - 2,08 (15°С), эфире - 1,08. При нагр. до 130°С с соляной к-той виноградная к-та частично превращ. в мезовинную. Виноградная к-та образуется в смеси с мезовинной при кипячении р-ра D-винной к-ты со щелочью, при окислении фумаровой или сорбиновой к-ты действием КМnО4, при восстановлении глиоксиловой к-ты Zn в уксусной к-те. Мезовинная к-та (антивинная к-та) - т.пл. 140°С; d420 1,666; K1 6,0*10-4, К2 1,4*10-5 (25°С). Образует моногидрат С4Н6О6*Н2О; р-римость в 100 г воды 125 г. Кислая К-соль мезовинной к-ты очень хорошо раств. в воде. Образуется мезовинная к-та при продолжит. кипячении всех форм винных кислот в р-рах едких щелочей, при окислении малеиновой к-ты (КМnО4 либо OsO4) или фенола (КМnО4). L-Винную к-ту получают расщеплением виноградной к-ты. |
|
Комментарии
К4
Общеизвестно, что исходным сырьём для промышленного получения реактивов винной кислоты и её солей является отход виноделия - винный камень, основной компонент которого - битартрат калия. И промежуточные очистки проводят через этот битартрат в связи с его малой растворимостью.
К5 По английски винный камень обзывается Cream of tartar. В кулинарных рецептах его как правило не переводят, что приводит к появлению таких словосочетаний как «крем тартар», «кремортартар», «кремор тартари». Входит в состав пекарских порошков (baker's powders). К5-1 В древней мифологии Тартар - "нижнее небо" - темная бездна под Аидом - подземным царством мертвых. Аид - прообраз христианского ада. Имя бога подземного царства (которое совпадает с названием самого царства) - Аид вселяло в древних такой страх, что его заменяли иносказаниями (Плутон, например). И под всем этим зиял Тартар. Интересная кулинария... К6 А что, сегнетова соль никак не подойдет (вместо винной кислоты)? В конечном растворе есть NaOH, а значит соль разложится до кислоты, надо только изменить пропорции NaOH. К6-1 Насчет сегнетовой соли - так делали, но только если не было винной кислоты. |