Химия и Химики № 2 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2022 Журнал Химиков-Энтузиастов |
Получение серного ангидрида SO3 взаимодействием фосфорного ангидрида P4O10 с концентрированной серной кислотой (с разными вариантами аппаратуры) Obtaining of sulfuric anhydride SO3 by interaction of phosphoric anhydride P4O10 with concentrated sulfuric acid Максим |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Введение
Первоначальной целью данной работы было "посмотреть" на серный ангидрид -вещество, которое, с одной стороны, является промежуточным продуктом крупнотоннажного промышленного синтеза, а с другой, абсолютное большинство химиков знакомы с серным ангидридом только по учебникам. В ходе работы возникла также задача подобрать такую установку, которая будет удобной для получения весомых количеств SO3. В связи с этим было проведено 3 синтеза - с разным аппаратурным оформлением. Способов получения серного ангидрида в лаборатории есть несколько. Один из них, детально описанный в журнале за 2009 г. [1], пиролизом кислого сульфата натрия NaHSO4, интересен, но требует подходящей муфельной печи, которой не имелось, а также довольно продолжительного времени (около 5-ти часов). Было предпринято несколько пробных попыток пиролиза пероксодисульфата натрия Na2S2O8, который, как было замечено, при умеренном нагревании разлагается с выделением не только кислорода по реакции: Na2S2O8 → Na2S2O7 + 1/2O2, но также следовых количеств SO3. Однако получить весовые количества серного ангидрида не удалось. После неудачных опытов по пиролизу пероксодисульфата натрия внимание привлекла иллюстрация из лабораторного практикума, где был изображен процесс получения SO3 в простой установке: в реторте нагревается горелкой смесь фосфорного ангидрида P2O5 и серной кислоты; отвод реторты погружен в пробирку, помещенную в охлаждающую смесь; в пробирке собирается SO3. Несмотря на то, что описания самого процесса не имелось, он представлялся понятным. P2O5 (он же P4O10) - очень сильный дегидратирующий агент, и он способен, в определенных условиях, отнять воду у серной кислоты. Химия процесса представляется следующей: P2O5 + H2SO4 = SO3 + 2HPO3 Очевидно, что при взаимодействии с таким сильным конкурентом за молекулу воды, как H2SO4, гидратация P2O5 (P4O10) пойдет не далее 1-й ступени, что нужно учесть при расчете. Обычная концентрированная серная кислота пл. 1.80-1.83 содержит воду, которая также будет связываться: P2O5 + H2O = 2HPO3 В присутствии образующегося олеума гидратация по 2-й ступени до H3PO4, очевидно, практически происходить не будет. Исходя из этого делаем материальный расчет (на 20 г целевого SO3). 1) дегидратация H2SO4:
2) связывание воды в концентрированной серной кислоте:
Таким образом, нам потребуется: P4O10 - 45 г (с запасом против расчетов - прим. ред.) H2SO4 - 20 мл
__________________________________________________ 1 См. статью: Получение серного ангидрида и олеума [ссылка]
Выполнение
Опыт №1Температура в помещении 22°С, влажность 45%. В реторту на 250 мл через тубус засыпали 45 г P4O10 (рыхлый белый порошок). Затем влили 20 мл серной кислоты. После вливания кислоты реакционная масса нагрелась, а из реторты стали выделяться характерные белые пары. На время сборки установки отвод реторты заткнули куском минеральной ваты (обычная строительная минеральная вата). Масса в колбе немного потемнела из-за примеси окисленной органики (со шлифа и т.п.). |

Фото 1. Опыт 1. Установка в сборе до начала нагревания |
|
Собрали установку, показанную на фото. Приемную пробирку максимально "притерли" к отводу реторты. В чашку для охлаждения поместили снег с улицы и добавили воду. Температура охлаждающей смеси 1-2°С. Работа проводилась в вытяжном шкафу, что оказалось весьма предусмотрительным из-за регулярного выброса белого тумана.
Зажгли горелку. Буквально через 20-30 с из стыка между отводом реторты и пробиркой стал выделяться белый туман, весьма интенсивно, реакционная масса запузырилась. Горелку пришлось погасить, дать установке немного остыть до прекращения выделения тумана, затем снова нагреть. |

Фото 2. Опыт 1. Начало выделения серного ангидрида SO3 в приемник после небольшого нагрева |
|
В итоге весь процесс был разделен не серию коротких нагреваний - остываний, для снижения утечки тумана через стык сосудов. Примерно после 2-го нагревания в пробирке образовался белый налет, который по мере накопления вещества превратился в снегообразную кристаллическую рыхлую массу.
|

Фото 3. Опыт 1. Серный ангидрид SO3 в виде снегообразной массы в приемнике |
|
При этом с кончика отвода реторты в пробирку иногда капала жидкость. При нагреве реакционная масса быстро "вскипала" с выделением газа, но в целом процесс шел весьма спокойно (с учетом периодических охлаждений). Синтез продолжали примерно 20-25 минут, до образования заметного объема твердой кристаллической фазы в реторте и накопления в приемнике примерно на 2/5 высоты белого вещества (собиравшегося кольцеобразно на внутренней поверхности пробирки).
|

Фото 4. Опыт 1. Установка в конце опыта |
|
Температура охлаждающей смеси 1-2°С. Температура реакционной массы, очевидно, не превышала 100-150°С, что недостаточно для возгонки P4O10, кроме того, почти весь P2O5 постепенно смешался с жидкостью. Таким образом, можно предполагать, что в пробирке собрался достаточно чистый серный ангидрид SO3.
При разборке установки из всех отверстий интенсивно выходил белый туман. Приемную пробирку сперва накрыли бюксом, затем заткнули минеральной ватой и обмотали белой сантехнической ФУМ-лентой. |

Фото 5. Опыт 1. Разборка установки. Белый "дым" из реторты |
|
При погружении пробирки в воду с температурой 24°С на стенках масса оплавилась, но нагревать дальше не стали из-за нехватки времени и негерметичности сосуда. Реторту охладили и временно заткнули минеральной ватой.
На следующий день реторту аккуратно отмыли небольшими порциями воды на открытом воздухе (выделилось много белого тумана), а пробирку загерметизировали и убрали на хранение. |

Фото 6. Опыт 1. Собранный серный ангидрид SO3 в приемнике |
|
Хотя исследованный способ получения серного ангидрида SO3 дал вполне удовлетворительный результат по целевому веществу, он обнаружил существенный недостаток - сильную утечку паров SO3 при самом незначительном перегреве реакционной массы, что понятно, учитывая негерметичность установки и слабое охлаждение.
В связи с этим было решено попробовать провести синтез в установке с воздушным и обратным холодильниками и круглой колбе бОльшего объема в качестве приемника. Опыт №2 Была собрана вот такая установка. |

Фото 7. Опыт 2. Установка в сборе перед началом опыта |
|
Температура в помещении 22°С, влажность около 45% в помещении (но, вероятно, более 40-50% в шкафу, в котором собрана установка).
Прямой холодильник слева предназначался для воздушного охлаждения (достаточно было бы просто толстой трубки). Охлаждение водой казалось вредным, т.к. могло привести к осаждению твердого SO3, и закупорке просвета трубки. В качестве приемника взята трехгорлая круглая колба на 250 мл (можно было взять 2-горлую, но таковой в наличии не было). Обратный холодильник с водяным охлаждением. Выход из холодильника оставили открытым, что, возможно, было ошибкой. Лучше было бы соединить его подходящей трубкой с емкостью с осушителем воздуха, но без погружения в жидкость, чтобы не создавать сопротивление току газа в установке (для этой цели используют хлоркальциевые трубки с осушителем - прим. ред.). Как и в предыдущем опыте, использовали порошкообразный фосфорный ангидрид (46 г) и серную кислоту пл. 1.82 (19 мл). |

Фото 8. Опыт 2. Фосфорный ангидрид и концентрированная серная кислота (92-94%) |
|
Фосфорный ангидрид засыпали в колбу и в вытяжном шкафу, при охлаждении в миске со снегом, прилили серную кислоту (при смешивании композиция разогревается и тут же начинается выделение тумана, поэтому лучше эту операцию производить уже под тягой и быстро присоединить колбу к установке или закрыть пробкой).
В чашку под приемником налили воду + положили снег (температура 1-2°С). Пустили ток воды в обратный холодильник и начали очень осторожный нагрев небольшим пламенем низко расположенной горелки. Как и в предыдущем опыте, сперва в реакционной колбе и приемнике возник туман, который вскоре рассеялся. Реакционная смесь начала плавиться и местами слабо кипеть. |

Фото 9. Опыт 2. Реакционная масса при нагревании |
|
В приемнике стал обнаруживаться налет в виде белой массы (с левой стороны - на входе в приемник).
Нагрев по мере протекания реакции понемногу увеличили. При этом в установке начали наблюдаться, на первый взгляд, непонятные явления: время от времени возникали легкие гидравлические удары и образование обильного тумана, который частично выходил через обратный холодильник. Вскоре стало ясно, что причиной являются отдельные капли водяного конденсата, образующиеся в спирали обратного холодильника, видимо, из атмосферного воздуха (что, в принципе, представлялось возможным). Попадание капли воды на твердый серный ангидрид SO3 вызывает мгновенное вскипание жидкости с выбросом обильного тумана. |

Фото 10. Опыт 2. Приемник в процессе опыта. Слева виден нарост серного ангидрида SO3 на входе в приемник. Туман в колбе из-за проникновения капель воды из обратного холодильника |
|
Через некоторое время на конце воздушного холодильника образовался отросток из твердого SO3, который постепенно увеличивался в объеме. (Это, в том числе, указывало на то, что водяной конденсат попадал в установку не со стороны реактора, а со стороны обратного холодильника). Расплавить воздушным феном снаружи нарост не удалось (стекло плохо проводит тепло, и оно в этом месте толстое), но при этом образовывалось много ненужного белого тумана на выходе из установки. Очевидно, для данного объема и мощности нагрева реактора длина воздушного холодильника была избыточной, т.к. SO3 затвердевал преждевременно.
Нагревание вели еще некоторое время до заметного снижения выделения газа в реакторе (до полного прекращения выделения пузырьков доводить не стали, опасаясь закупоривания отвода воздушного холодильника и риска разгерметизации установки). При этом в реакционной массе остался небольшой комок фосфорного ангидрида, который так и не растворился в жидкости. |

Фото 11. Опыт 2. Вид реакционной массы в конце опыта |
|
Всего процесс продолжался около 40 минут. На выходе получили:
1) Полужидкий плав в реакционной колбе с комком непрореагировавшего фосфорного ангидрида; 2) Застывший комок серного ангидрида, прилипший к отводу воздушного холодильника; 3) Кристаллическую массу, похожую на лед, на стенках приемной колбы (видимо, твердый раствор SO3 в олеуме, возникший вследствие попавшей из обратного холодильника воды) + немного рыхлого серного ангидрида SO3 на стенках колбы. Установку охладили и начали разбирать. Все детали при рассоединении очень сильно дымят - чем ближе деталь к реактору - тем сильнее. Главной проблемой было как-то отделить кусок SO3 от прямого холодильника, к концу которого SO3 прилип. Локальный нагрев феном ничем не помог, только вызвал выброс белого тумана. В итоге холодильник с некоторым усилием извлекли из колбы вращательными движениями, вставили в пришлифованную пробирку и после этого очень длинной стеклянной трубкой, пропущенной через холодильник, вытолкнули кусок SO3 в пробирку (возможно, благодаря частичному оплавлению при нагреве феном он отделился очень легко). Для очистки отвод холодильника погрузили в стакан с водой и затем сверху еще вливали воду - по всему объему холодильника наблюдалось образование тумана и постепенное его поглощение. Отвод реакционной колбы заткнули минеральной ватой. Приемная колба увеличилась по массе примерно на 6 г, но с учетом некоторого количества растворенной воды. В пробирке ориентировочно еще 3 г. твердого вещества. Общий выход, таким образом, невелик, но для поискового синтеза без использования опробованной методики это удовлетворительно. |
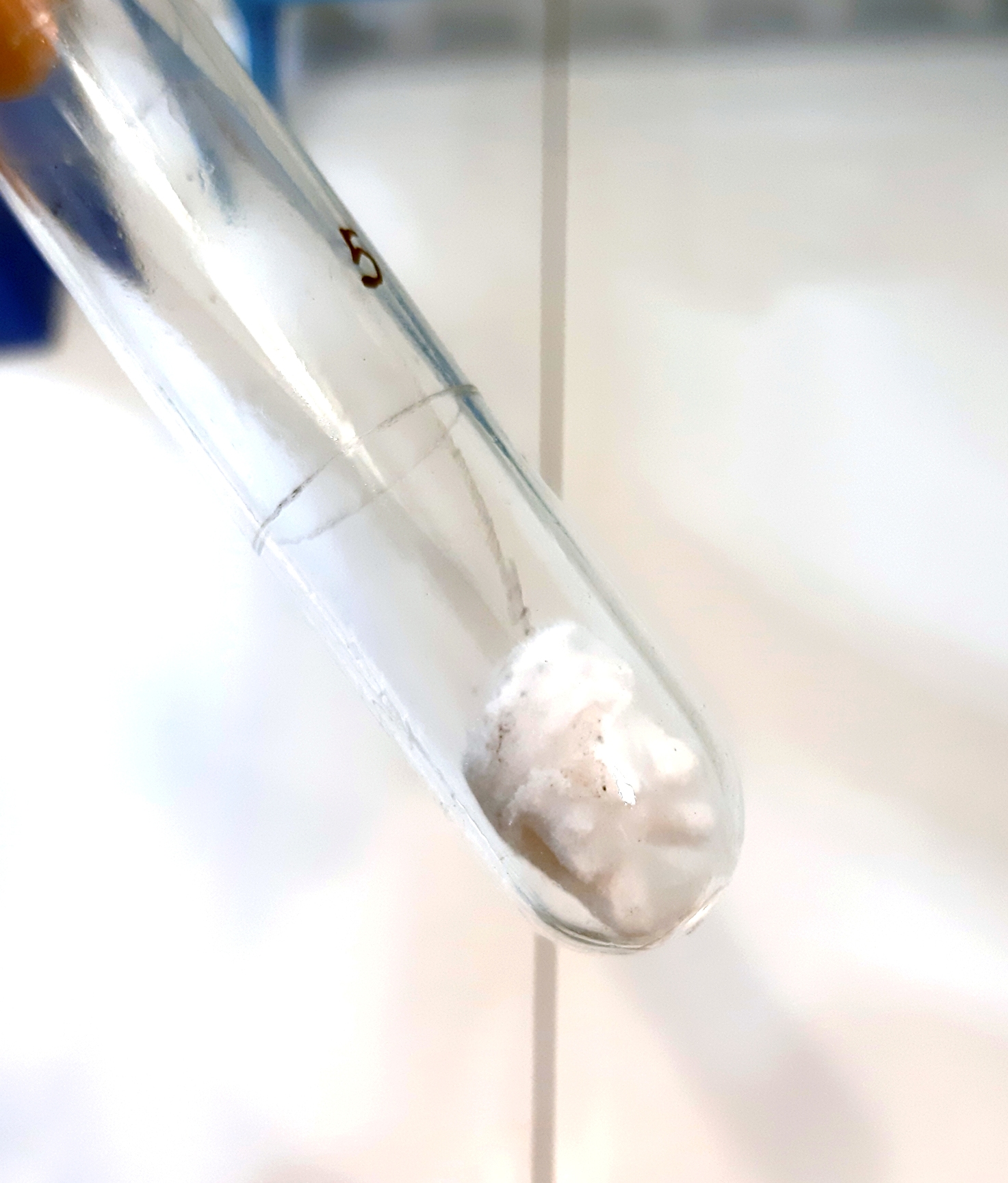
Фото 12. Опыт 2. Серный ангидрид, собранный с отвода холодильника |

Фото 13. Опыт 2. Серный ангидрид в твердой смеси с олеумом в виде похожей на лед субстанции на стенках приемной колбы |
|
Предварительные выводы по опыту №2.
1. В целом, методика синтеза рабочая, но есть ряд замечаний: 1.1. Для данного объема реакционной колбы и приемника следует увеличить объем реакционной массы где-то в 1.5-2 раза, т.к. часть SO3 теряется при взаимодействии с влагой воздуха в установке сравнительно большого объема. 1.2. Необходима насадка с твердым осушителем на выходе из обратного холодильника, т.к. периодически, вероятно, происходит подсос воздуха внутрь приемной колбы и образование конденсата на холодной поверхности спирали холодильника, который попадает в приемную колбу и взаимодействует с серным ангидридом, что было отмечено в ходе опыта. Для начала можно попробовать какую-то простую насадку-емкость с силикагелем или фосфорным ангидридом, распыленным на стеклянном бое или чем-то подобном - главное, чтобы осушитель не препятствовал свободному току газа из установки). 1.3. Длинный воздушный холодильник для данной мощности нагрева и температуры газообразного SO3 избыточен, и вызывает образование твердого серного ангидрида SO3 на входе в приемник. Возможно, вполне будет достаточно отвод из реакционной колбы ввести непосредственно в хорошо охлаждаемый приемник, либо через короткий переход. Тут нужно подобрать условия экспериментально. 2. Момент прекращения эффективного выделения "сухого" SO3 пока не установлен. Очевидно, что при нагревании реакционной массы до температуры не более 200°С (при избытке P4O10) не должны ни выделяться связанная вода, ни возгоняться фосфорный ангидрид. А вот при температуре 300°С и выше уже возможны разные варианты. Оптимально было бы провести синтез при нагревании с контролем температуры смеси термометром. В данном опыте отгонка SO3 продолжалась до значительного уменьшения выделения пузырьков газа из реакционной массы. 3. В случае успешного получения однородного SO3 желательно оценить его состав титрованием раствора образца по серной кислоте. Тут нужно продумать относительно удобные и безопасные способы пробоотбора продукта, с учетом его свойств (высокое сродство к воде и токсичность). Полученное в приемнике вещество было исследовано на содержание SO3. Для этого в колбу прилили 20 мл концентрированной серной кислоты ч.д.а. (ориентировочно 93-94%, - определение содержания см. подпункт 3) и взбалтывали до полного растворения твердой фазы (растворение в крепкой серной кислоте производится во избежание образования тумана и уноса образующейся H2SO4). 1 мл полученной жидкости отобрали пипеткой (точность 0.01 мл) и исследовали. 1) Взвешивание в бюксе на аналитических весах класс 2 (3 раза). Масса 1.8253 г. (Температура в помещении 22-23°С). 2) Пробу (1 мл) растворили в воде, объем раствора 250 мл. 5 мл полученного раствора оттитровали 0.1 н раствором NaOH по бромтимоловому синему (pH перехода 6.0-7.6). Титр 7.25 мл (2 раза), что соответствует 36.25 н раствору серной кислоты, или 18.125 моль/л, или 1.776 г/мл. Таким образом, в образце 1.776 г/мл / 1.8253 г = 97.3% = содержание серной кислоты. 3) Исследование концентрированной серной кислоты, использованной для растворения SO3. 2 мл, отобранные пипеткой на 5 мл класс 2, взвесили на аналитических весах класс 2. Масса образца = 3.6863 г. То есть плотность 1.8027 г/мл. Температура = 22°С. Содержание кислоты определили титрованием 0.2 н раствором NaOH (стандарт-титр из фиксанала) по бромтимоловому синему (интервал перехода 6.0-7.6). Для этого 2 мл (взвешенный образец) растворили в воде, доведя объем до 250 мл. 5 мл раствора титровали, получив титр 6.78 мл. Это соответствует 0.068 моль/л по H2SO4, или 17 моль/л для взятого образца, то есть 17*98 = 1666 г/л, 1.67 г/мл. То есть концентрация образца = 1.666/1.8253 = 92.4%. 4) Если принять эти расчеты за основу, то количество SO3, которое было в приемной колбе, следующее. Коэффициент увеличения массы по концентрации = (97.3%-92.4%)/92.4% = 5.3%. В исходном объеме раствора серной кислоты было 20 мл * 1.8027 = 36.054 г. Увеличение массы кислоты = 36.054*5.3% = 1.91 г. Здесь недостаточно данных, т.к. в составе вещества в колбе была также вода и, с одной стороны, происходило увеличение концентрации H2SO4 за счет олеума, с другой - ее снижение за счет включенной воды. Нужно было точно определить объем полученного раствора, это не было сделано. Таким образом, можно просто оценочно предположить, что масса SO3 в приемнике была более 2 г.
Опыт №3
Подготовка После анализа предыдущих опытов было решено сделать еще один синтез на установке, представляющей некое подобие гибрида установок из опытов 1 и 2. Реакционная колба на 250 мл круглая, с отводом, который через насадку Вюрца соединен с приемной колбой на 100 мл (форма приемника не имеет значения), приемник погружен в ледяную воду. К отводу промежуточной насадки через изгиб присоединен прямой обратный холодильник, который фактически выполняет роль дымовой трубы и ничего не конденсирует, т.к. в условиях осторожного нагрева реакционной массы SO3 конденсируется до входа в приемник, и через холодильник проходят только незначительные количества SO3 в форме тумана, образующегося с атмосферной водой, который холодильник в любом случае уловить практически не может. Существенным моментом в данной схеме является большой входной диаметр приемной колбы (29/32), что предотвращает преждевременное осаждение твердого серного ангидрида SO3, как это произошло в опыте 2. |

Фото 14. Опыт 3. Установка в сборе перед началом опыта |
|
Вместо обычной концентрированной. серной кислоты использовали обогащенную в предыдущем опыте серную кислоту примерно 98% концентрации.
Материальный расчет 1. Количество серной кислоты 18 мл * 1.83 г/мл = 32.9 г. Количество воды 32.9*2% = 0.66 г. 2. Масса P2O5 для связывания воды в кислоте = 142 г/моль (P2O5) * 0.66 г / 18 г/моль (H2O) = 5.2 г. 3. Масса P2O5 для получения 20 г SO3: 142 г/моль (P2O5) * 20 г / 80 г/моль (SO3) = 35.5 г. 4. Масса серной кислоты (по аналогии с п. 3) = 24.5 г (13.3 мл). Фактически для синтеза взяли 45 г фосфорного ангидрида и 33 г серной кислоты (18 мл). Фосфорной ангидрид в избытке, достаточным для полного связывания как реакционной, так и растворенной воды. Выполнение 1. Навеску 45 г фосфорного ангидрида засыпали в реакционную колбу, колбу ненадолго поместили в охлаждающую смесь снег-вода и прилили 18 мл 98% серной кислоты. В отличие от предыдущих опытов, тумана при этом образовалось немного (т.к. меньше растворенной в кислоте воды, то и разогрев смеси был меньшим). Колбу быстро присоединили к установке. 2. При слабом токе воды через холодильник нагревали колбу малым пламенем пропановой горелки небольшими интервалами, до начала активного выделения газа в колбе и начала появления белого тумана на выходе из холодильника. Далее горелку отставляли в сторону и при снижении активности в реакционной колбе смесь снова нагревали. На весь синтез было порядка 20 таких сетов. |

Фото 15. Опыт 3. Установка в начале опыта |
|
3. В отличие от опыта 2, образование тумана в самой установке было незначительным и, главным образом, в начале синтеза. Вскоре на стенках приемника стал образовываться белый снегообразный налет.
|

Фото 16. Опыт 3. Накопление SO3 в приемнике |
|
4. Синтез планировалось продолжать до почти полного завершения образования газа в реакционной колбе при умеренном нагреве. Однако его прекратить пришлось раньше, т.к. через некоторое время следы органики на шлифе входа в приемник обуглились, и через возникшую неплотность стал заметно выходить туман. Представлялся вероятным риск попадания внутрь влаги из воздуха. Избыточного выделения тумана SO3 + H2O также хотелось избежать, поэтому синтез прекратили.
5. Установку охладили и осторожно разобрали. Как обычно, при рассоединении детали сильно дымят (кроме холодильника, что свидетельствует о том, что SO3 в него практически не проникал). Остывшая реакционная масса представляет из себя прозрачный плав с твердой кристаллической фазой (видимо, фосфорная кислота). |

Фото 17. Опыт 3. Вид реакционной массы в конце опыта |
|
6. В приемнике образовалось заметное количество белого кристаллического снегообразного вещества без внешних признаков взаимодействия с водой.
|

Фото 18. Опыт 3. Полученный твердый серный ангидрид SO3 |
|
7. Отработанную реакционную массу в данном случае не размывали, а растворили в 50 мл 70% серной кислоты (при этом смесь разогрелась примерно до 80°С, но без выделения "дыма") и после охлаждения оставили для технических целей (фактически получилась смесь концентрированных серной и ортофосфорной кислот).
8. Выход продукта около 10 г, что для не доведенного до конца синтеза, в принципе, неплохо.
Выводы
Схема установки, использованная в данном опыте, представляется наиболее удобной для получения количественных образцов SO3. Вещество собирается в приемнике, не осаждается раньше времени и не уносится в обратный холодильник. Приемник легко отделяется, может использоваться и для хранения полученного вещества, и для последующих превращений (перегонки, синтеза, etc.). (С учетом специфических свойств серного ангидрида механический перенос его из одной емкости в другую представляет известную проблему). Утечка тумана SO3 + H2SO4 сравнительно невелика (в основном, при демонтаже установки).Фактический выход сравнительно невелик (порядка 50%), но поскольку синтез остановили преждевременно, он мог бы быть большим.
Внешний вид
Твердый серный ангидрид - белое кристаллическое вещество. Хотя в стандартных описаниях его сравнивают по виду с асбестом, он большой похож на легкий шелковистый рыхлый снег. При умеренном нагреве сосуда начинает плавиться, а при длительном стоянии на холоде частично изменяет вид, становясь похожим на ледяную изморозь. При контакте с воздухом (например, при открытии крышки сосуда, в котором находится) начинает интенсивно "дымить".
Справка (БСЭ 1969-86)
Серный ангидрид, трёхокись серы, оксид серы (VI) SO3. Твёрдый С. а. существует в α-, β-, γ- и δ-формах, имеющих tпл соответственно 16.8, 32.5, 62.3 и 95°С и различающихся по форме кристаллов и степени полимеризации SO3. Неустойчивая α-форма образуется при затвердевании жидкого С. а. и постепенно переходит в присутствии влаги в устойчивую β-форму - шелковистые кристаллы, похожие на асбест. Обратно β-форма может быть превращена в α-форму только через газообразное состояние SO3: при нормальном давлении и 44.7°С газообразный SO3 превращается в жидкость, которая, затвердевая при 16.8°С, образует α-SO3. Взаимный переход в другие модификации происходит очень медленно.
Безопасность
1. Даже при самой аккуратной работе серный ангидрид SO3 частично испаряется и образует с влагой воздуха обильный, и весьма медленно поглощаемый водой едкий туман серной кислоты (как известно, по этой причине при промышленном производстве серной кислоты SO3 растворяют не в воде, а в крепкой серной кислоте). Особенно интенсивно он образуется при разборе установки со следами SO3, либо при перегреве реакционной массы, но особенно - при случайном попадании капель воды на твердый SO3. Поэтому работу следует проводить в хорошо работающем вытяжном шкафу. Нагрев реакционной колбы/реторты должен быть очень аккуратным. Резиновые перчатки и защитные очки обязательны. 2. Реакционная смесь представляет собой горячий олеум, который, как и SO3, за очень короткое время "сжигает" самую разнообразную органику (из-за этого шлифы со следами смазки очень быстро чернеют). Соответственно, установка не может включать резиновые и т.п. детали, а шлифы должны быть сухими (без обычной вазелиновой смазки). Фторопластовые детали, скорее всего, будут стойкими. Во всяком случае, обычная белая ФУМ-лента выдержала, а вот у желтой быстро выгорел пигмент (хотя сама ФУМ-лента не разрушилась). 3. Взаимодействие с водой как реакционной массы, так и SO3 - сильно экзотермическая реакция, при этом вода находится тут же рядом, "за стенкой" (охлаждение приемника и холодильник). В случае случайного аварийного повреждения какой-либо детали возможно попадание воды внутрь установки с моментальным вскипанием реакционной массы или SO3, разгерметизацией сосуда и интенсивным разбрызгиванием агрессивных веществ. Поэтому работу проводить по возможности за экраном (за опущенным стеклом вытяжного шкафа), и иметь наготове нейтрализующие средства. 4. Тем не менее, при определенной аккуратности и соблюдении мер предосторожности синтез проходит ровно, спокойно, без всплесков и тому подобных неожиданностей. |

Вот такая красота в виде длинных игольчатых кристаллов обнаружилась в свободной части всех емкостей с SO3 через пару дней стояния на холоду (примерно при -2...-5°С)
|

|
|
Комментарии
К1
Дня три назад попробовал механически перенести серный ангидрид SO3 из приемников в одну емкость. Занятие практически бессмысленное. Даже при влажности 40% вещество активно "высасывает" воду из воздуха, из-за чего в верхней части открытого сосуда очень быстро появляется конденсат. Вещество липкое, несыпучее, напоминает сахарную вату, выскабливать неудобно, особенно с учетом ограничений по материалу инструментов. Вся грязь со шлифов сразу же приклеивается к основной массе. Дымит, разумеется, сразу все и очень сильно. Возможно, в герметичном перчаточном ящике получилось бы лучше, но не факт. В общем, практически нужно собирать сразу в емкость для дальнейшего синтеза или перегонки.
К1-1 Если нужны манипуляции с веществами с высокой гигроскопичностью - используют т.н. сухой бокс. Немного с ним работал. Небольшой шкафчик из оргстекла - напоминает маленькую вытяжку, но без отводной трубы. Со всех сторон - герметически закрыт. Внутри - две толстые резиновые перчатки для рук, герметично вставленные в кольцевые отверстия спереди. Внутри бокса - открытый кристаллизатор с фосфорным ангидридом. Фосфорный ангидрид по необходимости меняют. Сбоку - небольшой люк размером со среднюю тарелку. Точнее - люков два: используется принцип тамбура или выходного шлюза в космическом корабле. Сначала открывают внешний люк, помещают образцы в герметически закрытых емкостях в промежуточную камеру, потом внешний люк герметически закрывают. Дальше вставляют руки в перчатки, открывают внутренний люк (изнутри), перемещают закрытые образцы в бокс, закрывают внутренний люк и только тогда открывают емкости с гигроскопичным материалом и проводят с ним манипуляции. В конце - закрывают все емкости с гигроскопичным материалом, открывают внутренний люк и ставят емкости в промежуточную камеру (тамбур). Люк плотно закрывают. Только после этого - открывают внешний люк и забирают емкости с материалом. Потом люк герметично закрывают. Что неудобно - нет компенсатора давления. Когда ты сунул руку в одну рукавицу - в камере создается повышенное давление (эффект поршня) и вставить руку в другую рукавицу теперь непросто. Уверен, что для этой цели подойдет и большой прозрачный пластиковый лоток с крышкой (их сейчас продают достаточно - самых разных размеров). Конечно, лучше всего серный ангидрид использовать для проведения реакции в том же сосуде, в котором он был собран. |