Химия и Химики № 2 2022
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2022 Журнал Химиков-Энтузиастов |
Сульфаминовая кислота ч.1, 2, 3, 4, 5 Sulfamic acid В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Сульфаминовая кислота и цинк / Sulfamic acid and zinc
Сульфаминовая кислота - белое кристаллическое вещество, которое формально является производным серной кислоты: если в молекуле серной кислоты HO-SO2-OH мысленно заменить одну гидроксильную группу -OH на аминогруппу -NH2, то мы получим сульфаминовую кислоту NH2-SO2-OH (или NH2SO3Н). Другое название этого вещества - аминосульфоновая кислота.
 Разумеется, аминогруппа не будет "просто так" уживаться в одной молекуле с сильнокислотной группой О-Н: в кристаллическом состоянии сульфаминовая кислота находится в виде биполярного иона (цвиттер-ион) NH3+-SO3-: 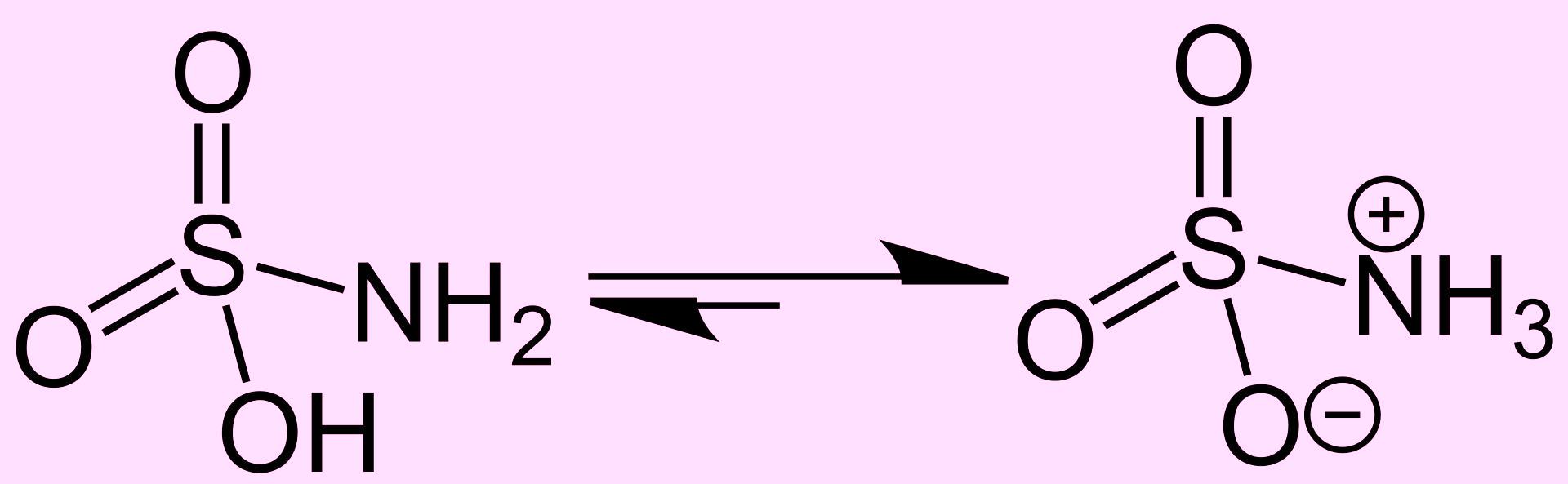 Несмотря на это, в некоторых источниках пишут, что сульфаминовая кислота - сильная кислота, которая сопоставима по силе с серной. Посмотрел справочники, оказалось, что для серной кислоты первая константа диссоциации pK1=-3, вторая pK2=1.92, а для сульфаминовой pK=0.99. Другими словами, сульфаминовая кислота намного слабее, чем серная кислоты по первой ступени диссоциации, но значительно сильнее, чем серная кислота по второй ступени диссоциации. Расчет показывает, что сульфаминовая кислота в растворе с концентрацией 1 моль/л диссоциирует чуть меньше, чем на 1/3. Где применяется сульфаминовая кислота? Для очистки труб и оборудования от накипи. Раньше с этой целью применяли более эффективную и дешевую соляную кислоту (с добавкой ингибитора), но сейчас соляную кислоту фактически запретили - работа с ней требует получения специальных разрешений и ведения ненужной отчетности, поэтому используют сульфаминовую кислоту. В органическом синтезе сульфаминовую кислоту иногда используют для сульфирования - вместо серной кислоты, серного ангидрида или олеума. Сульфамат никеля - компонент ванн гальванического никелирования (аналогично - с кобальтом). Сульфаминовую кислоту также используют для удаления избытка азотной кислоты перед осаждением золота из раствора - процесс аффинажа (об этом как-нибудь в другой раз). В лаборатории благодаря негигроскопичности и достаточной силе сульфаминовая кислота служит стандартным веществом при кислотно-основном титровании. Также используется для определения нитритов (солей азотистой кислоты). В горячем растворе сульфаминовая кислота гидролизуется до гидросульфата аммония NH4HSO4. Получают сульфаминовую кислоту реакцией мочевины с олеумом: (NH2)2CO + SO3 + H2SO4 = CO2 + 2H2NSO3H Несмотря на то, что сульфаминовая кислота у меня была, эксперименты с ней все откладывал на потом - в надежде сделать что-то более интересное. Но в один прекрасный момент "более интересное" не получилось: я не смог синтезировать комплекс куркумина с борной кислотой, поэтому решил заснять хоть что-то новое. А именно - реакцию сульфаминовой кислоты с цинком. Поместил в стакан 20 г сульфаминовой кислоты и 75 мл воды, перемешал, оставил. Температура была около 15°С, т.е. количество кислоты было больше, чем могло раствориться в данном объеме воды. Полученный насыщенный раствор слил с осадка и поместил в него гранулы цинка. И... ничего. Постепенно началось выделение пузырьков водорода, но очень слабое. Такого я не ожидал от "кислоты, сопоставимой по силе с серной". Хорошо. Сделаем гальваническую пару: зачистил медную проволоку, изогнул ее и опустил в раствор - так, чтобы конец прикасался к гранулам цинка. Выделение газа заметно ускорилось и стало "вполне приличным": как с поверхности меди, так и с поверхности гранул цинка. Разумеется основное количество водорода выделяла именно поверхность меди (хотя площадь проволоки была намного меньше, чем площадь гранул цинка). Приподнимаем проволоку - так, чтобы ее контакт с цинком потерялся, - и выделение пузырьков на меди прекращается, восстанавливаешь контакт - с поверхности меди снова выделяется водород. Просто, зато наглядно. Попутно заметил, что скорость выделения водорода с поверхности цинка увеличилась - даже без меди, но реакция все равно шла медленно. Ради интереса опустил в раствор универсальную индикаторную бумагу и сравнил ее окраску со шкалой. Получилось, что рН=0. А реакция с цинком - медленная. Использованная индикаторная бумага не отличается точностью, но все-таки. Еще один способ ускорить реакцию - повысить температуру. Слил раствор с гранул, нагрел на электроплитке до начала кипения, снял с плитки. Подождал, пока выделение пузырьков прекратится и вернул гранулы в раствор сульфаминовой кислоты. Результат - вещества реагируют не так активно, как концентрированная соляная кислота с цинком (комнатная температура), даже до реакции аккумуляторной серной кислоты (~35%) с цинком не дотягивает, но образовались целые струи пузырьков водорода. Реакция средней интенсивности. Опустил в раствор медную проволоку, прикоснулся медью к гранулам - чтобы снова создать гальваническую пару с цинком, но в горячем растворе реакция хорошо шла и без меди. Примерно, как разбавленная фосфорная или уксусная кислота оптимальных концентраций (при комнатной температуре). Эксперимент получился, видео - не очень. При просмотре оказалось, что белые пузырьки водорода на светлом фоне заметны плохо. Желательно переснять на темном фоне. Так и сделаю. Раствор сульфаминовой кислоты я уже вылил - пришлось готовить новый, но цинк я просто промыл водой и оставил сушиться. Это имело интересные последствия... |

Сульфаминовая кислота и универсальная индикаторная бумага |

Сульфаминовая кислота и цинк: в этот раз реакция с цинком идет гораздо быстрее |

|

Сульфаминовая кислота и цинк: реакция с цинком идет, но водород выделяется медленно |

Создадим гальваническую пару |

|

|

|

В горячем растворе реакция между сульфаминовой кислотой и цинком идет гораздо активнее |

|

|

|

|
|
Сульфаминовая кислота, цинк и хлорид натрия / Sulfamic acid, zinc and sodium chloride
Итак, я снова приготовил насыщенный раствор сульфаминовой кислоты (температура около 15°С) и поместил в него гранулы цинка после прошлого опыта. С тех пор гранулы не до конца просохли, но я не придал этому значения. Цель эксперимента - снять видео реакции на темном фоне, чтобы пузырьки водорода было лучше заметно. Температура - комнатная, в прошлый раз скорость реакции была низкой, т.е. - ничего выдающегося и даже интересного не ожидалось. Чтобы не проводить опыт фактически вхолостую (только ради более качественного видео), решил также проверить, ускорит ли реакцию прибавление насыщенного раствора хлорида натрия? Прогноз - сильно ускорит: показано на примере лимонной кислоты и цинка. В стаканчике смешал 10 г соли и 20 мл воды, дал постоять и отфильтровал не растворившийся хлорид натрия. Раствор хлорида натрия я добавлю чуть позже - когда сниму достаточно кадров реакции сульфаминовой кислоты и цинка. Сразу неожиданность: с первых секунд в стакане началась реакция средней скорости - выделение пузырьков водорода было на уровне реакции цинка и разбавленной фосфорной кислоты. Без добавления меди или подогрева раствора. Немного неожиданно, хотя логично: подобное явление называется активация поверхности. В первом эксперименте я использовал гранулы цинка, взятые из банки - они реагировали медленно. На поверхности металла есть оксидная пленка, на растворение которой нужно время. Когда она исчезла - реакция пошла быстрее. Плюс к этому - образование микроскопических гальванических пар: гранулы цинка (ч.д.а.) могли содержать вкрапления менее активных металлов, которые образуют гальваническую пару с цинком, ускоряя его растворение в кислоте. Сначала действовала только та часть вкраплений менее активных металлов, которая была на поверхности, но по мере растворения цинка обнажались все новые и новые порции примесей, образуя новые гальванические пары в дополнение к старым [1]. Визуально было хорошо видно, что выделение водорода шло не равномерно, а преимущественно из определенных точек поверхности. Через несколько минут добавил раствор хлорида натрия, перемешал. Выделение водорода заметно усилилось, но оно и до этого было существенным. Другими словами, хлорид-ион ускорил реакцию, но эффект был не так заметен, как в случае лимонной кислоты. Думаю, что дело не только в том, что сульфаминовая кислота сильнее лимонной, а и в том, что поверхность цинка до опыта была активирована обработкой в растворе сульфаминовой кислоты (причем - горячем). __________________________________________________ 1 Если примеси менее активного металла, например, меди растворены в цинке (и не образуют отдельную фазу - вкрапления), - сути дела это не меняет. |

|

Сульфаминовая кислота и цинк: в этот раз реакция с цинком идет гораздо быстрее |

|

|

Добавим хлорид натрия - выделение водорода ускорится |

|

|
|
Сульфаминовая кислота и мрамор / Sulfamic acid and marble
Карбонат кальция (мел или мрамор - крупные куски) реагирует с разбавленной серной кислотой весьма специфически: сначала начинается реакция средней интенсивности, потом реакция все замедляется и практически прекращается, зато в более слабой уксусной кислоте карбонат кальция растворяется без проблем (см. статью Мрамор и серная кислота / Marble and sulfuric acid [ссылка]. Дело в том, что сульфат кальция плохо растворим в воде и кислотах, поэтому он образует корку на поверхности карбоната кальция, которая препятствует дальнейшей реакции. В отличие от сульфата, хлорид, нитрат или ацетат кальция хорошо растворимы в воде и не мешают протеканию реакции соответствующих кислот с карбонатом кальция. А как обстоит дело с сульфаминовой кислотой? Это зависит от того, растворим ли сульфамат кальция в воде? Сначала начал искать - и только потом понял, что я задал глупый вопрос. Откровенно глупый! Сульфаминовая кислота используется для очистки труб и другого оборудования от накипи - т.е., от осадка солей жесткости, который состоит преимущественно из карбоната кальция и карбоната магния. Т.е., даже не заглядывая в литературу, можно сразу сказать, что сульфамат кальция хорошо растворим в воде, а сульфаминовая кислота "без проблем" реагирует с карбонатом кальция. Нашел даже специализированную статью, посвященную растворимости карбоната кальция в растворах сульфаминовой кислоты при избыточном давлении углекислого газа: [2]. Приготовил 75 мл насыщенного раствора сульфаминовой кислоты (Т=20°С), слил с осадка. В стакан поместил два кусочка мрамора. Началась реакция средней интенсивности. Активное выделение пузырьков углекислого газа и постепенное уменьшение кусков мрамора. Раствор стал бело-мутным от пузырьков углекислого газа. По мере расходования кислоты и замедления реакции он постепенно светлел. Данную реакцию вполне можно использовать для получения равномерного потока углекислого газа (например, в аппарате Киппа, если возникнет необходимость заменить соляную кислоту). Оставил стакан на время. Примерно через 3 часа проверил - выделение углекислого газа к этому времени почти прекратилось. На дне стакана образовалось немного белого осадка. Раствор сульфамата кальция профильтровал и оставил для дальнейших экспериментов. __________________________________________________ 2 См. Абрамов В.А. - НАКИПЕОБРАЗОВАНИЕ В СУДОВЫХ ТЕПЛООБМЕННИКАХ, МЕТОДЫ ИХ ОЧИСТКИ И РАСТВОРИМОСТЬ СaСО3 В РАСТВОРАХ СУЛЬФАМИНОВОЙ КИСЛОТЫ ПРИ ПОВЫШЕННЫХ ДАВЛЕНИЯХ СО2 // Судовые энергетические установки No 31 - 2013 г [ссылка] |

Сульфаминовая кислота и мрамор |

|

|

|

|

|

|

|

|

|

|

Сульфамат кальция и серная кислота (осаждение сульфата кальция) |

|

|

|

|

|

|

|

|

Сульфамат кальция при кипячении раствора постепенно дает осадок гипса |

|

|

|

|

|

|

|

|

Резкое вскипание раствора с осадком на дне - началось разбрызгивание |

|

|

|
|
Комментарии
К1
У меня впечатление, что кислота (и её соли) мало исследованы. И данных по растворимости в тройных системах, для высаливания, не найти.
|