Химия и Химики № 2 2023
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2023 Журнал Химиков-Энтузиастов |
Iron (II), (III) salts, ferrocyanide and ferricyanide - pt.1, 2, 3 Соли железа (II), (III) и гексацианоферраты (II), (III) В.М. Вітер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Iron(II) and potassium ferrocyanide - pt.1 / Железо (II) и желтая кровяная соль
Гексацианоферраты (II) - комплексные соединения, производные железа (II), которое они содержат в виде аниона [Fe(CN)6]4-, наиболее известный пример - желтая кровяная соль, или гексацианоферрат (II) калия - K4[Fe(CN)6]. Анион этот достаточно прочный, поэтому, несмотря на наличие в его составе аниона цианида, данное соединение нетоксично. Желтая кровяная соль широко известна среди химиков в качестве реактива на соли трехвалентного железа, Fe(III) - с ними она дает синий осадок берлинской лазури. Гексацианоферраты (III) - комплексные соединения, производные аниона [Fe(CN)6]3-, который, в отличие от предыдущего случая, содержит атом трехвалентного железа. Широко известный пример - красная кровяная соль, она же - гексацианоферрат (III) калия, K3[Fe(CN)6]. Красная кровяная соль - менее прочное соединение: в растворе она заметно диссоциирует с отщеплением цианид-аниона, поэтому считается ядовитой. Красная кровяная соль является известным реактивом на соли двухвалентного железа, Fe(II) - с ними она дает синий осадок турнбулевой сини. Как это запомнить? Существует мем - "2 => 3 и 3 => 2":
Долгое время считалось, что берлинская лазурь имеет состав FeIII4[FeII(CN)6]3, а турнбулева синь - FeII3[FeIII(CN)6]2, поскольку это следовало из гипотетических уравнений реакций их образования, которые казались простыми и очевидными: 4Fe3+ + 3[FeII(CN)6]4- => FeIII4[FeII(CN)6]3↓ 3Fe2+ + 2[FeIII(CN)6]3- => FeII3[FeIII(CN)6]2↓ Однако, с появлением более современных методов исследования еще в первой половине прошлого столетия было установлено, что эти два соединения - одно и то же вещество (вещества) состава: KXFeY[Fe(CN)6], в дополнению к сказанному, обмен электронами между атомами железа из внешней и внутренней координационных сфер происходит быстро и безо всяких проблем. В результате Fe(II) становится Fe(III), а Fe(III) становится Fe(II); причем в синем осадке двухвалентное железо находится именно во внутренней координационной сфере (т.е. - в комплексном анионе), даже если изначально была взята красная кровяная соль (которая содержит Fe(III) в комплексном анионе): Fe2+ + [Fe3+(CN)6] => Fe3+ + [Fe2+(CN)6]. Известность данное вещество - KXFeY[Fe(CN)6] получило не благодаря аналитической химии (или перипетиям его исследования), а благодаря тому, что оно широко использовалось в качестве дешевого синего пигмента, который имел множество разных названий (берлинская лазурь и турнбулева синь - только два из них). Кстати, только во взрослом возрасте узнал, что "турнбулева синь" - по сути, торговая марка (как "тефлон", "силуфол", "аэросил" и т.д.): название произошло от названия шотландской фирмы, которая этот пигмент изготавливала. В наше время название "турнбулева синь" практически вышло из употребления. А что будет, если поменять порядок: "2 => 3 и 3 => 2"? Например, к желтой кровяной соли, K4[Fe(CN)6] (производному Fe(II)) добавить сульфат железа (II), FeSO4? Т.е. осуществить схему: "2 => 2". Или попробовать схему: "3 => 3", например, к красной кровяной соли K3[Fe(CN)6] (производному Fe(III)) добавить хлорид железа (III), FeCl3? В книге Леенсон И.А. Чёт или нечет? Занимательные очерки по химии. М: Химия, 1987. С.62-68 [ссылка] прочитал следующее. При смешивании желтой кровяной соли и сульфата двухвалентного железа получается соль Эверитта - белый осадок гексацианоферрата(II) калия-железа (II): FeIISO4 + K4[FeII(CN)6] => K2FeII[FeII(CN)6] + K2SO4. Соль Эверитта быстро окисляется кислородом воздуха до гексацианоферрата(II) калия-железа(III) - берлинской лазури. Именно так берлинскую лазурь первоначально и производили. К комбинации "3 => 3" мы вернемся чуть позже (надеюсь), а сейчас попробуем произвести взаимодействие желтой кровяной соли с железным купоросом [сульфат железа (II)]. Для эксперимента взял 2 г железного купороса, добавил 15 мл дистиллированной воды и 10 мл концентрированной соляной кислоты. Железный купорос FeSO4·7H2O был технической чистоты - такой препарат содержит примесь трехвалентного железа, причем взял я технический препарат не "по бедности", а сознательно. Внешний вид - зеленые кристаллы с коричневыми включениями (результат окисления Fe(II) до Fe(III)). Железный купорос изначально дал коричневый мутный раствор, который после добавления соляной кислоты стал зелено-желтым. В другом стакане растворил 4 г желтой кровяной соли в 200 мл дистиллированной воды. К раствору желтой кровяной соли K4[Fe(CN)6] по каплям стал добавлять раствор сульфата железа (II). Раствор опускался на дно в форме вихревых колец, облаков и нитей, образуя бело-голубой осадок. Т.е., осадок изначально был не белым, а бело-голубым, для меня это не стало неожиданностью, поскольку технический сульфат двухвалентного железа содержит примесь трехвалентного железа. А трехвалентное железо дает с желтой кровяной солью синий осадок. Перемешал. Содержимое стакана представляло собой светло-синюю суспензию. Если прекратить перемешивание, осадок постепенно оседал в виде бело-голубых хлопьев. Действительно "лазурь". |
_sulfate-potassium_ferrocyanide-1.jpg)
Iron(II) sulfate (technical grade) and potassium ferrocyanide |
_sulfate-potassium_ferrocyanide-2.jpg)
|
_sulfate-potassium_ferrocyanide-3.jpg)
|
_sulfate-potassium_ferrocyanide-4.jpg)
|
_sulfate-potassium_ferrocyanide-5.jpg)
|
_sulfate-potassium_ferrocyanide-6.jpg)
|
_sulfate-potassium_ferrocyanide-7.jpg)
|
_sulfate-potassium_ferrocyanide-8.jpg)
|
_sulfate-potassium_ferrocyanide-9.jpg)
|
_sulfate-potassium_ferrocyanide-10.jpg)
|
_sulfate-potassium_ferrocyanide-11.jpg)
|
_sulfate-potassium_ferrocyanide-12.jpg)
|
_sulfate-potassium_ferrocyanide-13.jpg)
|
|
Теперь вторая часть замысла. В стакан с сульфатом железа (II), в который я изначально добавил соляную кислоту, добавить металлическое железо - чтобы оно восстановило примесь (III) до (II), потом следовало добавить этот раствор в раствор желтой кровяной соли (такой же, как и в прошлый раз). Я надеялся, что осадок в этот раз будет белым (без голубого оттенка) - за счет образования соли K2Fe[Fe(CN)6], которая при стоянии на воздухе окислится до голубой (или синей) берлинской лазури, - как описано в книгах.
Поскольку сульфат железа (II) был взят технический, о чистоте металлического железа особо заботится не следует - я взял канцелярские скрепки. Сюрприз... выделения водорода некоторое время не наблюдалось. Потом пузырьки появились, причем скорость реакции была низкой. Соляной кислоты я добавил достаточно, но, водород выделяется еле-еле: неужели эти скрепки сделаны из хорошей легированной стали (а не из какой попало черной)? Нет: хром, никель или другие посторонние металлы мне здесь не нужны. Слил раствор, вынул скрепки. Вместо них поместил в стакан изогнутые гвозди - они точно сделаны из дешевой черной стали, вернул раствор в стакан. Добавил еще концентрированной соляной кислоты. Примерно час длилась реакция с умеренным выделением водорода. Цвет раствора при этом не изменился. Выделение водорода ослабло, но продолжалось. Взял несколько капель данного раствора и капнул в стакан с точно таким же раствором желтой кровяной соли (как в первый раз). Результат был идентичен тому, что мы наблюдали в прошлый раз: бело-голубой осадок. Добавление металлического железа и соляной кислоты, их длительная реакция никак не повлияли на цвет осадка. Подумал: если нам нужно исключительно железо (II) без железа (III), то зачем брать технический железный купорос, а потом пытаться восстановить примесь трехвалентного железа в нем. Изначально я планировал продемонстрировать разницу между поведением технического препарата железа (II) и этого же препарата, но после восстановления примеси Fe(III). А, раз заметной разницы не было, - возьмем просто металлическое железо (гвозди) и соляную кислоту. Промыл эти же гвозди и добавил к ним концентрированную соляную кислоту. Сразу же началась сравнительно интенсивная реакция. Примерно через 20 минут отобрал пробу раствора и добавил ее в раствор желтой кровяной соли (такой же, как и в прошлые разы). Результат - бело-голубой осадок. Субъективно в самом начале осаждения он был более светлым, чем в двух предыдущих опытах, но чисто-белого осадка не получилось. Т.е., или примесь трехвалентного железа была в растворе изначально, или процесс окисления Fe(II) до Fe(III) пошел очень быстро еще в момент образования осадка. Почти наверняка - оба варианта сразу. То, что соли двухвалентного железа часто дают положительные качественные реакции на трехвалентное железо, - известный факт. Печально, но не неожиданно. Много других нерастворимых (малорастворимых) соединений железа (II) ведут себя аналогично - при осаждении их на воздухе. Особенно - в щелочной среде. Например, пишут, что гидроксид железа (II) - белый, но попробуйте его осадить, не обеспечив анаэробные условия: осадок получится, сначала зеленым, а потом - и вовсе станет коричневым, из-за окисления Fe(OH)2 в Fe(OH)3. Простая изоляция реакционной смеси от атмосферы не поможет - необходимо также удалить растворенный в воде кислород. Подобное происходит при осаждении фосфата железа (II) из водного раствора: необходима инертная или восстановительная атмосфера, иначе железо (II) окислится кислородом до железа (III). Аналогичные предосторожности нужны и при осаждении карбоната двухвалентного железа. По этой же причине вместо ацетата двухвалентного железа, если не обеспечить анаэробную атмосферу, вы получите осадок основного ацетата трехвалентного железа. Схожим образом, кстати, ведет себя и гидроксид двухвалентного марганца Mn(OH)2: он быстро и количественно окисляется кислородом. На этом основан метод Винклера - надежный способ количественного определения растворенного в воде кислорода. |
_sulfate-potassium_ferrocyanide-14.jpg)
Concentrated hydrochloric acid and iron |
_sulfate-potassium_ferrocyanide-15.jpg)
|
_sulfate-potassium_ferrocyanide-16.jpg)
|
_sulfate-potassium_ferrocyanide-17.jpg)
|
_sulfate-potassium_ferrocyanide-18.jpg)
|
_sulfate-potassium_ferrocyanide-19.jpg)
Iron(II) chloride and potassium ferrocyanide |
_sulfate-potassium_ferrocyanide-20.jpg)
|
_sulfate-potassium_ferrocyanide-21.jpg)
|
_sulfate-potassium_ferrocyanide-22.jpg)
|
_sulfate-potassium_ferrocyanide-23.jpg)
|
_sulfate-potassium_ferrocyanide-24.jpg)
|
_sulfate-potassium_ferrocyanide-25.jpg)
|
_sulfate-potassium_ferrocyanide-26.jpg)
|
_sulfate-potassium_ferrocyanide-27.jpg)
|
_sulfate-potassium_ferrocyanide-28.jpg)
|
|
Iron(III) chloride and potassium ferricyanide - pt.2 / Хлорид железа (III) и красная кровяная соль
Теперь рассмотрим комбинацию "3 => 3", а именно - реакцию гексацианоферрата и соли железа с одинаковой степенью окисления железа в них (+3). Например, к красной кровяной соли K3[Fe(CN)6] (производному Fe(III)) добавим хлорид железа (III), FeCl3 - также производное Fe(III). Точнее, перед тем, как что-то к чему-то добавлять, сначала посмотрим литературу. Если тематика новая, смотреть нужно обзорные статьи, монографии и выборочно - оригинальные экспериментальные работы. В данном случае вопрос изучался еще во времена наших дедушек-бабушек, поэтому я ограничился научно-популярной книгой, упомянутой в первой части статьи:
Леенсон И.А. Чёт или нечет? Занимательные очерки по химии. М: Химия, 1987. С.62-68 [ссылка].Согласно книге при смешивании FeCl3 и K3[Fe(CN)6] осадок не выпадает вообще - образуется зелено-коричневый коллоидный раствор, который при кипячении в темноте дает т.н. берлинскую зелень, ей обычно приписывают состав "FeIII[FeIII(CN)6]", хотя в составе осадка обнаружено некоторое количество FeII. Единственный восстановитель (в данной системе), который мог бы перевести часть железа (III) в железо (II), - цианид-ион. Лирическое отступление В приведенном описании мне был непонятен один момент: зачем смесь хлорида трехвалентного железа и красной кровяной соли кипятить в темноте? Я помнил, что хотя железо - не серебро, но светочувствительные соединения железа (III) известны и получить их не так и трудно. Более того, в прошлом они имели широкое практическое применение. Например, - триоксалатоферрат(III) калия - K3[Fe(C2O4)3]·3H2O (Potassium ferrioxalate).  Potassium ferrioxalate / Триоксалатоферрат(III) калия Может быть получен из хлорида железа (III) и оксалата калия: FeCl3 + 3K2C2O4 => K3[Fe(C2O4)3] + 3KCl Данная соль фоточувствительна - она разлагается под действием света: 2K3[Fe(C2O4)3] + hv => 2K2[Fe(C2O4)3] + K2C2O4 + 2CO2 Реагирует с красной кровяной солью на свету: 2K3[Fe(C2O4)3] + 2K3[Fe(CN)6] + hv =>2 KFe[Fe(CN)6] + 5K2C2O4 + 2CO2 Последняя реакция использовалась в методе цианотипии - бессеребряный фотографический процесс, дающий при фотопечати изображение голубого оттенка. Изобретен в 1842 году английским физиком и астрономом сэром Джоном Гершелем. Технология широко использовалась для изготовления светокопий чертежей и документов ("синек"), а в настоящее время она получила распространение среди фотохудожников как альтернативный процесс фотографии.  Algae cyanotype (a photographic blueprint) / Фотограмма водорослей, выполненная способом цианотипии 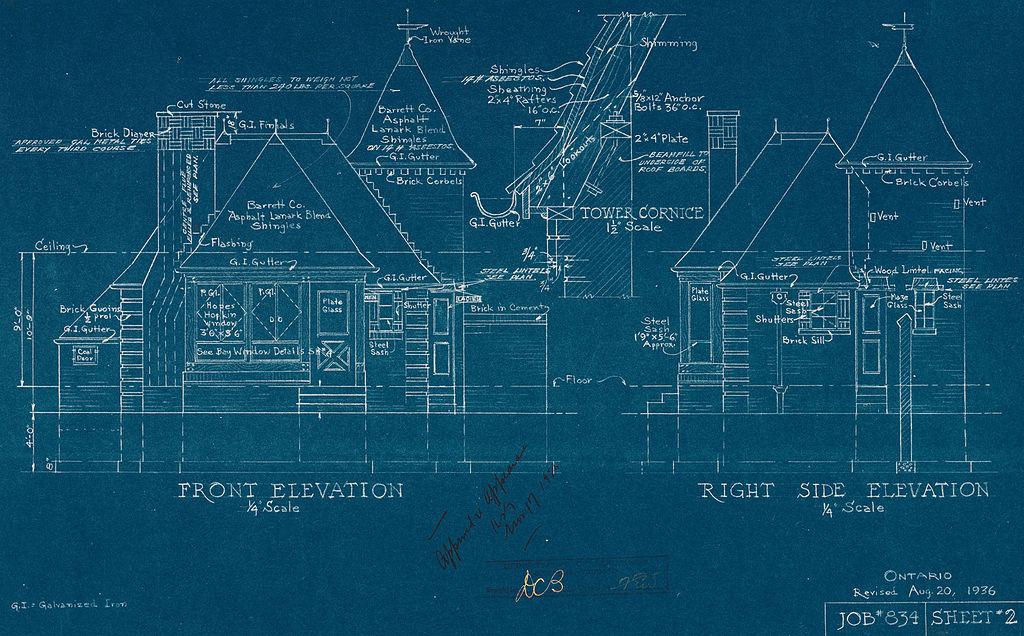 Architectural drawing blueprint, Canada, 1936 / "Синька" - копия чертежа, полученная данным методом "Синьки" - копии чертежей, полученные методом цианотипии, я еще застал. Правда, в классическом варианте цианотипии использовался не оксалат железа(III)-калия, а его аналог - цитрат железа(III)-аммония: "Главные достоинства технологии заключаются в ее простоте и возможности печати на любых материалах, способных удержать чувствительный слой. В отличие от обычных фотопроцессов, цианотипия пригодна только для контактной печати и фотограмм из-за очень низкой светочувствительности. Классическая технология, в некоторых источниках называемая "бессеребряным негативным процессом", основана всего на двух веществах: 30%-м растворе аммиачного лимоннокислого железа (Цитрат железа(III)-аммония) и 12%-м растворе железосинеродистого калия (Красная кровяная соль). В результате смешивания их равных долей получается раствор, который затем наносится кистью на какую-либо поверхность, чаще всего, акварельную бумагу. После полного высыхания такая бумага становится чувствительной к ультрафиолетовому излучению. На экспонированных участках покрытие становится нерастворимым, образуя турнбулеву синь, окрашивающую поверхность. Закрепление отпечатка заключается в его промывке водой. Растворимое в воде железо Fe (III) вымывается, в то время как нерастворимая турнбулева синь остается на бумаге. В результате получается негативное (по отношению к оригиналу) изображение синеватого оттенка." А теперь, как сказал преподаватель неорганики: "Вернемся к нашим бОранам". Точнее, не к гидридам бора, а к взаимодействию красной кровяной соли и хлорида железа (III). Я приготовил раствор 4 г красной кровяной соли в 200 мл воды. В другой стакан налил 10.4 г насыщенного раствора хлорида железа (III) - с намерением использовать какую-то его часть. К раствору красной кровяной соли по каплям стал добавлять хлорид железа (III). Добавил аж две капли, они опустились на дно, образуя вихревые кольца. Раствор на дне стал темным, перемешал - весь раствор в стакане стал черным. Конкретный цвет раствора был неразличим, поэтому поставил рядом стакан с дистиллированной водой и отобрал в него несколько миллилитров реакционной смеси, перемешал. Раствор стал желто-зеленым. Никаких признаков опалесценции я не заметил (опалесценцию дают коллоидные растворы или суспензии и НЕ дают истинные растворы), но боковым лучом на предмет возникновения конуса Тиндаля проверить не догадался. Теперь - кипячение смеси растворов красной кровяной соли и хлорида железа (III). Единственное, решил кипятить не в темноте, а на свету (затемнить помещение - не проблема, снимать в темноте не удастся). Отлил 40 мл полученного черного раствора, стал нагревать на плитке. Раствор закипел, при этом он оставался непрозрачным - трудно было увидеть, образовался ли осадок? Учитывая, что хлорида железа я добавил очень мало, добавил по каплям еще 1 мл насыщенного раствора FeCl3 к кипящей реакционной смеси. Кипение усилилось. Хотя раствор был темным, стало заметно, что теперь он представляет суспензию, - т.е., что появилась твердая фаза. В тонком слое цвет жидкости был корично-зеленым. На время прекратил кипячение, повращал стакан, чтобы раствор растекся тонким слоем по стенкам - было очевидно, что это - не истинный раствор, а суспензия. Больше всего он мне напоминал синтез основного сульфата хрома (III), хотя сходство чисто внешнее (см. Хромовый ангидрид, основный сульфат хрома и нитрат хрома (III) / Chromic anhydride, basic chromium sulfate and chromium (III) nitrate [ссылка]). Добавил в стакан дистиллированной воды - до общего объема 75 мл, продолжил кипячение. Стало заметно, что на дне образовался коричневый осадок, но основная масса твердой фазы по-прежнему взвешена в жидкости. Поставил раствор охлаждаться для дальнейшего фильтрования. Тем временем к дистиллированной воде в другом стакане добавил порцию исходного черного раствора (красная кровяная соль + хлорид железа (III)) - так, чтобы окраска была интенсивной, но раствор остался прозрачным на просвет. Тоже поставил кипятиться. Раствор кипел, но долгое время осадка не было. Потом - при просмотре отснятого видео заметил, что осадок был, но мало, поскольку в смеси мало было хлорида железа (III). К кипящей жидкости добавил каплю насыщенного раствора FeCl3 - в результате моментально образовалась зелено-коричневая суспензия - жидкость потеряла прозрачность. Это меня НЕ впечатлило, поскольку хлорид железа (III) дает коллоид даже с дистиллированной водой: если его добавить в кипящую воду, происходит гидролиз, еще лучше для этой цели взять водопроводную воду - вы получите бурые хлопья (т.к. водопроводная вода имеет щелочную реакцию, особенно - при кипячении). С этим раствором я закончил. Взял основную порцию раствора, которую я кипятил и оставил остывать. Начал фильтровать через бумажный фильтр. Первые порции фильтрата были зеленоватыми - по-видимому, немного зеленых частиц прошло через фильтр, но следующие порции фильтрата были почти чисто-желтыми, как исходный раствор красной кровяной соли. На фильтре остался темно-зеленый осадок, который вполне мог бы служить пигментом (по крайней мере, - исходя из его внешнего вида). Это и есть "берлинскую зелень" - хорошо, что не "парижская" [1]. __________________________________________________ 1 Парижская зелень - ацетат-арсенит меди (II), Cu(CH3COO)2·3Cu(AsO2)2. Раньше использовалась в качестве красивого зеленого пигмента, например, для комнатных обоев, но для бытовых целей парижская зелень давно запрещена из-за высокой токсичности и многочисленных случаев отравлений. Также является зооцидом, инсектицидом и фунгицидом. |
_chloride_potassium_ferricyanide-1.jpg)
Interaction of iron(III) chloride and potassium ferricyanide Взаимодействие хлорида железа (III) и красной кровяной соли |
_chloride_potassium_ferricyanide-2.jpg)
|
_chloride_potassium_ferricyanide-3.jpg)
|
_chloride_potassium_ferricyanide-4.jpg)
|
_chloride_potassium_ferricyanide-5.jpg)
|
_chloride_potassium_ferricyanide-6.jpg)
|
_chloride_potassium_ferricyanide-7.jpg)
|
_chloride_potassium_ferricyanide-8.jpg)
|
_chloride_potassium_ferricyanide-9.jpg)
|
_chloride_potassium_ferricyanide-10.jpg)
|
_chloride_potassium_ferricyanide-11.jpg)
|
_chloride_potassium_ferricyanide-12.jpg)
|
_chloride_potassium_ferricyanide-13.jpg)
|
_chloride_potassium_ferricyanide-14.jpg)
|
_chloride_potassium_ferricyanide-15.jpg)
|
_chloride_potassium_ferricyanide-16.jpg)
|
_chloride_potassium_ferricyanide-17.jpg)
|
_chloride_potassium_ferricyanide-18.jpg)
|
_chloride_potassium_ferricyanide-19.jpg)
|
_chloride_potassium_ferricyanide-20.jpg)
|
_chloride_potassium_ferricyanide-21.jpg)
|
_chloride_potassium_ferricyanide-22.jpg)
|
_chloride_potassium_ferricyanide-23.jpg)
|
_chloride_potassium_ferricyanide-24.jpg)
|
_chloride_potassium_ferricyanide-25.jpg)
|
_chloride_potassium_ferricyanide-26.jpg)
|
_chloride_potassium_ferricyanide-27.jpg)
|
_chloride_potassium_ferricyanide-28.jpg)
|
_chloride_potassium_ferricyanide-29.jpg)
|
_chloride_potassium_ferricyanide-30.jpg)
|
_chloride_potassium_ferricyanide-31.jpg)
|
_chloride_potassium_ferricyanide-32.jpg)
|
_chloride_potassium_ferricyanide-33.jpg)
|
_chloride_potassium_ferricyanide-34.jpg)
Interaction of iron(III) chloride and potassium ferricyanide Взаимодействие хлорида железа (III) и красной кровяной соли |
_chloride_potassium_ferricyanide-35.jpg)
|
_chloride_potassium_ferricyanide-36.jpg)
|
_chloride_potassium_ferricyanide-37.jpg)
|
_chloride_potassium_ferricyanide-38.jpg)
|
_chloride_potassium_ferricyanide-39.jpg)
|
_chloride_potassium_ferricyanide-40.jpg)
|
_chloride_potassium_ferricyanide-41.jpg)
|
_chloride_potassium_ferricyanide-42.jpg)
|
_chloride_potassium_ferricyanide-43.jpg)
|
_chloride_potassium_ferricyanide-44.jpg)
|
_chloride_potassium_ferricyanide-45.jpg)
|
_chloride_potassium_ferricyanide-46.jpg)
|
_chloride_potassium_ferricyanide-47.jpg)
|
_chloride_potassium_ferricyanide-48.jpg)
|
_chloride_potassium_ferricyanide-49.jpg)
|
_chloride_potassium_ferricyanide-50.jpg)
|
_chloride_potassium_ferricyanide-51.jpg)
|
_chloride_potassium_ferricyanide-52.jpg)
|
_chloride_potassium_ferricyanide-53.jpg)
|
_chloride_potassium_ferricyanide-54.jpg)
|
_chloride_potassium_ferricyanide-55.jpg)
|
_chloride_potassium_ferricyanide-56.jpg)
|
_chloride_potassium_ferricyanide-57.jpg)
|
_chloride_potassium_ferricyanide-58.jpg)
|
_chloride_potassium_ferricyanide-59.jpg)
|
|
Комментарии
К1
В книге "Справочник химика" / Редкол.: Никольский Б.П. и др. - 2-е изд., испр. - Л.: Химия, 1963. - Т. 2. - С. 64-64 упоминается вещество FeIII4FeII3[Fe(CN)6]6 - зеленые кристаллы, не растимые в воде, но растворимые в горячей соляной кислоте.
|