Chemistry and Chemists № 2 2024
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 2 2024 Journal of Chemists-Enthusiasts |
Hydrochloric acid dissolves copper metal - part 3, 4 Volodymyr M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Concentrated hydrochloric acid, air and copper metal - part 3
After the last experiment, I had difficulty interpreting the results. I turned to my colleagues for help. One of the chemists noted that in the previous experiment, discolouration of the solution isolated from air by a layer of hexane did not occur, since hexane dissolves air. Consequently, air passes through the layer of the organic liquid to the aqueous solution. (Let me remind you that this solution contained copper and hydrochloric acid this liquid was in contact with copper metal).
Концентрированная соляная кислота, воздух и металлическая медь - часть 3 This means that it is necessary to change the experimental conditions towards simplification, namely, not to pour a layer of hexane on top of the solution (under which the copper is located), but to seal the flask hermetically so that there is no air left above the solution layer. The first attempt ended with a cracked flask neck - I took a plastic stopper that was too hard and a volumetric flask with thin walls. But this is not a problem, since I used a more durable flask for the second attempt. I poured the solution into the flask, moved metal copper there, and sealed it hermetically so that no air was left above the liquid. So, the flask contained the brown-green solution with the copper wire at the bottom. I just have to wait and watch. 12 hours. The colour intensity of the solution decreased slightly. The colour of the solution was uniform over the entire height (the formation of two layers was not observed). 24 hours. I did not notice any changes. 2 days. The solution became significantly lighter. The colour was greenish-yellow, and the colour was uniform in height. 3 days. I did not notice any changes. 5 days. The solution became lighter. 6 days. I did not notice any changes. 8 days. I did not notice any changes. 12 days. The solution became significantly lighter and the colour was greenish-yellow. 17 days. I did not notice any changes. 38 days. I did not notice any changes. Thus, the solution in the hermetically sealed flask began slowly brightening, and then its colour stabilized. Long exposure of the solution over metallic copper did not lead to its discolouration. The solution of copper in hydrochloric acid remained light yellow; this suggested that an equilibrium had been established between complex copper ions and metallic copper inside the flask By the way, while the flask was standing, its outer walls became covered with a white coating of ammonium chloride, since I conducted experiments with ammonia in this room. I had to remove it several times to prevent the coating from interfering with filming. After completing the observation, I opened the flask to experiment with the resulting solution. I poured 120 ml of distilled water into a glass, added about three millilitres of the solution to the water and stirred, waiting for the formation of a precipitate of copper (I) chloride; however, a white precipitate did not form, and the solution did not even become cloudy. I added excess ammonia and stirred. The solution turned blue; this colour is characteristic of the ammonia complex of divalent copper, [Cu(NH3)4]2+. |

Concentrated hydrochloric acid, air and copper metal |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Concentrated hydrochloric acid, air and copper metal - part 4
After I opened the flask with hydrochloric acid and copper metal, which had been left hermetically sealed for over a month, I took a few millilitres of the solution for the experiments. The question arose, what should be done with the main volume of the solution?
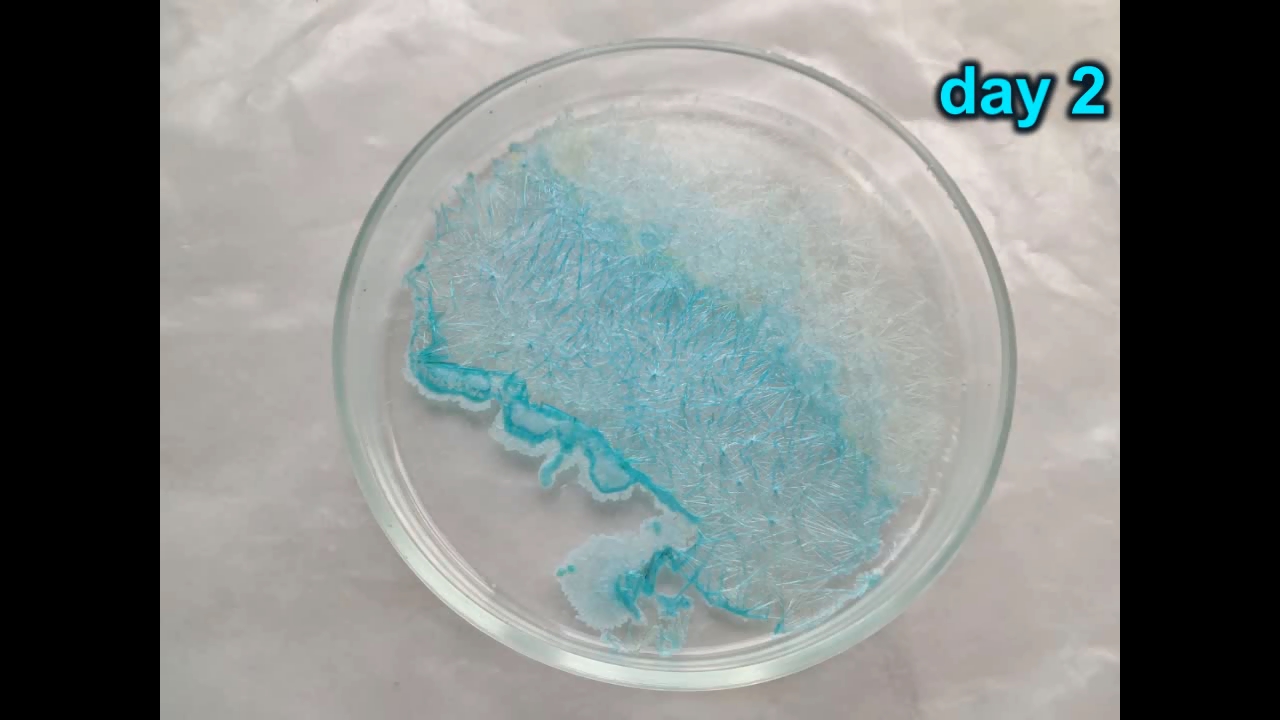
Концентрированная соляная кислота, воздух и металлическая медь - часть 4 I decided not to come up with complex experiments, but to observe the oxidation of monovalent copper in solution with air. To do this, I poured the solution (along with the copper wire) into a larger and wider flask, and covered it with a small flask (the same one in which I carried out the last experiment). As a result, there was enough air above the solution for the reaction to take place, but the hydrochloric acid vapours did not enter the room. A slight increase in colour intensity was noticeable after just a few minutes, and after 20 minutes the solution darkened significantly. After 1 hour, the solution was dark brown with a green tint. After 12 hours, the solution in the flask turned black (in a thin layer it was greenish-yellow). Near the bottom, I noticed a thin light layer of the solution, which disappeared after a slight shake of the flask and did not appear again. After 24 hours the solution was black and opaque. After 48 hours, the solution was black and opaque (greenish-yellow in a thin layer). Above the solution surface, green needle-shaped crystals formed on the walls of the flask. A small amount of the solution was poured into a Petri dish and left to evaporate in the air. Initially, the solution was dark brown, even in a thin layer. After a day, the solution became light, yellowish-green. After two days, the liquid had evaporated, leaving blue needle-shaped crystals [copper (II) chloride crystalline hydrate] in the dish. |

Concentrated hydrochloric acid, air and copper metal |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|

|
|
Комментарии
К1
Вроде как механизм взаимодействия меди с раствором хлорной меди рассмотрен в книге Э.Б. Хоботова, В.И. Ларин, Л.М. Егорова, В.В. Даценко, М.А. Добриян - ХИМИЧЕСКОЕ РАСТВОРЕНИЕ МЕДИ И ЕЕ СПЛАВОВ В РАСТВОРАХ РАЗЛИЧНОГО СОСТАВА И ОПТИМИЗАЦИЯ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ ТРАВЛЕНИЯ МЕТАЛЛОВ. Харьков, 2008
|