Chemistry and Chemists № 2 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 2 2025 Journal of Chemists-Enthusiasts |
Experiments with Thermite - pt.24, 25 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Combustion of Mixture: Lead(II, IV) Oxide/Aluminum (Pb3O4/Al) - Part 24
In previous experiments, the thermite mixtures contained iron oxide (Fe3O4), copper oxide (CuO), and calcium sulfate (CaSO4). I had another oxide available—lead(II, IV) oxide (Pb3O4), also known as red lead. Its formula is similar to that of iron(II, III) oxide (Fe3O4). Like iron oxides, Pb3O4 is used as an inorganic pigment. However, this is where the similarity between Fe3O4 and Pb3O4 ends.
Горение смеси: оксид свинца (II, IV)/алюминий (Al/ Pb3O4) - часть 24 Despite their similar formulas, Fe3O4 contains iron in the +2 and +3 oxidation states, while Pb3O4 contains lead in the +2 and +4 oxidation states. The oxidizing properties of Pb(IV) are much stronger than those of Fe(III). Similarly, Pb(II) is a stronger oxidizer than Fe(II). Therefore, a mixture of Pb3O4 and finely dispersed aluminum can explode when exposed to flame or mechanical shock. It is not surprising that in the reference table listing various thermite compositions, not a single mixture includes lead oxides [1]. Pb3O4 does appear in some compositions intended for thermite ignition, but even in these, it is not combined with aluminum or magnesium. I learned that a mixture of red lead and aluminum powder can explode when ignited or struck from a chemist friend of mine, who at the time worked as a forensic expert for the police. He prepared a mixture of Pb3O4 and aluminum pigment powder to demonstrate to his supervisor that it was indeed capable of exploding. Thus, an explosive device can be made simply by mixing two common pigments. Aluminum pigment powder ("silver paint") is a pigment consisting of small aluminum flakes with an average length of no more than 30 microns and a thickness of 0.2-0.5 microns. I planned to use aluminum powder with significantly larger particles (100-140 microns), so I expected the reaction to be violent, but not explosive. Another important difference between Fe3O4 and Pb3O4 is that lead is extremely toxic. Inhaling aerosols and vapors of lead compounds is unacceptable. Therefore, I decided to use only minimal amounts of the Pb3O4-Al mixture and to wear a respirator. The experiments were conducted outdoors. I calculated the stoichiometric ratio for the Pb3O4/Al mixture. Initially, I determined that 0.50 g of aluminum should be added to 9.50 g of lead oxide. However, these numbers seemed implausible, so I rechecked my calculations and discovered an error. The correct ratio is 9.05 g of Pb3O4 to 0.95 g of aluminum. Even so, the result felt counterintuitive—almost ten grams of lead oxide for every gram of aluminum. I searched for more information online and unexpectedly came across an article in our journal [2] that described experiments conducted by colleagues. It confirmed that my calculated Pb3O4/Al ratio was accurate. In their experiment, the colleagues placed a mixture of lead oxide and aluminum pigment powder in a plastic syringe, which exploded loudly and released a cloud of toxic smoke. Their test was conducted in a deserted area during peacetime. However, due to the ongoing war, loud noises can frighten people, as they are now associated with danger. To avoid the risk of an explosion, I decided not to place the mixture in a confined container. Additionally, I conducted the experiments outdoors due to the formation of toxic aerosols of lead compounds. To avoid inhaling these aerosols, I wore a respirator during the experiments. I weighed out 0.95 g of aluminum and 9.05 g of Pb3O4. The aluminum particles were 100-140 microns in size. I thoroughly mixed the powders on a sheet of paper, placed it on the ground, and ignited the mixture using a gas burner. It burned with a yellow flame and released a large amount of yellowish-gray smoke. The combustion was not vigorous. After the reaction, a yellowish-gray mass remained. The main products were metallic lead (gray) and aluminum oxide (white). The yellowish color was due to the formation of a small amount of lead(II) oxide (PbO). I repeated the experiment, this time doubling the quantities (1.9 g of aluminum and 18.1 g of Pb3O4). I poured the mixture into an open aluminum foil container and placed it in a sand-filled tray. The burner ignited the mixture, which again burned with a yellow flame, producing a large volume of yellowish-gray toxic smoke. Fortunately, the smoke quickly rose and dispersed. The combustion was again not violent and seemed less impressive than the Fe3O4/Al thermite reaction. __________________________________________________ 1 Combustion of Thermite: Iron(II, III) Oxide/Aluminum (Fe3O4/Al) - Part 5 [link] 2 Explosion of Mixture of Red Lead and Aluminum Powder / Взрыв смеси свинцового сурика и алюминиевой пудры [link] |
|
Горение смеси: оксид свинца (II, IV)/алюминий (Al/ Pb3O4) - часть 24
В предыдущих экспериментах термитные смеси содержали оксид железа Fe3O4, оксид меди CuO и сульфата кальция CaSO4. У меня был в наличии еще один оксид - оксид свинца (II, IV) Pb3O4 (известный также как свинцовый сурик). Он имеет формулу аналогичную формуле оксида железа (II, III) Fe3O4. Как и оксиды железа, оксид свинца (II, IV) Pb3O4 применяется в качестве неорганического пигмента. Однако на этом схожесть Fe3O4 и Pb3O4 заканчивается.
Несмотря на аналогичную химическую формулу, Fe3O4 содержит атомы железа в степени окисления +2 и +3, в то время как Pb3O4 - атомы свинца в степени окисления +2 и +4. Окислительные свойства у Pb(IV) выражены гораздо сильнее, чем у Fe(III). Аналогично Pb(II) - более сильный окислитель, чем Fe(II). Поэтому смесь оксида свинца (II, IV) с мелкодисперсным алюминием способна взрываться при действии пламени и ударе. Не удивительно, почему в таблице, в которой собрано много разнообразных составов термитов, не приведено ни одной композиции, содержащей оксиды свинца [1]. Оксид свинца Pb3O4 входит в некоторые составы, предназначенные для инициации термитов, но даже в этих смесях оксид свинца не сочетается с алюминием или магнием. О том, что смесь свинцового сурика и алюминиевой пудры взрывается при поджигании или ударе, я узнал от знакомого химика, который в то время работал экспертом в полиции. Он специально приготовил смесь оксида свинца Pb3O4 и алюминиевой пудры, чтобы доказать своему начальнику, что эта смесь взрывается. Следовательно, взрывное устройство можно изготовить, смешав два распространенных пигмента. Алюминиевая пудра ("серебрянка") представляет собой пигмент, состоящий из мелких алюминиевых чешуек, которые имеют среднюю длину не больше 30 микрон и толщину 0.2-0.5 микрон. Я планировал использовать алюминиевый порошок с существенно большим размером частиц (100-140 микрон), поэтому прогнозировал, что реакция произойдет бурно, но без взрыва. Еще одна важная разница между оксидом железа Fe3O4 и оксидом свинца Pb3O4 состоит в том, что свинец крайне токсичен. Вдыхать аэрозоль и пары соединений свинца недопустимо. Поэтому для эксперимента следует использовать минимальные количества смеси Pb3O4 - Al, а сам эксперимент необходимо проводить за пределами помещения, надев респиратор. Провел расчет стехиометрического состава смеси Pb3O4/Al. Получилось, что к 9.50 г оксида свинца необходимо добавить 0.50 г алюминия. Свинец имеет большую атомную массу, а алюминий - маленькую, но цифры все равно выглядели неправдоподобно. Проверил расчет, нашел ошибку. Правильное соотношение: 9.05 г оксида свинца - 0.95 г алюминия. Все равно цифры выглядели нереалистично - на каждый грамм алюминия необходимо добавить около десяти грамм оксида свинца. Стал искать информацию о данной смеси в интернете, - неожиданно наткнулся на статью в нашем журнале [2], в которой описаны эксперименты коллег. Оказалось, что соотношение Pb3O4/Al я рассчитал правильно. Коллеги использовали смесь оксида свинца и алюминиевой пудры. Смесь, помещенная в пластиковый шприц, громко взорвалась, образовав облако токсичного дыма. Коллеги провели эксперимент в безлюдной местности, в мирное время. Однако сейчас идет война, и звуки взрывов пугают людей, поскольку громкий звук теперь часто означает опасность. Чтобы избежать взрыва, решил не помещать смесь закрытую оболочку. Кроме того, эксперименты с данной смесью проводил на открытом воздухе ввиду образования токсичного аэрозоля соединений свинца. Чтобы не вдыхать данный аэрозоль, во время экспериментов я надевал респиратор. Взвесил 0.95 г алюминия и 9.05 г оксида свинца (II, IV). Размер частиц алюминия был 100-140 мкм. Вещества тщательно смешал на листе бумаги. Бумагу поместил на землю и направил на смесь пламя газовой горелки. Смесь загорелась желтым пламенем, образуя много желтовато-серого дыма. Горение не было бурным. После сгорания смеси осталась желтовато-серая масса. Основные продукты реакции - металлический свинец (серый) и оксид алюминия (белый). Желтоватый цвет обусловлен образованием небольшого количества оксида свинца (II) PbO. Повторил эксперимент, увеличив количество веществ вдвое [1.9 г алюминия и 18.1 г оксида свинца (II, IV)]. Смесь насыпал в открытый контейнер из алюминиевой фольги, которую поместил в лоток с сухим песком. Направил пламя горелки на смесь. Смесь воспламенилась и сгорела желтым пламенем, образуя много желтовато-серого токсичного дыма. К счастью, дым быстро поднялся вверх и рассеялся. Взаимодействие также не было бурным и выглядело менее эффектно, чем горение термита Fe3O4/Al. |

Combustion of Mixture: Lead(II, IV) Oxide/Aluminum (Pb3O4/Al) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
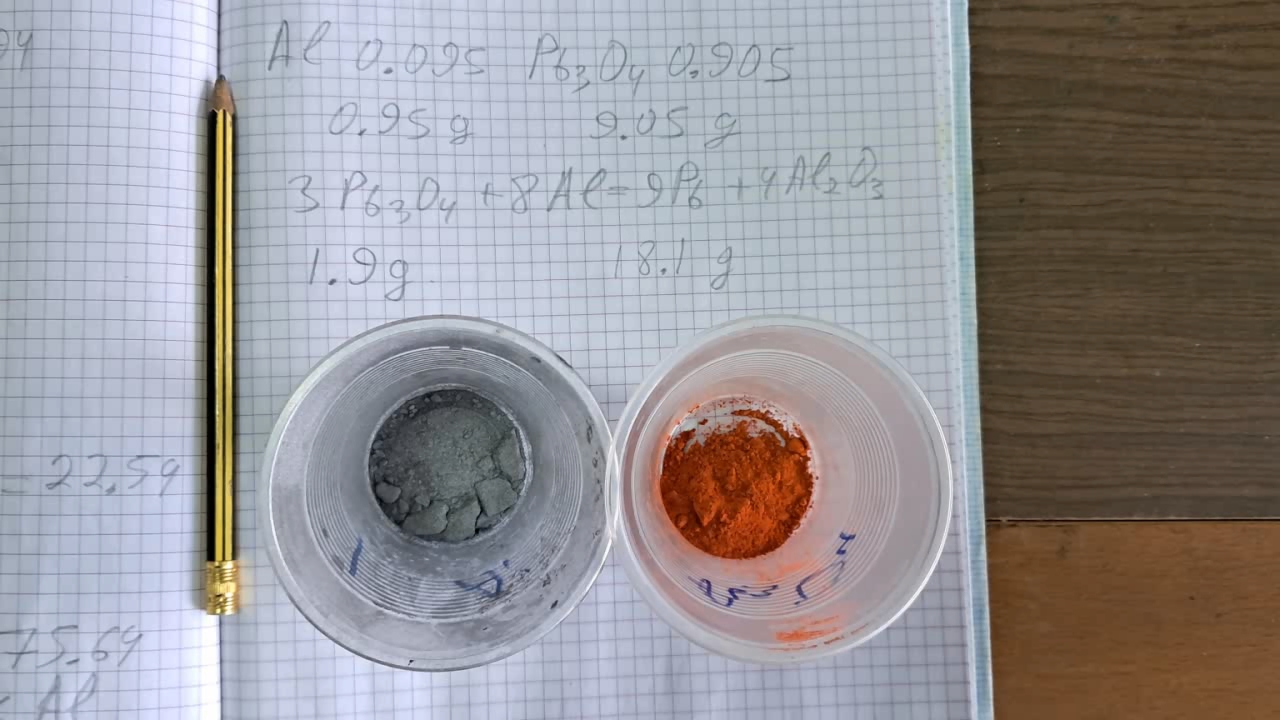
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Fe3O4/Al Thermite: Soot in Iron Oxide Iron(II, III) - Part 25
After conducting a series of experiments with thermite mixtures containing aluminum and iron oxide, I planned to test compositions using other metal oxides, as well as calcium and barium sulfates, as oxidizers. However, a colleague unexpectedly brought a kilogram of iron oxide pigment (Fe3O4) to the lab.
Термит Fe3O4/Al: сажа в оксиде железа (II, III) - часть 25 — I bought it on sale! There's a discount on this at the supermarket right now! Check if this iron oxide is suitable for thermite—if it is, I'll buy more. Three more packages are on sale! — Thanks, but there's no need to buy more. We're not a thermite research lab, so we don't need such a large amount of iron oxide. Since my colleague had already purchased the oxide, I decided to test whether it was suitable for thermite preparation. I weighed out and thoroughly mixed 10 g of aluminum (particle size: 100-140 microns) with 27.5 g of the oxide. The mixture was placed in a paper bag and compacted tightly in the palm of my hand. The bag was then placed on a tray with dry sand. I did not add an incendiary mixture, as I was confident the thermite would ignite from a gas burner flame. I directed the burner's strong flame at the thermite. The paper ignited and burned away, the thermite glowed red and then yellow—but it did not ignite. The dark gray surface of the thermite turned brown due to surface oxidation of Fe3O4 to Fe2O3. Next, I prepared an incendiary mixture consisting of 1 g of finely dispersed aluminum and 2.75 g of iron oxide (from a previously tested batch). I poured this mixture on top of the thermite and ignited it using the burner flame. A bright flash occurred, sparks flew, and smoke was released. The thermite burned completely in under 10 seconds, leaving behind a glowing yellow "lake" of molten material that gradually cooled on the sand. Much later, I realized I had never attempted to ignite Fe3O4/Al thermite (made with 100-140 micron aluminum particles) using just a gas burner flame. I had always used an incendiary mixture of iron oxide and finely dispersed aluminum for ignition. At the same time, I decided to test whether iron oxide containing soot would be suitable for thermite preparation. I had previously attempted to ignite Fe3O4/Al thermite made from soot-containing oxide, but it had failed to ignite—neither with a burner flame nor with incendiary mixtures of two different compositions. Perhaps I would have better luck this time? I repeated the procedure described earlier, but this time used Fe3O4 with added soot instead of the technical-grade iron oxide. I didn't even attempt to ignite the thermite directly with the burner. Instead, I placed an incendiary mixture on top and directed the gas burner flame at it. The incendiary mixture flared up, but the thermite did not ignite. After the incendiary mixture burned out, I directed a strong flame at the thermite and continued heating for a long time. As expected, the thermite still did not ignite. My hypothesis is as follows: soot particles coat the Fe3O4 particles, preventing them from reacting with the metallic aluminum. In the past, I had successfully ignited a loose mixture of finely dispersed aluminum and soot-containing iron oxide using a burner flame. However, in this experiment, the aluminum particles were larger, and the thermite was compacted. As a result, the thermite made with soot-containing iron oxide failed to ignite. |

Fe3O4/Al Thermite |

|

|

|

|

|

|

|

|

|

The thermite failed to ignite |

|

|

|

|

The incendiary mixture was added |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Fe3O4/Al Thermite: Soot in Iron Oxide Iron(II, III) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

The thermite made with soot-containing iron oxide failed to ignite (only the incendiary mixture flared) |

|

|

|

|

|